血清补体C3对原发性胆汁性胆管炎相关肝纤维化分期的诊断价值
周 辉, 牛 斌, 宓余强, 刘勇钢, 李 萍
1 天津医科大学第二人民医院临床学院, 天津 300070; 2 天津市第二人民医院 a.肝病科, b.病理科,天津 300192
原发性胆汁性胆管炎(PBC,旧称原发性胆汁性肝硬化)是一种慢性自身免疫性肝内胆汁淤积性疾病。尽管PBC 比较少见,但它对患者的生活质量和生存率有重大影响,且PBC 的全球患病率正呈现上升趋势[1]。由于长期胆汁淤积,PBC 可出现进行性肝纤维化、肝硬化,最终可演变为终末期肝病。免疫学相关指标通常用于PBC 的评估,本文主要分析了血清补体C3在PBC患者中的变化及其与肝纤维化分期的关系。
1 资料与方法
1.1 研究对象 选取2012年1月—2022年10月于天津市第二人民医院就诊并行肝穿刺活检的PBC 患者108 例。纳入标准:(1)符合PBC 诊断和治疗共识[2-3]的诊断标准;(2)进行肝穿刺活检;(3)在肝活检1周内行血清学检测;(4)临床资料完整。排除标准:(1)合并其他慢性肝病,如病毒性肝炎、自身免疫性肝炎、重叠综合征、原发性硬化性胆管炎、IgG4相关胆管炎、酒精性肝病、非酒精性脂肪肝、药物性肝损伤等;(2)肝移植者;(3)有恶性肿瘤史或其他终末期疾病者;(4)孕产妇;(5)患有影响血补体C3水平的相关疾病,如系统性红斑狼疮、银屑病、过敏性哮喘、非典型溶血性尿毒综合征、遗传性补体缺陷病等。
1.2 研究方法
1.2.1 观察指标 采用回顾性分析的方法,收集患者的一般人口学资料(年龄、性别、BMI 等)、临床表现(乏力、纳差、瘙痒等)、自身抗体指标(ANA、AMA、M2、Sp100、Gp210)、肝穿刺活检1 周内的血清学指标(PLT、ALT、AST、GGT、ALP、CHE、Alb、TBil、DBil、
IBil)、免疫功能指标(C3、C4、IgG、IgA、IgM)、肝纤维化指标(LSM)及无创肝纤维化评分[(AST/ALT比值指数(AAR)、AST/PLT 比值指数(APRI)和肝纤维化4 因子指数(FIB-4)]。
1.2.2 组织学评估 所有患者均在局部麻醉状态下,经超声引导进行肝组织穿刺,标本长度为1.0~2.0 cm。用10%中性福尔马林固定,石蜡包埋、切片,进行HE 染色、Masson 三色染色和网状纤维染色等。肝组织切片由两名对患者临床特征毫不知情且经验丰富的病理学家独立评估,采用Scheuer 评分系统[4]评估肝纤维化程度,其中≥S2 定义为显著肝纤维化;≥S3定义为进展期肝纤维化;S4定义为肝硬化。
1.3 统计学方法 采用SPSS 26.0 软件进行数据分析。符合正态分布的计量资料用xˉ±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用Bonferroni法。不符合正态分布的计量资料用M(P25~P75)表示,两组间比较采用Mann-WhitneyU检验;多组间比较采用Kruskal-WallisH秩和检验,进一步两两比较采用Bonferroni法。计数资料组间比较采用χ2检验或Fisher精确检验。绘制受试者工作特征曲线(ROC 曲线)评估补体C3 对PBC 患者肝纤维化的诊断效能,ROC 曲线下面积(AUC)的比较采用Delong 法。采用Spearman 相关分析评估补体C3 与肝纤维化分期的相关性。P<0.05 为差异有统计学意义。
2 结果
2.1 一般资料 本研究共纳入PBC患者108例,平均(53.6±10.4)岁。患者以女性居多87 例(80.6%),自身抗体阳性102 例(94.4%)。肝纤维化分期S0 期5 例(4.6%),S1 期41 例(38.0%),S2 期23 例(21.3%),S3期25例(23.1%)、S4期14例(13.0%)。患者的其他资料见表1。不同肝纤维化分期患者PLT、CHE、Alb、TBil、C3、IgA、LSM、AAR、APRI、FIB-4 比较,差异均具有统计学意义(P值均<0.05);进一步两两比较的结果显示,C3、LSM 在S3 与S0/1 之间差异均具有统计学意义(P值均<0.05),LSM 在S3 与S2 之间差异具有统计学 意 义(P<0.05),PLT、CHE、Alb、C3、LSM、AAR、APRI、FIB-4 在S4 与S0/1 之间差异均具有统计学意义(P值均<0.05),CHE、Alb、C3、IgA、LSM、AAR、FIB-4在S4 与S2 之间差异均具有统计学意义(P值均<0.05),CHE、Alb、C3、AAR、FIB-4 在S4 与S3 之间差异均具有统计学意义(P值均<0.05)(表2)。

表2 PBC患者肝纤维化分期的一般特征Table 2 General characteristics of hepatic fibrosis stage in patients with PBC
2.2 免疫功能对PBC 不同肝纤维化分期的诊断效能 免疫功能指标中C3、C4、IgG、IgA 及IgM 诊断显著肝纤维化的AUC 分别为0.731、0.529、0.583、0.520、0.562;免疫功能指标中C3、C4、IgG、IgA 及IgM 诊断进展期肝纤维化的AUC 分别为0.832、0.591、0.609、0.602、0.503;免疫功能指标中C3、C4、IgG、IgA 及IgM诊断肝硬化的AUC分别为0.968、0.687、0.604、0.739、0.638。综上所述,补体C3 对PBC 不同肝纤维化分期的诊断效能最佳(图1)。

图1 免疫功能指标与不同肝纤维化分期的ROC曲线Figure 1 ROC curves of immune function indexes and different stages of liver fibrosis
2.3 ROC曲线诊断补体C3的性能分析 ROC曲线显示显著肝纤维化分期(≥S2)中C3 的最佳截断值为1.445 g/L,诊断显著肝纤维化的敏感度为87.1%,特异度为52.2%(AUC=0.731,95%CI:0.637~0.812)(图1a)。因此,根据C3这一截断值水平来比较PBC患者的一般特征。高补体C3组(C3>1.445 g/L)PLT、GGT、ALP、Alb、TBil、C4明显高于低补体C3组(C3≤1.445 g/L)(P值均<0.05),高补体C3 组LSM、AAR、FIB-4 和纤维化分期明显低于低补体C3 组(P值均<0.05)。两组间其他参数均无显著差异(P值均>0.05)。
ROC曲线显示进展期肝纤维化分期(≥S3)中C3的最佳截断值为1.235 g/L,诊断进展期肝纤维化的敏感度为82.1%,特异度为71.0%(AUC=0.832,95%CI:0.748~0.897)(图1b)。因此,根据C3这一截断值水平来比较PBC 患者的一般特征。高补体C3 组(C3>1.235 g/L)PLT、GGT、CHE、Alb、C4 明显高于低补体C3 组(C3≤1.235 g/L)(P值均<0.05),高补体C3组IgG、LSM、AAR、FIB-4 和纤维化分期明显低于低补体C3 组(P值均<0.05)。两组间其他参数均无显著差异(P值均>0.05)。
ROC 曲线显示肝硬化分期(S4)中C3 的最佳截断值为1.005 g/L,诊断肝硬化的敏感度为100%,特异度为91.5%(AUC=0.968,95%CI:0.915~0.992)(图1c)。因此,根据C3这一截断值水平来比较PBC患者的一般特征。高补体C3 组(C3>1.005 g/L)PLT、CHE、Alb 和C4 明显高于低补体C3 组(C3≤1.005 g/L)(P值均<0.05),高补体C3 组IgA、LSM、AAR、APRI、FIB-4 和纤维化分期明显低于低补体C3组(P值均<0.05)。两组间其他参数均无显著差异(P值均>0.05)(表3)。
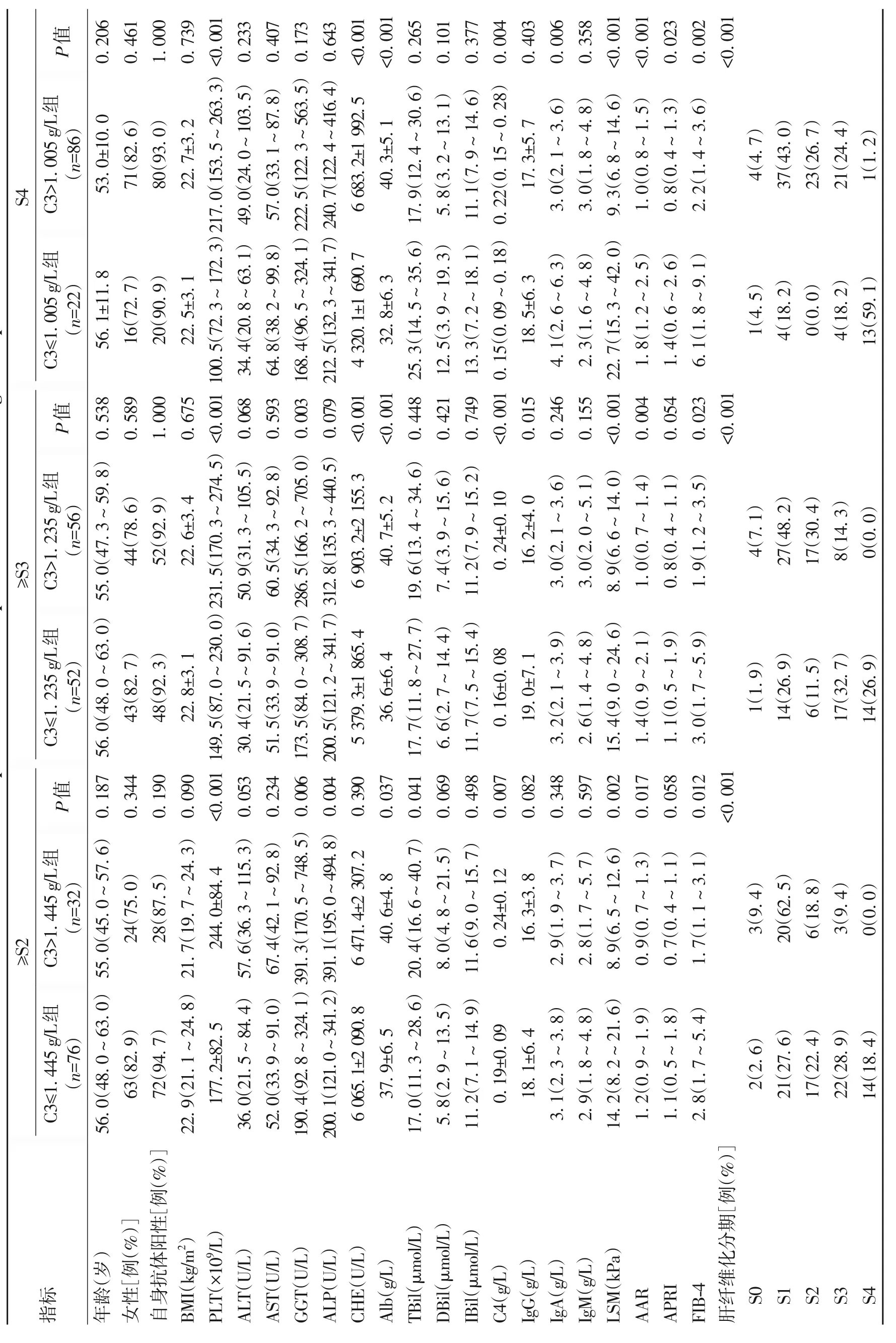
表3 不同肝纤维化分期患者补体C3 水平的一般特征Table 3 General characteristics of complement C3 levels in patients with different stages of hepatic fibrosis
2.4 补体C3与肝纤维化分期、肝硬度及三种无创肝纤维化评分的相关性 补体C3与肝纤维化分期的相关系数为-0.565(P<0.001),即肝纤维化分期越高,补体C3的水平越低(图2a)。LSM、AAR、APRI 及FIB-4 与补体C3 的相关系数分别为-0.439(P<0.001)、-0.323(P=0.001)、-0.206(P=0.033)和-0.291(P=0.002)(图2b~e)。相比于3种无创肝纤维化评分,C3与LSM的相关性更高。

图2 补体C3与肝纤维化分期、肝硬度及3种无创肝纤维化评分的相关性Figure 2 The correlation between C3 and liver fibrosis stage, LSM, AAR score, APRI score and FIB-4 score
2.5 补体C3 水平与不同肝纤维化分期的关系 单因素Logistic 回归分析显示PLT、CHE、C3、LSM、AAR和FIB-4 是与显著肝纤维化相关的危险因素;PLT、CHE、Alb、TBil、IBil、C3、LSM、AAR 和FIB-4 是进展期肝纤维化相关的危险因素;PLT、CHE、Alb、IBil、C3、C4、IgA、LSM、AAR 和FIB-4是肝硬化相关的危险因素(表4)。为了避免冗余和最大限度的提高统计能力,以P<0.1 为界限选取在单因素Logistic 回归中有意义的指标代入多因素Logistic 回归进一步计算。在分别调整了不同肝纤维化分期的纤维化相关混杂因素后,模型1、2、3、4中补体C3水平均为显著肝纤维化、进展期肝纤维化和肝硬化的独立预测因素,而LSM 是显著肝纤维化和进展期肝纤维化的独立预测因素(表5)。
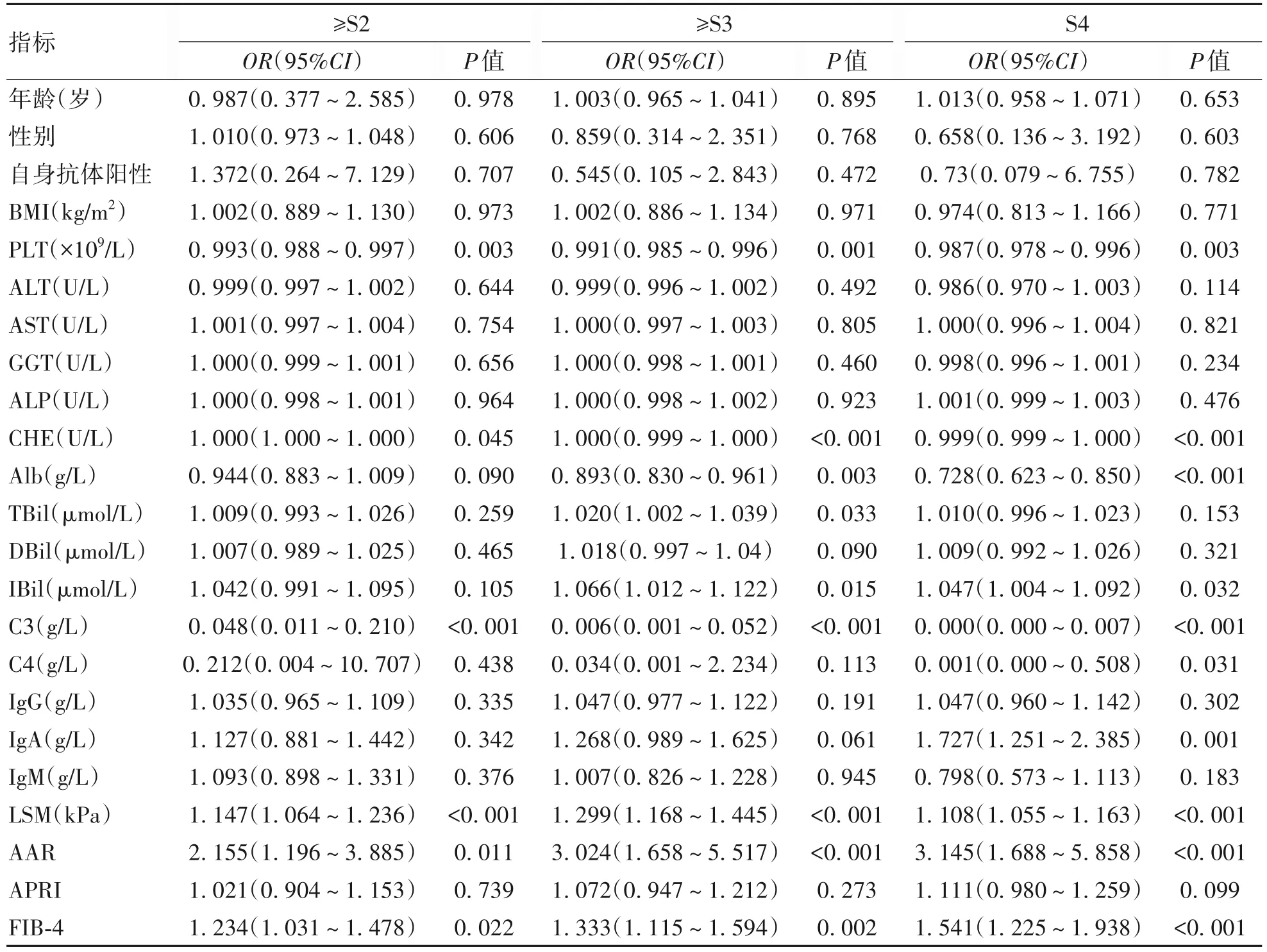
表4 不同肝纤维化分期指标的单因素分析Table 4 Univariate analysis of different liver fibrosis staging indicators

表5 不同肝纤维化分期调节混杂因素后指标的多因素分析Table 5 Multi-factor analysis of indicators after adjustment of confounding factors for different liver fibrosis stages
2.6 C3、LSM 及C3 联合LSM 对不同肝纤维化分期的诊断性能 C3、LSM及C3联合LSM诊断显著肝纤维化AUC 分别为0.731、0.764、0.811,最佳cut-off值分别为1.445、14.050、0.632,C3 联合LSM 诊断显著肝纤维化的AUC 与补体C3 的相比,差异具有统计学意义(Z=2.604,P=0.009)。C3、LSM及C3联合LSM诊断进展期肝纤维化AUC 分别为0.832、0.911、0.941,C3 联合LSM诊断进展期肝纤维化的AUC与补体C3的相比,差异具有统计学意义(Z=3.033,P=0.002)。C3、LSM 及C3 联合LSM 诊断肝硬化AUC 分别为0.968、0.910、0.976,C3 联合LSM 诊断肝硬化的AUC 与补体C3 相比,差异不具有统计学意义(Z=1.050,P=0.294),C3联合LSM诊断肝硬化的AUC与LSM相比,差异具有统计学意义(Z=2.326,P=0.020)(表6)。
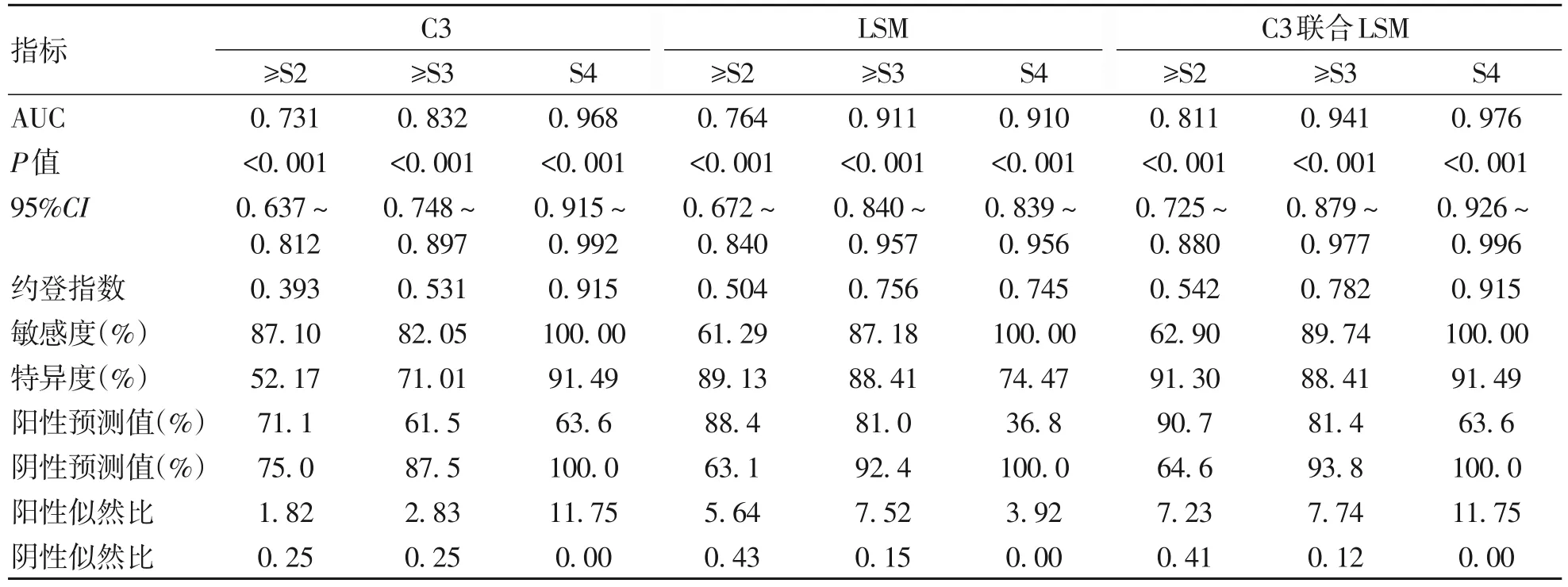
表6 C3、LSM及C3联合LSM对不同肝纤维化分期的诊断性能Table 6 Diagnostic performance of C3, LSM and C3 combined with LSM for different liver fibrosis stages
3 讨论
目前,PBC 的年发病率为0.84/10 万~2.75/10 万,患病率为1.91/10 万~40.2/10 万,且PBC 的全球患病率呈不断上升趋势[1,5]。PBC 患者早期无明显症状,主要表现为血清ALP、GGT 和AMA 的升高,部分患者会出现瘙痒、疲劳、黄疸等症状[6],与本研究调查结果一致。PBC 患者的临床预后与肝纤维化分期程度密切相关,如果没有得到早期诊断和有效的治疗,容易发展成肝硬化,甚至肝衰竭[7]。因此,寻找能有效评估肝纤维化程度的方法对PBC 的治疗及病情控制具有重要意义。目前,肝活检是评估PBC 肝纤维化分期的金标准,但其为有创操作且花费高,临床应用受到限制。一些肝纤维化无创诊断模型,如AAR、APRI 和FIB-4 等,以及瞬时弹性成像技术对肝纤维化有较高的诊断价值,然而上述模型都需要进一步完善。有研究[8]发现肝硬化患者的Child评分与补体C3水平呈负相关。还有研究[9-10]证实血清补体C3 水平能评估慢性乙型肝炎相关分期的严重程度,低补体C3 水平的失代偿性肝硬化患者容易发生慢加急性肝衰竭。这些研究表明补体C3 可能与肝纤维化分期相关,然而目前的研究主要关注于评估慢性乙型肝炎相关肝纤维化分期,关于PBC 患者肝纤维化程度评估的研究较少。基于此,本研究探讨了血清补体C3 对PBC 患者肝纤维化程度的诊断价值。
补体是存在于正常人和动物血清及组织液中的一组经活化后具有酶活性的蛋白质。补体的激活有3种途径:经典途径、替代途径和凝集素途径[11]。生理情况下能参与机体的抗感染免疫及扩大体液免疫反应,促进组织修复。当补体系统过度激活时,也可介导炎症反应,导致组织损伤,甚至器官衰竭。C3 是补体系统的中心分子,它的激活对于该系统执行的所有功能至关重要[12-13]。血清中存在的大部分补体蛋白是由肝脏产生和分泌的,其中C3 由肝细胞产生[14]。PBC是一种以小叶内胆管为靶点的自身免疫性肝脏疾病,其特点是超过90%的患者中存在自身抗体和高血清IgM[15]。然而,补体在PBC 中的作用只在有限数量的研究中被描述。根据本研究结果推测,补体C3 评估PBC 相关肝纤维化的可能机制有两个方面,分别是补体的生成减少和消耗增多。补体生成减少:已有研究[16-17]表明PBC患者处于急性炎症状态时,肝细胞出现明显损伤,补体蛋白的水平会比健康人群高。而持续的炎症刺激导致胆管破坏、胆管形态异常和分泌功能障碍,出现胆汁淤积,肝细胞损伤进一步加重,容易发展成纤维化和肝硬化[18]。当肝纤维化发生时,肝细胞功能严重受损,补体蛋白产生减少[19]。补体的消耗增多:PBC 患者在发生肝损伤时会伴随免疫应答反应,即生成抗原抗体复合物(IC),从而触发补体系统的激活和补体成分的过度消耗[10]。但有研究[20]指出,PBC 患者胆管内无补体C3的沉积,这表明补体C3可能没有通过经典途径被激活而直接参与到PBC 患者胆管损伤的过程。这可能是因为PBC 患者胆管中IC 沉积,诱发更多的C3 与其结合,同时黏附于表达补体受体1 的红细胞或血小板,然后运送至巨噬细胞被吞噬或清除,即免疫黏附作用导致血液循环中的补体C3水平下降。
本研究结果显示,随着肝纤维化程度的加重,补体C3 的水平呈下降趋势。相关性分析也证实了这一现象,补体C3水平与肝纤维化分期呈负相关。这与以往的研究结果一致[21]。此外,补体C3 水平与LSM、AAR、APRI 及FIB-4 纤维化评分也呈负相关。ROC 曲线分析显示,免疫功能指标中补体C3对PBC不同肝纤维化分期的诊断效能最佳。多因素Logistic 回归分析显示补体C3水平为显著肝纤维化、进展期肝纤维化和肝硬化的独立预测因素。因此,可以合理推断补体C3水平可以在一定程度上评估PBC 患者的肝纤维化程度。此外,ROC 曲线分析显示C3 联合LSM 诊断PBC患者显著肝纤维化、进展期肝纤维化的AUC与补体C3的相比,差异具有统计学意义;C3 联合LSM 诊断PBC患者肝硬化的AUC与LSM的相比,差异具有统计学意义。这提示C3 联合LSM 能进一步提高补体C3 或者LSM在诊断PBC患者肝纤维化分期程度时的效能。
综上所述,补体C3 作为一种易获取且不易受药物因素影响的血清学指标,在评估PBC 患者肝纤维化程度方面具有重要的临床价值,C3 联合LSM 后诊断效能更加显著。本研究局限性:(1)是一项单中心、小样本、回顾性研究,患者的选择可能出现偏差。未来应开展多中心、大样本、前瞻性研究进一步验证补体C3水平及C3联合LSM对PBC患者肝纤维化程度的诊断价值。(2)目前的研究结果不能准确的判断补体C3水平和PBC 患者肝纤维化发生的因果关系。(3)PBC目前还是一种罕见病,临床收集的样本量较少,尤其是肝穿刺确诊的PBC 患者样本量更少,所以统计结果可能会出现偏倚。
伦理学声明:本研究方案于2019年12月25日经由天津市第二人民医院伦理委员会审批,批号:[2019]58。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:周辉负责收集数据、资料分析及撰写论文;牛斌负责收集数据和指导统计分析;宓余强负责指导文章撰写;刘勇钢负责病理评分;李萍负责课题设计和最后定稿。

