鸭疫里默杆菌LAMP-LFD快速检测方法的建立与初步应用
龙宥茨,顾庆林,鲜思美,2*,周 飘,梁 倩,郑维豪,吴 琴
(1.贵州大学 动物科学学院,贵州 贵阳 550025;2.贵州省动物疫病研究所,贵州 贵阳 550025)
鸭疫里默杆菌病(Riemerellaanatipestiferinfection)是由鸭疫里默杆菌(Riemerellaanatipestfer,RA)引起鸭、鹅、及火鸡等多种禽类的一种接触性、急性、高致病性传染病,主要感染雏禽,其中雏鸭最易感[1]。该病传播途径多样,主要通过消化道、呼吸道以及皮肤破损感染,也可见应激反应诱发该病[2]。近几年已有多个地区暴发,给养禽业造成了严重的经济损失[3-4]。因此,建立一种针对RA快速、简便的诊断方法,可达到早发现、早预防的目的。
环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)是一种在恒温60~65℃条件下,针对靶基因序列设计2对特异性内、外引物,利用Bst DNA 2.0 聚合酶的链置换作用及识别延伸效应实现核酸大量且快速扩增的方法[5-6]。LAMP反应产物通常需通过琼脂糖凝胶电泳和浊度仪等判读结果,但存在易导致假阳性、仪器价格昂贵、不便于在基层应用等缺点[7]。本研究基于LAMP扩增原理结合横向流动试纸条(lateral flow dipstick,LFD),其原理是通过由异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的探针与生物素标记的LAMP扩增产物特异性杂交,在LFD上完成显色和结果判断[8]。该方法操作简便、特异性及敏感度较强、无需EB等有毒试剂、不依赖仪器设备等优点[8-9]。目前LAMP-LFD检测技术已被应用于禽腺病毒血清型-4[10]、羊口疮病毒[11]、猪肺炎支原体[12]等多种病原的检测。基于以上技术,本研究以RA的ompA基因为靶基因,经过对LAMP体系的优化,建立一种用于检测RA的新型等温扩增方法(LAMP-LFD),旨在为临床鸭疫里默杆菌病的实地、快速诊断提供技术支持。
1 材料与方法
1.1 主要材料pMD 19-T-ompA重组质粒、致病性大肠杆菌(Escherichiacoli,E.coli)、禽沙门菌(Salmonellaenteriditis,SE)、RA、多杀性巴氏杆菌(Pasteurellamultocida,Pm)、葡萄球菌(Staphylococcus)、鸭瘟病毒(duck plague virus,DPV),22份疑似鸭疫里默杆菌病病料均由贵州大学动物疫病研究室保存。
1.2 主要试剂Bst DNA 2.0 聚合酶购自NEB公司;dNTP Mix、DNA/RNA 共提取试剂盒均购自天根生化科技(北京)有限公司;质粒小量提取试剂盒购自OMEGA有限公司;横向流动试纸条购自Millenia Biotec GmbH公司。
1.3 引物设计与合成根据GenBank中登录的鸭疫里默杆菌ompA基因序列(登录号:FJ765044)设计特异性引物和探针,在上游内引物RA-FIP的5′端用BIO标记;同时设计合成1条经FITC标记的特异性探针RA-HP,用于LFD的杂交试验(表1),引物和探针由上海生工生物工程股份有限公司合成。

表1 引物及探针序列
1.4 核酸提取根据质粒小量提取试剂盒说明书提取 pMD19-T-ompA质粒DNA,根据 TIANamp Bacteria DNA Kit说明书提取RA、Pm、E.coli、SE、Staphylococcus、DPV的DNA,将所提取的DNA于-20℃保存备用。
1.5 LAMP-LFD 反应体系的优化和建立
1.5.1LAMP反应体系的建立 参照文献[11],建立25 μL LAMP 反应体系:1 μL Bst DNA 2.0聚合酶、2.5 μL ThermoPol buffer(10×)、3.5 μL dNTPs、内引物BIP/FIP各1 μL、外引物F3/B3各2 μL、2 μL DNA模板、1.5 μL MgSO4、8.5 μL ddH2O,将以上混合物振荡离心后于64℃反应1 h,再用80℃热激5 min,使酶失活停止反应。
1.5.2LAMP反应条件的优化 LAMP反应条件的优化需选择不同的内、外引物浓度比、时间、温度、dNTPs浓度以及Bst DNA聚合酶浓度和Mg2+浓度,同时设置阴性对照,反应后扩增产物通过琼脂糖凝胶电泳(AGE)观察结果。以上述体系为基准,以pMD19-T-ompA质粒DNA为模板,通过控制变量法,依次改变内、外引物浓度比(1∶1,2∶1,4∶1,8∶1,16∶1,32∶1)、反应温度(60,61,62,63,63,64,65℃)、反应时间(10,20,30,40,50,60 min)进行LAMP扩增反应,依据AGE扩增效果分别选取最佳反应条件。以dNTPs浓度梯度(1.5,2.0,2.5,3.0,3.5,4.0 mmol/L)、Bst DNA聚合酶浓度梯度(0.25,0.50,0.75,1.00,1.25,1.50 mmol/L)以及Mg2+浓度梯度(2,4,6,8,10,12 mmol/L)进行扩增,选取各试剂的最佳反应浓度。
1.5.3LAMP扩增产物的LFD检测 对LAMP反应体系进行优化后,使用BIO标记的RA-FIP进行LAMP反应,反应结束时不经过终止反应,在反应体系中加入20 pmol探针RA-HP,63℃杂交5 min。杂交结束后,从反应液中取8 μL杂交液加入到100 μL缓冲液中混匀,将试纸条浸入其中,静置3 min 观察质控线与检测线的颜色变化,若是质控线与检测线均为红色,可判定为阳性;若是质控线为红色,检测线无色,可判定为阴性;若是质控线无色,则判定结果无效。
1.6 LAMP-LFD特异性试验分别以RA、Pm、E.coli、SE、Staphylococcus、DPV的DNA为模板进行LAMP扩增,利用AGE和LFD分别检测扩增产物,设立阴性对照,分析该方法的特异性。
1.7 LAMP-LFD敏感性试验将提取的pMD19-T-ompA质粒DNA进行连续10倍梯度稀释,以1.83×107~1.83×100copies/μL的8个连续梯度浓度的质粒DNA为模板,设置阴性对照,利用优化的LAMP反应体系进行扩增,扩增产物用AGE及LFD检测;同时将相同模板利用外游引物建立PCR方法,PCR反应条件:95℃ 3 min;95℃ 30 s,52℃ 30 s,72℃ 45 s,35个循环,72℃ 10 min,扩增产物用AGE检测。比较LAMP、LAMP-LFD和PCR方法的敏感性。。
1.8 临床样品检测提取采集的22份临床疑似鸭疫里默杆菌病样品DNA,分别进行LAMP-LFD和PCR检测,同时设立阴、阳性对照。
2 结果
2.1 LAMP反应条件的优化在LAMP-LFD反应体系优化中,当内、外引物浓度比为4∶1时,目的条带最亮(图1A);当反应温度为64℃时(图1B),电泳图呈现清晰明亮的梯度条带;当反应时间为30 min时(图1C),目的条带最亮;当dNTPs浓度为2.5 mmol/L时(图1D),目的条带最明亮;当Bst DNA 2.0聚合酶浓度为0.25 mmol/L时(图1E),目的条带较为清晰,当Mg2+浓度为6 mmol/L时(图1F),目的条带最亮。以上结果显示可确定最终LAMP反应体系及反应条件:1.0 μL Bst DNA2.0聚合酶、2.5 μL ThermoPol buffer(10×)、3.5 μL dNTPs 、1.0 μL内引物BIP/FIP、0.5 μL外引物F3/B3、2.0 μL DNA模板、1.5 μL Mg2+溶液、11.5 μL ddH2O,反应时间为30 min,反应温度为64℃。
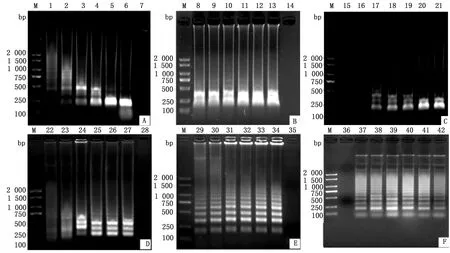
A.内、外引物浓度比优化试验(M.DL2000 DNA Marker;1~6.1∶1,2∶1,4∶1,8∶1,16∶1,32∶1;7.阴性对照);B.反应温度优化试验(M.DL2000 DNA Marker;8~13. 60,61,62,63,64,65℃;14.阴性对照);C.反应时间优化试验(M.DL2000 DNA Marker;16~21.10,20,30,40,50,60 min;15.阴性对照);D.Bst DNA聚合酶浓度优化试验(M.DL2000 DNA Marker;22~27.0.25,0.50,0.75,1.00,1.25,1.50 mmol/L;28.阴性对照);E. dNTPs浓度优化试验(M.DL2000 DNA Marker;29~34.1.5,2.0,2.5,3.0,3.5,4.0 mmol/L;35.阴性对照);F.Mg2+浓度优化试验(M.DL2000 DNA Marker;37~42.2,4,6,8,10,12 mmol/L;36.阴性对照)
2.2 LAMP-LFD特异性试验在同一反应条件下,分别以RA、Pm、E.coli、SE、Staphylococcus、DPV的DNA为模板进行LAMP扩增,结果显示:仅有以RA为模板的LAMP扩增产物经AGE和LFD检测为阳性,其他模板及阴性对照均为阴性(图2),表明该方法具有良好的特异性。

M.DL2000 DNA Marker;1~6.分别为RA、Pm、E.coli、SE、Staphylococcus、DPV;7.阴性对照
2.3 LAMP-LFD敏感性试验将提取的PMD19-T-ompA质粒DNA进行连续10倍梯度稀释,以相同模板分别进行LAMP及PCR扩增。结果表明,LAMP扩增后,AGE和LFD 的检最低模板浓度为1.83×100copies/μL,而PCR扩增后,最低模板浓度为1.83×103copies/μL,因此LAMP-LFD方法的敏感度是PCR方法的1 000倍(图3)。
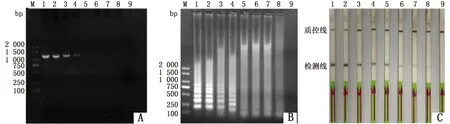
M.DL2000 DNA Marker;1~8.1.83×107~1.83×100 copies/μL;9.阴性对照
2.4 临床检测结果利用本研究建立的LAMP-LFD方法及PCR方法对临床22份疑似鸭疫里默杆菌病临床样本进行检测,结果显示,LAMP-LFD检测结果与PCR检测结果一致,阳性样本数均为14份(图4)。2种方法检测符合率达100%,表明本研究建立的LAMP-LFD方法可应用于临床诊断。
3 讨论
我国禽类养殖地区患鸭疫里默杆菌病的概率呈逐年上升趋势,特别是在幼禽养殖期间的发病率及病死率极高,并且病菌有着多型性和耐药性较强的特点,导致病情易反复、难以根治,极大阻碍禽类养殖业的发展[2,4,13]。目前已有多种方法可以对RA感染进行检测,病原学检测方面有细菌的分离鉴定、常规PCR和实时荧光定量PCR等;血清学检测方法有凝集试验、ELISA等,这些方法检测周期长、操作繁琐、依赖仪器设备、易出现假阳性,针对检测技术的实用性和推广性来说,以上方法还存在不足[2-3]。因此建立快速、简便、敏感、特异、可视化的检测方法对疾病的基层检测与综合防制至关重要。外膜蛋白A(OmpA)作为RA的主要外膜蛋白,其基因序列具有高度的同源性和保守性,且众多RA血清型菌株均含此基因序列[14-15]。因此,本研究以RA 的ompA基因为靶基因,建立高效特异检测RA的 LAMP-LFD方法,对该病的诊断及防制具有重要意义。
本研究针对ompA基因序列设计4条LAMP特异性引物,优化条件后,用于LAMP-LFD检测。结果表明,在64℃下运用LAMP扩增核酸到LFD结果判读只需33 min即可肉眼观察;MEI等[16]建立检测沙门菌的LAMP-LFD方法,65℃、40 min完成反应;杨倩等[11]建立检测羊口疮病毒的LAMP-LFD方法,64℃扩增40 min即可观察结果,而CHANG等[17]建立检测RA的PCR方法需高温变性、时间长(≥1 h);与PCR相比,LAMP-LFD具有耗费时间减少、全程恒温、不依赖专业仪器设备且结果可视化等明显优势。
本研究建立的LAMP-LFD特异性强,与Pm、E.coli、SE、Staphylococcus、DPV无交叉反应。LAMP-LFD的敏感度与LAMP-AGE的敏感度最低检测浓度均为1.83×100copies/μL,敏感性是PCR的1 000倍,但AGE需等待30 min以上,而LFD检测扩增产物只需3 min左右;柴书军等[18]建立检测猪细小病毒LAMP-LFD的最低检测限为1×10 copies/μL; ZHAI等[10]建立检测禽腺病毒血清型-4的LAMP-LFD方法的最低检测浓度均为1×10 copies/μL,表明LAMP-LFD敏感度高,且LFD比AGE具有操作简单、时间短的优势。将LAMP-LFD和PCR方法用于检测疑似鸭疫里默杆菌病临床样本,2种方法检测结果一致,表明了LAMP-LFD检测方法的可靠性和实用性。
吴彤等[19]建立检测RA的LAMP方法,63℃扩增60 min后,通过显色剂(SubgreenⅠ+HNB)和AGE判读结果。目前,LAMP扩增产物检测方法通常有琼脂糖凝胶(AGE)、浊度仪、荧光染料等,但这些方法有气溶胶污染、易假阳性、依赖仪器、有毒试剂、费时、存在主观影响、实验室条件限制等缺陷[20-21],而LAMP技术联合LFD试纸条,利用FITC标记的探针与被标记在扩增产物上的Biotin进行特异性杂交,短时间内即可肉眼观察,在保证检测特异性与敏感性的前提下,避免了其他检测方法的缺点。
综上,本研究根据RA的ompA基因建立的LAMP-LFD技术,能够特异性地检测RA,检测时间只需33 min,且该方法特异强、敏感度高,临床样本检出与常规PCR符合率一致,适用性强、结果判读可视化,在RA的现场及基层检测等领域的应用前景广阔。

