同期有氧与抗阻训练对老年小鼠快缩型骨骼肌蛋白质合成的影响
王世香 赵艳 尚画雨 王前进 丁孝民 刘绍生 夏志
1 井冈山大学体育学院(吉安 343009)
2 温州大学体育与健康学院(温州 325035)
3 成都体育学院运动医学与健康学院(成都 610041)
4 温州医科大学体育科学学院(温州 325035)
衰老性骨骼肌萎缩(age-related sarcopenia)是65岁及以上老年人群的多发病症[1,2],主要表现为快缩型骨骼肌质量与功能的进行性衰退,其发生发展可致老年人跌倒、残疾甚至死亡的风险显著增加,并与住院费用的增长独立相关[3]。随着人口老龄化速度的加快和平均预期寿命的提高,衰老性骨骼肌萎缩给家庭与社会造成的精神或经济负担将日趋严重。然而,其临床治疗迄今尚无公认标准与指引,现有药物及干预手段亦未能有效应对其进展[4,5]。
衰老性骨骼肌萎缩主要表现为快缩型骨骼肌的退行性变化,蛋白质平衡紊乱是其根本诱因[5-7],蛋白质合成减少则直接导致其发生与发展[8]。运动是强有力的蛋白质合成刺激[9],抗阻训练可使衰老骨骼肌质量增加高达21%[10],而肌力增幅则可达90%[11];越来越多的研究指出有氧运动具有类似作用[12,13],我们近期的一些研究亦佐证了这一观点[14-16]。既然抗阻与有氧运动均能促进蛋白质合成,若同时施加两种运动干预,能否发挥显著的衰老性骨骼肌萎缩干预效应?此问题尚有待明确。有零星研究提示,同期训练(指一种将力量与耐力素质的任务安排在相同训练时期的训练模式)可增强骨骼肌响应抗阻刺激时的合成反应,产生显著的蛋白质正性平衡、骨骼肌肥大及功能促进[6]。由此,我们推测同期运动训练干预亦有防治衰老性骨骼肌萎缩的重要潜力。
基于上述考虑,本研究观察同期运动训练干预对自然衰老小鼠快缩型骨骼肌蛋白质合成水平与功能的影响,考量其防治衰老性骨骼肌萎缩与功能衰退的潜力。通过观察骨骼肌蛋白质合成调节中关键信号通路蛋白哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)Ser2448 位点、p70 核糖体蛋白S6 激酶(p70 ribosomal protein S6 kinase,p70S6K)Thr389位点与真核翻译起始因子4E 结合蛋白1(eukaryotic translation initiation factor 4E binding protein 1,4EBP1)Thr37/46 位点的磷酸化表达及Ⅱb 型肌球蛋白重链(myosin heavy chain Ⅱb,MHCⅡb)蛋白表达变化进行间接评价,并探讨其潜在作用机制。
1 材料与方法
1.1 实验动物与分组
雄性SPF级C57BL/6小鼠,由成都达硕实验动物科技有限公司提供,合格证号:SCXK(川)2015-030。3月龄体成熟青年鼠8只纳入青年对照(young control,YC)组,体重28~29 g);非退役种鼠16只饲养至16月龄后据体重随机纳入衰老对照(aging control,AC)与运动干预(aging with endurance and resistance exercise,AER)组,每组8 只(体重33~36 g)。小鼠自由摄食饮水,室温22℃± 1.5℃,室内照明控制为12小时光暗循环周期。研究经井冈山大学医学伦理委员会审批通过(2019伦批第5号)。
1.2 主要仪器与试剂
电泳仪购自美国Bio-Rad 伯乐生命医学产品有限公司,Mini P-4 电泳槽购自北京凯元信瑞仪器有限公司,YSL-13A小动物抓握力计购自济南益延科技有限公司。蛋白提取试剂(T-PER™,78510)、定量试剂盒(Pierce™Coomassie,23200)购自美国Thermo赛默飞世尔科技公司;mTOR(2972S)、P-mTORSer2448(2971S)、p70S6K(9202S)、P- p70S6KThr389(9205S)、4E- BP1(9452S)和P-4E-BP1Thr37/46(9459S)一抗均购自美国CST赛信通生物试剂有限公司,MHCⅡb(20140-1-AP)一抗购自武汉三鹰生物技术有限公司,Puromycin(嘌呤霉素,EQ0001)一抗购自美国Kerafast凯拉法斯特公司,嘌呤霉素(T2219)购自美国Targetmol陶素生化科技公司。
1.3 运动方案
运动方案参照我们前期的报道进行设置[14,17],训练组小鼠接受为期8 周的运动干预,每周训练6 天,周日休息。根据Murach 等[13]的研究结论,有氧与抗阻运动干预应间隔6~24 小时,故每周一、三、五进行有氧训练,二、四、六进行抗阻训练以减少两种训练手段之间的干扰。为减少应激,有氧与抗阻训练均采用水中运动方式,水温控制在30°C±2°C。其中,有氧运动采用3%体重比例负荷,每日训练45分钟[14]。我们此前的报道已表明,以此负荷运动后小鼠血乳酸水平均介于2.9~3.7 mmol/l 范围内,为典型有氧运动[16];抗阻运动采用递增负荷方案,训练时用透明管材将泳池分隔为8个独立泳区,最初以40%体重负荷,每周增加2.5%比例至50%后固定不变。每次运动10组,每组30 s,组间休息1分钟[17]。因为负重过大,小鼠难以保持头部露出水面,因此需后肢用力蹬踏缸底跃出水面以保证呼吸。30秒内,小鼠将完成8~10次跳跃,根据我们前期关于实验动物抗阻训练模型的分析结果,这一方案为典型无氧、抗阻型运动[18]。
1.4 取样
运动组小鼠末次训练后间隔24 小时(期间禁食6小时,以减少小鼠末次进食时间差异对骨骼肌蛋白质代谢水平的混杂影响),各组小鼠称重后以100 mg/kg体重剂量腹腔注射戊巴比妥钠进行麻醉。注射10 分钟后以40 μmol/kg体重剂量腹腔注射蛋白质合成测试标记物嘌呤霉素,待吸收35 分钟后处死全部小鼠,分离双侧趾长伸肌与胫骨前肌。肌样用生理盐水冲洗后,滤纸吸干、称重。鉴于两种肌样总量的限制,故切取胫骨前肌部分肌样置于4%多聚甲醛中固定后用于组织形态学分析,趾长伸肌与剩余胫骨前肌肌样则经液氮速冻后用锡纸包裹并装入冻存管中,-80℃超低温冰箱保存待测。
1.5 测试指标与方法
1.5.1 网屏测试
采用网屏测试[19]评价小鼠神经肌肉力量与协调性。在30 cm 高亚克力板材箱上放置一个50 cm×50 cm的网屏,网格开口1.0 cm×1.0 cm,箱底放置海绵垫进行小鼠落地缓冲。将各组测试小鼠置于网格中心后将网屏旋转倒置,记录小鼠从网屏上松开四肢坠落至海绵垫前的悬吊时间。于运动干预前和干预后每周日进行测试,每只小鼠测试3 次,测试间隔30 分钟,以最长悬吊时间为准。
1.5.2 肌力测试
采用小鼠后肢抓握力评价骨骼肌肌力,实验前测定小鼠后肢抓握力作为基线值,运动干预期每周日进行重复测量。测试方法参照我们的前期报道[20]:用软管套住小鼠前爪使其不能抓握,提起鼠尾待其后肢抓紧测力板抓握杆后缓慢、持续地水平向后拉动,当双侧后肢同时松开抓握杆时记录显示数值。每只小鼠视测试表现重复6~10次,以最大值为准。
1.5.3 力竭游泳测试
为避免于取样前进行力竭游泳对其它检测指标产生混杂影响,故于第7周周日以5%体重比例负荷进行测试,用于评价小鼠体能。测试时控制水深在35 cm以上,从而避免小鼠以尾尖支撑缸底进行休息。出现漂浮或“集团游泳”等消极表现时立即进行驱赶。当小鼠游泳动作明显失调,不能继续坚持运动,或沉入水中3秒仍不能回到水面时,视为达到力竭状态[21]。
1.5.4 肌原纤维与肌浆蛋白定量
定量方法参照我们的前期报道[16],将待测骨骼肌样本在预冷缓冲液内匀浆后以600×g 转速离心20 分钟,分离出富含肌原纤维蛋白的沉降物。上清则继续以100000×g 4℃离心60分钟,分离出肌浆蛋白。Bradford法进行蛋白定量。
1.5.5 蛋白质合成率
使用嘌呤霉素表面标记翻译法(Surface sensing of translation,SUnSET)测定体蛋白合成率。肌样匀浆后的混悬液4℃2000×g离心3分钟,以20 μg蛋白质样品进行电泳。转膜并封闭后,4℃与抗嘌呤霉素抗体(1∶2000)孵育过夜。洗膜后,在二抗中孵育1小时(1∶10000)。其它操作同免疫印迹。
1.5.6 免疫印迹
肌样剪成碎粒,加入蛋白提取试剂并进行匀浆。混悬液于4℃12000×g离心20分钟取上清。蛋白定量后以120 μg 上样量标准进行分装,加入PBS 补足20 μl。加入5×蛋白上样缓冲液变性10分钟。配置5%浓缩胶与15%分离胶,浓缩胶80 V 恒压30~40 分钟,分离胶120 V 恒压,溴酚蓝至板底后停止。转膜时恒流300 mA,据分子量大小而转膜不同时间,其中MHCⅡb为150分钟,mTORSer2448蛋白总量与磷酸化表达均为120分钟,p70S6KThr389蛋白总量与磷酸化表达均为60分钟,4E-BP1Thr37/46总量与磷酸化表达均为30 分钟。封闭后分别进行一抗(MHCⅡb 1∶1000、mTOR 1∶1000、mTORSer24481∶1000、p70S6K1∶2000、p70S6KThr3891∶500、4E-BP1Thr37/461∶1000、4E-BP1Thr37/461∶1000)和二抗(1∶50000-1∶200000)孵育。读取灰度值后,以目的蛋白灰度值/内参灰度值计算蛋白表达量,以磷酸化蛋白表达量/总蛋白表达量计算磷酸化率,组间差异采用对照组目的蛋白相对表达量进行校正后再作比较[16]。
1.6 统计学分析
数据采用Shapiro-Wilk 分析进行正态分布检验,Levene 分析进行方差齐性检验。数据呈严重偏态时,进行数据转换后再次统计,若不能转换至近似正态分布,则采用Kruskal-Wallis非参数检验方法进行统计分析。若Levene 检验结果P<0.05,直接采用Tamhane’s T2基于t检验的保守成对比较结果。对于满足近似正态分布和方差齐性条件的数据则直接采用方差分析进行统计,组间多重比较采用Bonferroni法。实验期内网屏悬吊时间与肌肉力量的时程变化采用重复测量方差分析进行统计,未通过球形检验时,Epsilon校正系数参考Greenhouse-Geisse 的校正结果,Epsilon 校正系数小于0.7时采用Bonferroni法调节置信区间,大于0.7则采用Tukey 法。所有数据均以均数± 标准差(±s)表示,当P<0.05时认为数据差异具有统计学意义。
2 结果
2.1 一般情况比较
与YC 组小鼠毛发浓密油亮、反应敏捷迅速、日常活动性强等特点相比,AC 与AER 组小鼠毛发稀疏暗淡,反应迟钝,体重较重且活动性差。
2.2 蛋白质合成水平差异比较
2.2.1 蛋白质总量及肌原纤维与肌浆蛋白含量
AC 组与AER 组小鼠骨骼肌蛋白质总量均显著低于YC 组(P<0.01),AER 组小鼠较AC 组高15.2%(P<0.01)(图1A)。AC组与AER组小鼠骨骼肌肌原纤维蛋白含量显著低于YC组(P<0.01),AER组小鼠肌原纤维蛋白含量较AC 组高15.0%(P<0.01)(图1B)。就肌浆蛋白含量而言,除AC 组显著低于YC 组小鼠外(P<0.05),其它组间比较差异未见统计学意义(图1C)。
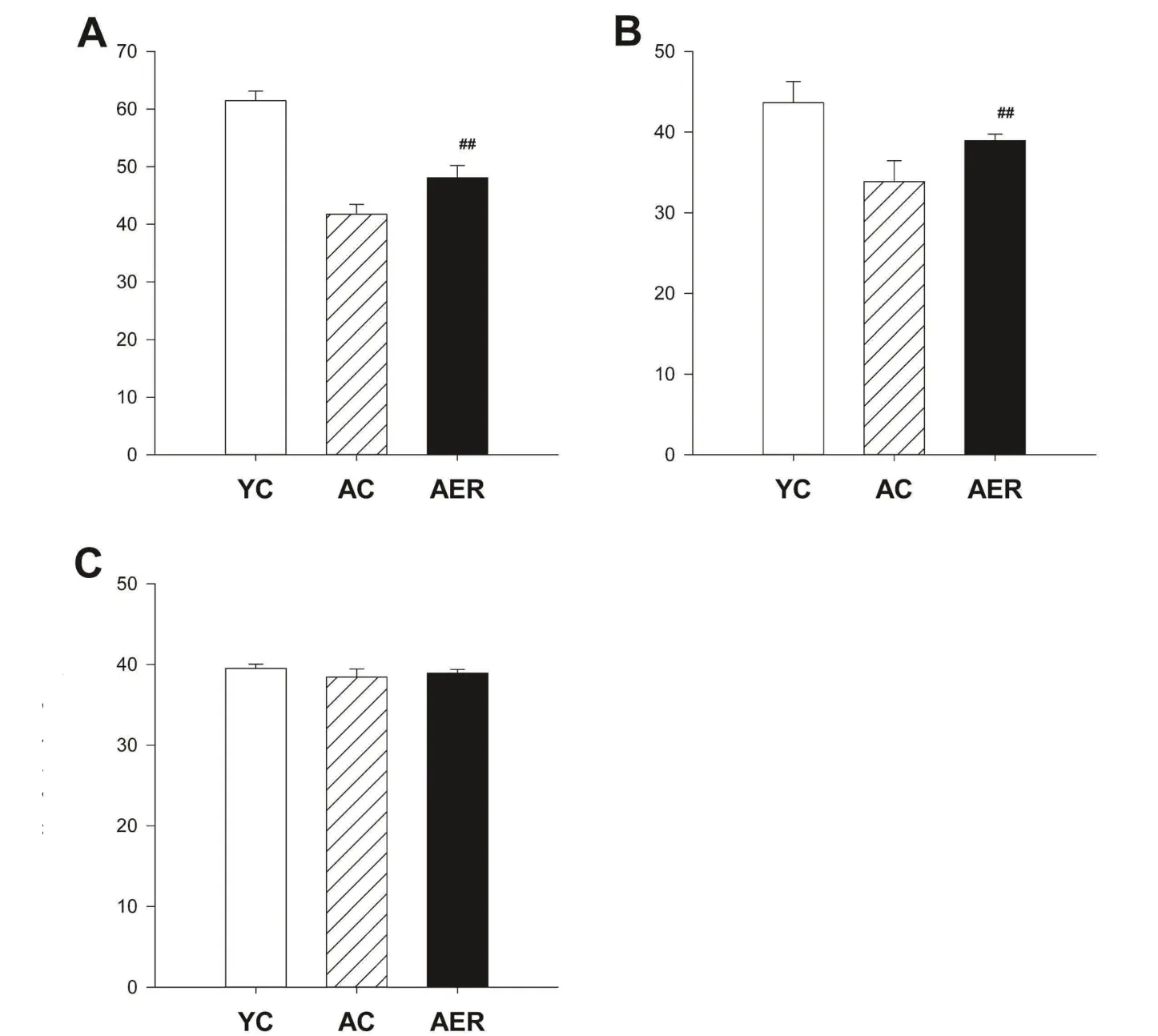
图1 各组小鼠骨骼肌蛋白质总量(A)、肌原纤维蛋白含量(B)与肌浆蛋白含量(C)比较
2.2.2 蛋白质合成率
使用抗嘌呤霉素抗体进行SUnSET 分析的新合成嘌呤霉素标记蛋白代表性印迹参见图2A。如图2B 所示,AC组与AER组小鼠体外蛋白质合成率均显著低于YC 组(P<0.01);AER 组小鼠蛋白质合成率较AC 组高12.3%(P<0.01)。

图2 各组小鼠骨骼肌新合成嘌呤霉素标记蛋白的代表性印迹(A)与蛋白质合成率(B)比较
2.3 骨骼肌形态学与功能差异比较
2.3.1 肌纤维直径与横截面积
AC 组与AER 组小鼠骨骼肌纤维直径均显著低于YC组(P<0.01),AER组小鼠较AC组高12.6%(P<0.01)(图3A,3C)。肌纤维横截面积的组间差异趋势与直径一致,AC组与AER组小鼠骨骼肌肌原纤维蛋白含量显著低于YC 组(P<0.01),AER 组小鼠横截面积则较AC组高27.4%(P<0.01)(图3B,3C)。
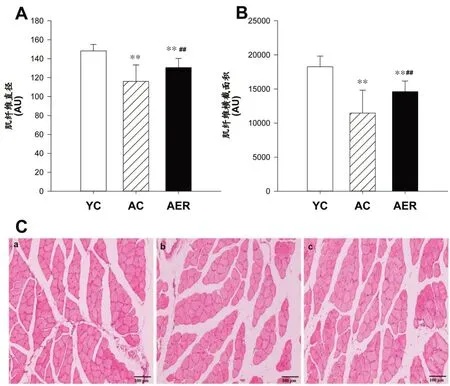
图3 各组小鼠骨骼肌纤维直径(A)、横截面积(B)及组织形态学(C)比较
2.3.2 网屏悬吊时间
重复测量方差分析结果显示:仅见时间×分组因素的交互作用均具有统计学意义(P<0.01),提示时间因素的作用随分组不同而不同;分组因素具有统计学意义(P<0.01),提示各组小鼠悬吊时间总体差异显著。各处理组小鼠实验期间网屏悬吊时间变化如图4 所示。AC与AER组小鼠干预前悬吊时间并无差异,但均显著低于YC组小鼠(P<0.01)。8周实验期内,YC组小鼠悬吊时间变化未见统计学意义;AC组小鼠悬吊时间显著减少,自第1 周即开始出现具有统计学意义的变化(P<0.05);AER组则自第3周运动干预后出现具有统计学意义的增长(P<0.05),至第7 周时已显著优于AC组小鼠(P<0.05)。
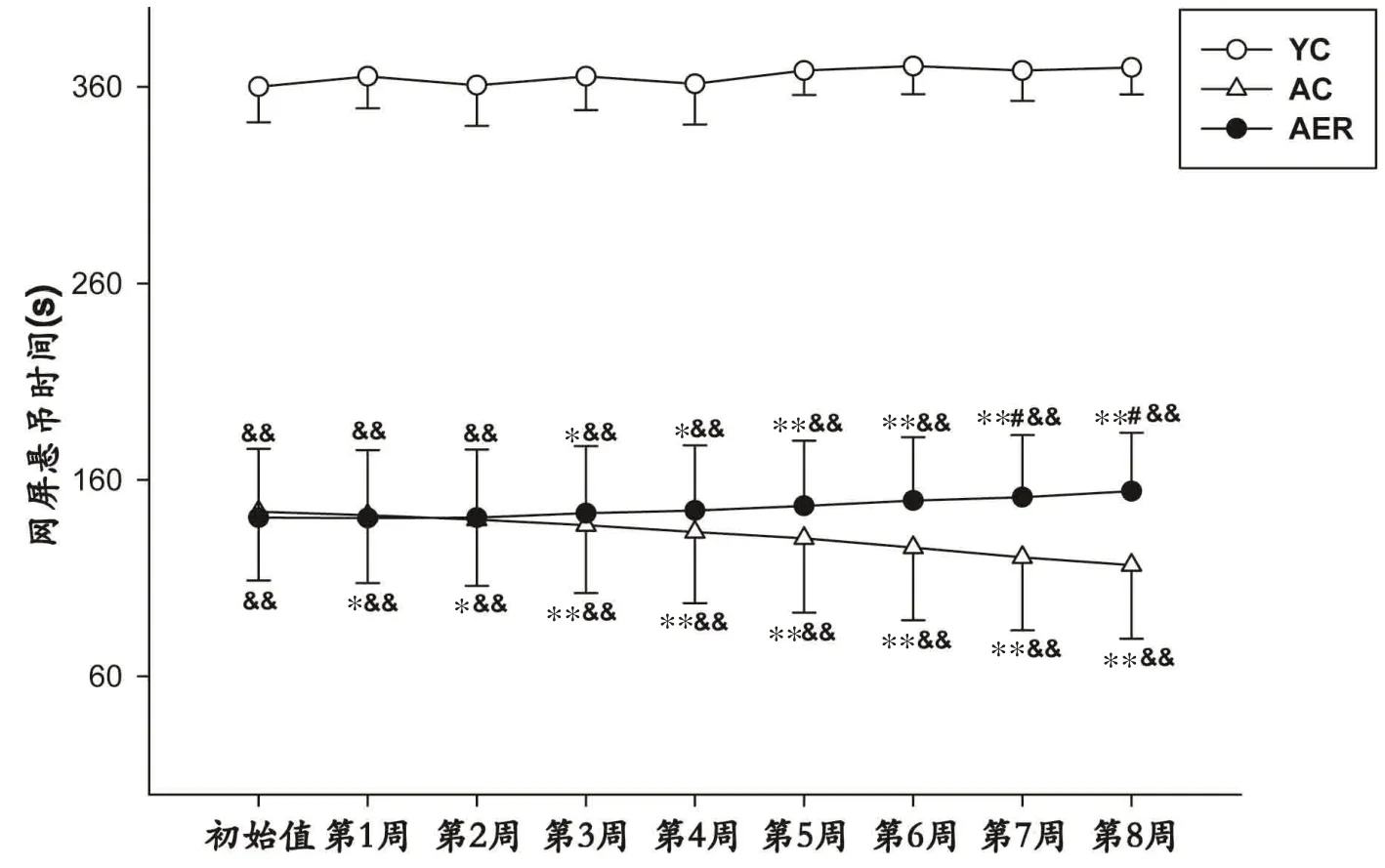
图4 各组小鼠网屏悬吊时间比较
2.3.3 肌肉力量
重复测量方差分析结果显示:时间因素以及时间×分组因素的交互作用均具有统计学意义(P<0.01),提示小鼠抓握肌力有随时间变化的趋势,且时间因素的作用随分组的不同而不同;分组因素具有统计学意义(P<0.01),提示各组小鼠抓握肌力总体差异显著。各处理组小鼠实验期间抓握力变化如图5 所示。AC 与AER 组小鼠初始抓握肌力差异无统计学意义,但均显著低于YC组小鼠(P<0.01)。8周实验期后,YC组小鼠肌力增长,较初始肌力水平差异具有统计学意义(P<0.01);AC 组小鼠肌力显著下降,自第4 周开始出现有统计学意义的变化(P<0.05);AER 组小鼠肌力变化趋势与YC组一致,自第2周同期运动训练后即已出现具有统计学意义的增长(P<0.05),至第8 周时与AC 组小鼠肌力差异已具有统计学意义(P<0.01)。
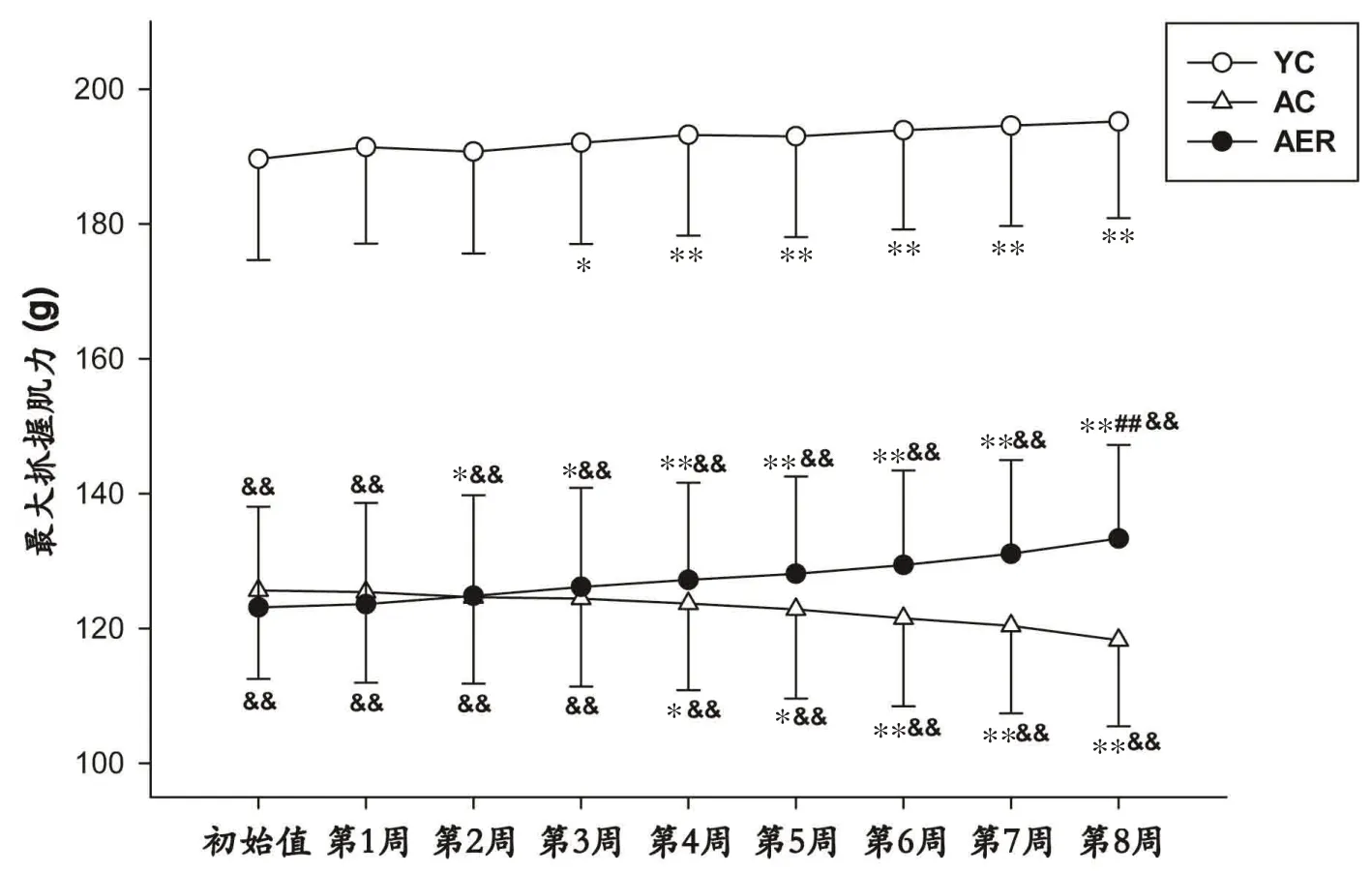
图5 各组小鼠肌肉力量比较
2.3.4 力竭游泳时间
如图6所示,AC组与AER组小鼠力竭游泳时间显著短于YC 组(P<0.01),AER 组较AC 组小鼠力竭运动时间长272.9%(P<0.01)。
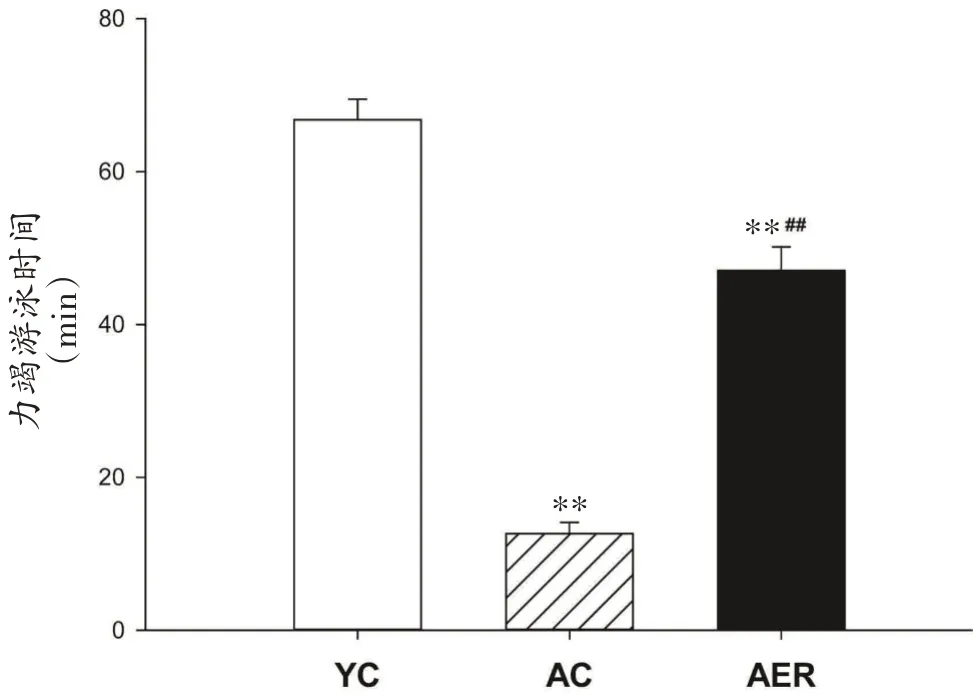
图6 各组小鼠力竭游泳时间比较
2.4 蛋白质合成关键信号通路蛋白表达量差异
各组小鼠骨骼肌蛋白质合成关键信号通路相关蛋白表达见图7A。如图7B 所示,与YC 组相比,AC 组与AER 组小鼠mTORSer2448、4E-BP1Thr37/46与p70S6KThr389磷酸化表达均表现为下调,且差异具有统计学意义(P<0.01);但AER组小鼠较AC组上调,差异亦有统计学意义(P<0.01)。MHC Ⅱb 组间趋势与mTORSer2448、4EBP1Thr37/46与p70S6KThr389磷酸化表达一致。
3 讨论
骨骼肌质量的维持取决于骨骼肌蛋白质合成和降解之间的平衡,两者的差值体现着净蛋白质平衡状态[6,22]。若肌肉蛋白质合成的昼夜波动与蛋白质降解相当,则骨骼肌质量维持稳态;而当蛋白质合成水平超过降解导致净蛋白质平衡呈正数时,骨骼肌蛋白质沉积增加并继发导致骨骼肌肥大与肌力增长。反之,若蛋白质降解水平超过合成使净蛋白质平衡呈负数,则会诱发骨骼肌蛋白质含量减少并致萎缩加剧[23,24]。就衰老机体而言,其骨骼肌质量与功能所表现出的退行性变化主要由蛋白质合成的减少所致,这一变化被称为“合成代谢抵抗(anabolic resistance)”,意即在接受促蛋白质合成刺激时,老年人骨骼肌需要更大的刺激剂量方能产生与青年人类似的净蛋白质平衡与蛋白质沉积[25]。因此,如何有效刺激衰老骨骼肌蛋白质合成,削弱“合成代谢抵抗”的不良影响并诱发正性净蛋白质平衡,已成为学界近年来所关注的重点研究领域。
3.1 同期运动训练对老年小鼠骨骼肌蛋白质合成水平的影响
蛋白质合成率与含量是用于评价衰老骨骼肌蛋白质合成水平的关键指标。本研究发现,衰老导致了骨骼肌蛋白质合成水平的显著下调,但8 周同期运动训练可显著改善这一变化,致其蛋白质合成率增长12.3%,总蛋白质含量增长15.2%,肌原纤维蛋白质含量增长15.0%,肌纤维直径与横截面积分别增长了12.6%和27.4%。
运动是促进骨骼肌蛋白质合成的有效刺激,无论被试处于何种年龄阶段,运动均可诱发肌原纤维和线粒体蛋白质合成率显著增长[26,27]。Yarasheski[28,29]研究组的早期报道表明,抗阻训练可致老年男性与女性被试混合肌蛋白质合成率明显增长;而Brightwell 等[30]近年研究则提示,24 周中等强度有氧训练可使老年被试混合肌基础蛋白质合成率增长高达50.7%,与Short 等[31]及Harber研究组[32,33]此前报道的结果一致。但是,联合力量与耐力素质训练的同期运动训练是否能够产生类似的作用效应,迄今鲜见报道。Donges 等[34]以中年被试为研究对象,分别给予70% 1RM 强度抗阻训练、55% VO2max强度有氧训练及同期运动训练(以抗阻和有氧训练强度50%比例)干预,发现同期运动训练诱发了与抗阻训练相近的肌原纤维蛋白质合成率,及与有氧训练相近的线粒体蛋白质合成率。值得注意的是,该研究的同期运动训练方案中仅采用了50%的抗阻与有氧训练强度,却同时促进了肌原纤维与线粒体蛋白质合成水平的有效增长。Colleluori 等[35]的近期研究将120名肥胖老年人随机纳入有氧、抗阻或同期运动训练组,进行为期6个月的运动干预,结果观察到抗阻与同期运动训练干预组被试股外侧肌蛋白质合成率较安静对照被试出现了显著增长,且抗阻训练组较有氧训练组被试的差异亦有统计学意义。笔者认为,上述研究结果不仅较好地佐证了同期运动训练对衰老骨骼肌蛋白质合成率的改善作用,且其较单独有氧或抗阻训练对运动强度要求较低的特点可能更加凸显了其在老年人群中的应用潜力。
就运动对骨骼肌蛋白质含量的影响而言,目前的研究结果仍然莫衷一是。Linderman等[36,37]早期的研究表明,抗阻训练可以使后肢悬吊模型大鼠骨骼肌肌原纤维蛋白质含量出现显著增长,Willoughby等[38]的人体实验研究亦观察到了相同的结果。而Haus等[39]则观察到双侧下肢悬吊和卧床被试在分别接受35 天与90 天抗阻训练后,其股外侧肌混合蛋白质含量、肌原纤维蛋白质含量与肌浆蛋白质含量变化均未见具有统计学意义;Roberts 等[40]对健康青年被试的研究亦报道了类似的结果。尽管目前未见同期运动训练对衰老骨骼肌蛋白质含量影响的相关报道,但本研究及我们此前的报道[17]均提示,此干预手段可以促进衰老骨骼肌总蛋白质含量的提高(即增强蛋白质沉积),且此效应可能主要来自于肌原纤维蛋白质含量的增长,而非肌浆蛋白质的变化。结合前述关于蛋白质合成率的评价结果,笔者认为其亦可在一定程度上佐证蛋白质含量增长的变化趋势。此外,由于衰老性骨骼肌的萎缩性变化主要发生于快缩型骨骼肌内,MHCⅡb在典型快肌中的相对表达对于骨骼肌收缩表型及纤维类型具有至关重要的意义,因此,MHCⅡb表达水平的上调亦在一定程度上佐证了其蛋白质合成水平的增强。但是,鉴于目前相关研究结果的分歧,在后续研究中仍需进一步排除运动强度、运动间隔和干预周期差异对研究结果造成的混杂影响,而在应用恶病质等其它疾病萎缩性模型所开展的相关研究中还需注意结合骨骼肌蛋白质降解水平的变化进行综合评价。
3.2 同期运动训练对老年小鼠骨骼肌形态与功能的影响
如前所述,抗阻训练可致衰老骨骼肌肌力显著增强[11,41],研究提示有氧运动具有类似效应[9,10],且大量针对非老年人群开展的实验研究亦表明同期运动训练均可刺激被试肌力增长[42,43]。Timmons 等[44]的研究中,将84名老年被试平均纳入对照、有氧训练、抗阻训练与同期运动训练干预组内,各训练组被试每周训练3次,每周训练时长均固定为72 分钟。经过为期6 周和12 周干预后发现,同期运动训练仅在12周干预后使得被试握力出现有统计学意义的增长,但6 周与12 周干预均可致被试卧推及腿举的1RM 值明显增加,且同期运动训练导致的推举力量增长较抗阻训练更为显著。Kirk等[45]针对老年被试施加16 周同期抗阻与功能训练干预,结果亦观察到了卧推、腿举与肱二头肌弯举1RM值显著提高。Alcazar等[46]以老年慢性阻塞性肺病患者为研究对象的实验中,12 周同期高强度间歇与爆发力训练亦产生了类似的影响。就运动耐力而言,目前鲜见同期有氧与抗阻训练对衰老人体与动物影响的相关报道,但Alcazar 等[46]的研究中观察到了被试最大摄氧量与最大功率等运动能力指标的显著增长;且Losa-Reyna[47]近年对衰弱老年被试进行为期6 周的同期爆发力与高强度间歇训练干预,亦观察到了类似的研究结果。
协调性、肌肉力量与运动耐力是衰老性骨骼肌萎缩的重要评价指标。本研究观察到,衰老使小鼠网屏悬吊时间、最大抓握肌力与力竭游泳能力均显著下降,而8 周同期运动训练干预可使其有效改善,与前述研究结果基本一致。尽管存在研究对象、评价指标及干预方案的差异,但笔者认为综合目前可考的研究文献结果,仍然提示了其在改善衰老机体骨骼肌功能方面的重要潜力。在后续研究中,尚需探明低强度功能训练、中等强度有氧训练、高强度间歇有氧训练联合肌肉肥大型抗阻训练与爆发式抗阻训练进行干预对被试骨骼肌功能的作用差异,以及改变有氧与抗阻训练的顺序及间隔可能导致的不同适应性变化。
3.3 同期训练对老年小鼠骨骼肌蛋白质合成水平的间接评价
哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)信号的胞内诱导与传递功能障碍是诱发骨骼肌蛋白质合成减少的关键机制。mTORC1由mTOR、Raptor、mLST8及几个非核心亚基构成,活化的mTOR 可刺激骨骼肌蛋白质合成与适应性肥大,特异性阻断mTOR 功能表达可抑制骨骼肌适应性肥大变化高达95%,因此其活化水平直接影响衰老性骨骼肌萎缩的干预效应[48]。作为mTOR下游靶蛋白,p70S6K与4E-BP1在调控骨骼肌蛋白质合成过程中亦有重要贡献:活化的p70S6K可磷酸化核糖体S6蛋白,进而控制着5’端含有末端寡聚嘧啶的一类信使RNAs 的翻译效率;而4E-BP1 活化后则可从eIF4E 复合物中解离,并与eIF4G 与eIF4A 这两种蛋白质结合形成eIF4F复合物,从而对帽依赖性翻译的起始产生重要影响。因此,骨骼肌mTOR/p70S6K/4EBP1通路的活化亦可被视为蛋白质合成水平升高的间接评价指标[16,49]。
同期有氧与抗阻训练对衰老骨骼肌mTOR信号通路的影响迄今未见相关报道。Camera等[50]对青年被试进行的急性同期运动干预研究发现,运动结束后1 小时mTORSer2448磷酸化水平出现了显著上调,但在4 小时后即已恢复至安静水平,且p70S6KThr389磷酸化水平无变化。而Fernandez-Gonzalo 等[51]的研究中,青年被试经过5 周同期有氧与抗阻训练后,给予一次急性有氧运动干预并在6 小时后进行抗阻运动,在抗阻运动前和运动后3 小时进行股外侧肌活检,结果仅见p70S6KThr389磷酸化水平显著上调。本研究则发现,经过为期8 周同期运动训练后24 小时,骨骼肌mTORSer2448、p70S6KThr389与4E-BP1Thr37/46磷酸化表达较安静对照组均显著增强,与Ogasawara 等[52]此前报道的研究结果一致。笔者认为,前人研究结果的差异主要在于干预方案以及研究设计的区别,而本研究所观察到的结果间接佐证了衰老小鼠骨骼肌蛋白质合成水平增强,同时亦提示该通路在骨骼肌蛋白质合成代谢响应同期运动训练刺激过程中具有重要调控作用。但是,该过程中mTOR的上游调控蛋白仍有待进一步研究探明。
4 结论
同期运动训练能够刺激衰老小鼠快缩型骨骼肌蛋白质合成率上调并促进蛋白质沉积,同时增强其协调性、最大抓握肌力与运动能力,具有改善衰老性骨骼肌萎缩的重要潜力。就其作用机制而言,可能涉及快缩型骨骼肌内mTOR/p70S6K/4E-BP1 信号通路的活化。在后续研究中,首先,需厘清不同的同期训练方案(含不同运动强度、运动量、有氧与抗阻训练顺序及间隔)对蛋白质合成水平可能产生的不同影响。其次,需要借助生物信息学分析或基因芯片分析等手段,鉴定出mTOR/p70S6K/4E-BP1 信号通路响应同期有氧与抗阻训练刺激的关键上游调节通路与蛋白,并通过完全性/条件性基因敲除动物模型或阻断剂的使用予以验证。最后,亦需进一步探明此类适应性变化是否能够转化为对人体被试的有益促进,从而为相关靶点与机制在临床转化医学领域的应用提供理论与实验线索。

