T2DM 患者尿β2-MG 及血清OST、25(OH)D3 水平与糖尿病肾病发病风险的关系
郭玲 丁静贤
糖尿病肾病(diabetic kidney disease,DKD)是因糖尿病引起肾损伤的慢性微血管疾病,是2 型糖尿病(type 2 diabetes mellitus,T2DM)最严重的并发症之一。DKD 不仅会引起患者进展为终末期肾病,亦显著增加患者发生心血管疾病及死亡的风险,严重威胁患者生存质量及生命健康[1]。DKD病程进展缓慢,随着疾病发展,肾功能会受到无法逆转的损伤,但在疾病早期经过治疗,肾脏损害可以逆转[2]。因此,早期诊断及干预DKD 对于促进疾病转归至关重要。24 h 尿蛋白排泄率及肾小球过滤估计值(Glomerular filtration rate,eGFR)是评估DKD 患者肾功能与疾病分期的常用指标,但其对DKD 早期诊断效果有限。有文献报道[3],尿β2微球蛋白(β2-microglobulin,β2-MG)在DKD 患者中的表达高于单纯T2DM 患者及健康人群。血清骨钙素(Osteocalcin,OST)及25 羟基维生素D3[25 hydroxyvitamin D3,25(OH)D3]均是骨代谢指标,其表达水平与早期肾损伤有关[4]。本研究将通过测定DKD 患者上述指标水平,分析上述指标与DKD 发病风险的关系,以期为T2DM 患者早期发现及预防DKD 提供依据。
1 资料与方法
1.1 一般资料
选取2018 年1 月至2022 年7 月常州市武进中医医院收治的DKD 患者112 例(DKD 组)、单纯T2DM 患者53 例(T2DM 组)、同期在医院体检的健康志愿者49 名(对照组)作为研究对象。本研究所有研究对象均知情同意,且已签署知情同意书。本研究通过常州市武进中医医院医学伦理委员会批准后开展。
纳入标准:①T2DM 诊断符合《中国2 型糖尿病防治指南(2020)》[5]的关于T2DM 确诊标准;②DKD 诊断符合《中国糖尿病肾脏疾病防治临床指南》[6]的关于DKD 确诊标准;③健康志愿者血糖指标、肾功能指标正常;④无阅读及沟通能力障碍;⑤临床资料完整。排除标准:①Ⅰ型糖尿病、妊娠期糖尿病等其他糖尿病分型;②合并泌尿系统感染或梗阻疾病;③合并心、肺等重要器官衰竭者;④其他疾病引起的肾功能异常;⑤近期服用肾毒性药物;⑥合并恶性肿瘤、内分泌疾病或血液系统疾病。
1.2 方法
1.2.1 一般临床资料收集
收集所有研究对象性别、年龄、糖尿病病程、身高、体重等一般资料,并计算体质指数(Body mass index,BMI)。
1.2.2 标本收集及处理
采集所有受检者清晨空腹血液3~5 mL,离心(3 000 r/min,10 min,离心半径:10 cm)后取上血清,收集受检者晨起中段尿离心处理(2 000 r/min,10 min,离心半径:8 cm)后取上清液,低温保存待检。
1.2.3 检测方法
以免疫比浊法测定β2-MG 含量,酶联免疫试剂盒购自美国西门子医疗系统有限公司;使用全自动生化仪(型号:C701,厂家:德国罗氏)检测血清血清肌酐(Serum creatinine,Scr)及尿素氮(Urea nitrogen,BUN)水平;根据慢性肾脏病流行病学合作研究公式(Chronic kidney disease epidemiology collaboration,CKD-EPI)[7]通过Scr 水平计算eGFR水平;使用全自动电化学发光免疫分析仪(德国罗氏公司)及其配套试剂检测血清OST 及25(OH)D3 水平。所有检测均按照试剂盒说明书操作。
1.2.4 统计学处理
使用SPSS 23.0 统计学软件对数据进行分析处理,计量资料以()表示,组间两两比较采用t检验,多组间比较采用F检验;采用Pearson 相关模型分析尿β2-MG、血清OST、25(OH)D3 与肾功能指标的相关性;采用Logistic 回归模型分析影响DKD 的因素;绘制受试者工作曲线(ROC)分析尿β2-MG、血清OST、25(OH)D3 对DKD 的预测价值。以P<0.05 为差异具有统计学意义。
2 结果
2.1 三组一般临床资料及实验室指标比较
三组性别、年龄、BMI、TG、TC 等指标比较,差异均无统计学意义(P>0.05);尿β2-MG、Scr 及BUN水平比较,DKD 组>T2DM 组>对照组,eGFR、血清OST 及25(OH)D3 水平比较,DKD 组<T2DM 组<对照组,差异均有统计学意义(P<0.05)。见表1。
表1 三组一般资料及实验室指标比较[n(%),()]Table 1 Comparison of general clinical data and laboratory indexes among the three groups[n(%),()]
注:a表示与对照组比较,P<0.05;b表示与T2DM 组比较,P<0.05。
2.2 DKD 患者尿β2-MG、血清OST、25(OH)D3与肾功能指标的相关性
Pearson 相关性模型分析显示,β2-MG 水平与Scr、BUN 水平呈正相关,与eGFR 水平呈负相关(P均<0.05);血清OST 及25(OH)D3 与Scr 及BUN 呈负相关,与eGFR 呈正相关(P均<0.05)。见表2。
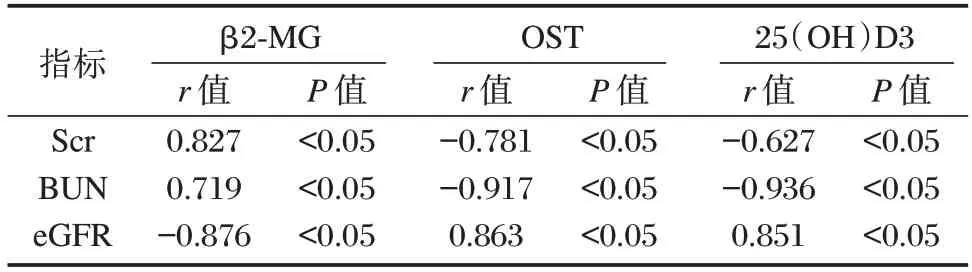
表2 DKD 患者尿β2-MG、血清OST、25(OH)D3 与肾功能指标的相关性分析Table 2 Correlation analysis of urinary β2-MG,serum OST,25(OH)D3 and renal function indexes in DKD patients
2.3 DKD 患者危险因素的多因素Logistic 回归模型分析
结果显示,Scr、BUN、β2-MG、血清OST 及25(OH)D3 是DKD 患者的独立影响因素(P均<0.05)。见表3。

表3 DKD 患者危险因素的多因素Logistic 回归分析Table 3 Multivariate Logistic regression analysis of risk factors in patients with DKD
2.4 尿β2-MG、血清OST 及25(OH)D3 及联合检测对DKD 的预测价值
尿β2-MG、血清OST及25(OH)D3预测DKD的下曲线面积(AUC)分别为0.831、0.894、0.763,联合检测为0.936,高于单一检测(P<0.05)。见表4、图1。
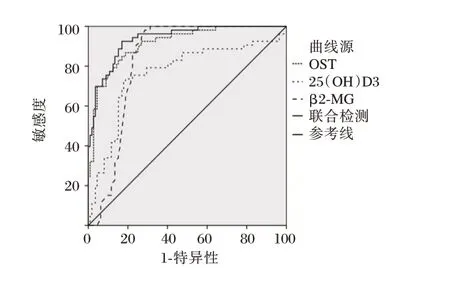
图1 ROC 曲线Fig. 1 The ROC curve
3 讨论
T2DM 是一种以血糖持续升高为主要特征的内分泌疾病,机体在长期高血糖状态下会使肾小球系膜细胞释放大量活性氧(reactive oxygen species,ROS)基团,从而引起肾小球系膜细胞死亡,导致肾功能障碍,最终导致DKD 发生[8]。目前,临床上通常将微量白蛋白尿作为诊断DKD 的主要依据,但有研究指出,部分T2DM 患者在出现白蛋白尿之前就已经有肾小球滤过率下降趋势[9],此外,DKD 起病隐匿,在糖尿病期持续数十年才达到发病高峰期,出现蛋白尿。因此,应选用更灵敏的指标对DKD 作出诊断,并及时进行治疗。
β2-MG 是一种小分子蛋白质,可通过肾小球过滤及近端肾小管吸收后分解成氨基酸,其在健康人体内合成及释放过程稳定,而肾病患者肾小球过滤功能及肾小管功能受损,易引起β2-MG 浓度异常升高[10]。血清OST 是一种活性多肽,参与调节骨钙代谢,可在一定程度上反映成骨细胞活性,其对诊断骨质疏松等病症有较好的特异度[11]。25(OH)D3是反映机体内维生素D 水平的活性形式,其作用于肾脏、小肠等靶器官,可以调节钙磷水平、骨骼代谢及刺激成骨细胞活动能力,对肾脏具有一定的保护作用[12]。本研究结果显示,DKD 组β2-MG 水平高于对照组和T2DM 组,血清OST 及25(OH)D3 水平低于对照组及T2DM 组。分析其机制可能与以下几点有关,其一,在肾功能出现损伤时会导致β2-MG 分解代谢受到抑制,从而引起机体循环内β2-MG 水平迅速升高;其二,糖尿病患者在机体长期高血糖刺激下会产生大量有毒代谢物质,引起血管功能异常,进而致使骨形成减少及成骨活性降低,从而导致血清OST 合成减少[13];其三,由于DKD 患者肾功能不同程度的损伤,致使肾脏1α 羟化酶活性降低,DKD 患者eGFR 水平下降,导致血磷无法排出体内,使体内血磷水平升高,抑制近曲小管,导致25(OH)D3 合成受阻。
周红军等[14]认为,β2-MG 是早期T2DM 患者肾损伤的敏感标志物,其水平随肾功能损害程度加深而升高。这与本研究中DKD 患者β2-MG 水平随Scr、BUN 水平升高及eGFR 水平降低而升高的结果不尽相同。本研究结果显示,DKD 患者血清OST 及25(OH)D3 水平与Scr 及BUN 水平呈负相关,与eGFR 水平呈正相关,表明血清OST 及25(OH)D3 对DKD 具有保护作用,研究结果与王英彪等[15]一致。分析其对糖尿病微血管病变的保护机制可能是:血清OST 在通过成骨细胞内质网蛋白质羧化后产生变化,使羟基磷灰石晶体表面钙离子亲和力增加,进而减少微血管钙化[16];而25(OH)D3 通过抑制转化生长因子-β 水平及保护肾小球滤过屏障的足细胞,减少了糖尿病肾病肾脏损害。
多因素Logistic 分析显示,β2-MG、血清OST及25(OH)D3 是DKD 患者的独立影响因素,提示上述指标在DKD 发生及发展过程中起重要作用。此外,Scr 及BUN 亦是DKD 的影响因素,这可能与高Scr 及BUN 水平会造成肾小管上皮细胞纤维化及肾小球硬化,从而导致肾功能损伤有关。ROC 曲线结果显示,尿β2-MG、血清OST 及25(OH)D3 预测DKD 的下曲线面积(AUC)分别为0.813、0.712、0.739,三者联合检测AUC 为0.936,表明联合检测三者水平对于临床诊断DKD 有较好的预测价值,可为DKD 的诊断及治疗提供思路。
综上所述,T2DM 患者尿β2-MG、血清OST 及25(OH)D3 水平与肾功能密切相关,并参与DKD的发病机制,对诊断DKD 具有应用价值。

