盐度对浒苔(Ulva prolifera)微观繁殖体萌发生长及藻体繁殖的影响*
马薇薇 王 楠 孙 妍 孙 松
盐度对浒苔()微观繁殖体萌发生长及藻体繁殖的影响*
马薇薇1, 2, 3王 楠1, 2孙 妍1, 2孙 松1, 2, 3①
(1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 山东青岛 266071; 2. 中国科学院大学 北京 100049; 3. 山东胶州湾海洋生态系统国家野外科学观测研究站 山东青岛 266071)
黄海绿潮起源于苏北浅滩, 每年夏天漂移到青岛沿岸泛滥成灾, 对生态环境造成严重破坏。苏北浅滩受沿岸径流输入影响, 盐度变化范围大, 青岛海域盐度较稳定, 稍高于苏北浅滩。盐度对浒苔微观繁殖体萌发、藻体生长及繁殖过程具有重要作用, 通过室内连续受控实验, 系统研究了固定盐度(5、10、15、20、25、30、33、35)和变化盐度(盐度逐渐降低)对浒苔微观繁殖体固着、萌发、藻体生长和繁殖不同阶段的影响, 主要结论如下: 固着阶段, 盐度5不利于浒苔微观繁殖体的固着, 盐度10~35对微观繁殖体固着的影响不显著, 相同盐度下, 孢子的固着量显著高于配子。萌发阶段, 不同盐度(5~35)及不同盐度变化形式对微观繁殖体(孢子和配子)的萌发没有显著影响, 孢子的萌发速度快于配子, 最终均能完全萌发。生长阶段, 低盐(5~15)不利于浒苔幼苗的生长。繁殖阶段, 当盐度≤10时, 浒苔不进行生殖活动; 盐度15~35范围内, 浒苔可以产生微观繁殖体, 完成一个完整的生活史; 在绿潮形成过程中, 孢子的生殖策略为K对策, 配子的生殖策略为R对策。上述结论表明, 在苏北浅滩和青岛海域, 盐度不是限制浒苔发生发展及繁殖过程的关键环境因子, 明确了盐度在绿潮发生过程的作用, 为揭示绿潮暴发机制提供科学依据。
盐度; 浒苔(); 浒苔微观繁殖体; 萌发生长; 繁殖
自2007年以来, 黄海海域连年大规模暴发绿潮, 漂浮绿藻大量增殖、堆积及腐烂降解, 引发水体缺氧和水产养殖动物死亡, 对海洋生态环境安全及海洋经济可持续发展造成严重威胁, 引起了科学家和政府的高度关注(Sun, 2008; Ye, 2011; Zhou, 2015; 于仁成等, 2018)。通过大量的海上调查和室内实验, 确定我国黄海绿潮的原因种为浒苔(), 浒苔起源于苏北浅滩, 在向北漂移过程中不断增殖, 最终聚集在山东半岛沿海(Ding, 2009; Leliaert, 2009; Duan, 2012; Wang, 2015; Zhang, 2020)。浒苔的发生与微观繁殖体有关, 浒苔生殖过程产生的孢子、配子、合子以及不同生长阶段的显微个体统称为微观繁殖体,在其生活史中占据重要地位(Hoffmann, 1991; Liu, 2012; Cao, 2023)(图1)。浒苔存在有性生殖和无性生殖等多种繁殖方式, 复杂的繁殖方式是浒苔适应变化环境的重要方式(Lin, 2008; Liu, 2015; Wang, 2016; Zhao, 2019)。浒苔生活史中除雌雄配子结合成合子发育成藻体外, 孢子和配子均可单独发育成藻体, 在适宜的环境条件下, 微观繁殖体附着在合适的基质上萌发成可见藻体, 对绿藻的生物量产生极大的影响(Huo, 2016; Wang, 2020)。因此, 厘清环境因子对浒苔微观繁殖体的影响对于研究绿潮暴发机制, 解释绿潮成因及绿潮预警预报尤为重要。
盐度是影响大型藻类生长的重要环境因子, 对浒苔微观繁殖体阶段的萌发、藻体的生长、藻体的繁殖等过程中具有重要的作用(Rybak, 2018)。此外, 浒苔生活史中存在必需的微观繁殖体固着过程, 微观繁殖体繁殖经过固着后, 才会萌发生长, 固着阶段是浒苔生活史的重要组成部分(颜天等, 2018)。研究表明, 浒苔对盐度适应性较强, 藻体生长的盐度范围为12~40, 最适盐度范围是24~32; 藻体释放微观繁殖体的盐度范围在12~40, 最适盐度范围为28~40(王建伟等, 2007; 罗民波等, 2011; 张晓红等, 2012)。苏北浅滩为浒苔微观繁殖体的“发源地”, 受到苏北沿岸流以及地下水的影响, 该区域海水盐度具有周期性波动的特征, 其盐度变化范围较大, 海水盐度较低通常在30以下, 一般在25~30 (Huo, 2013, 2014; Zhao, 2021)。与苏北浅滩相比, 青岛海域的盐度比较稳定, 平均盐度在31左右, 稍高于苏北浅滩海域。
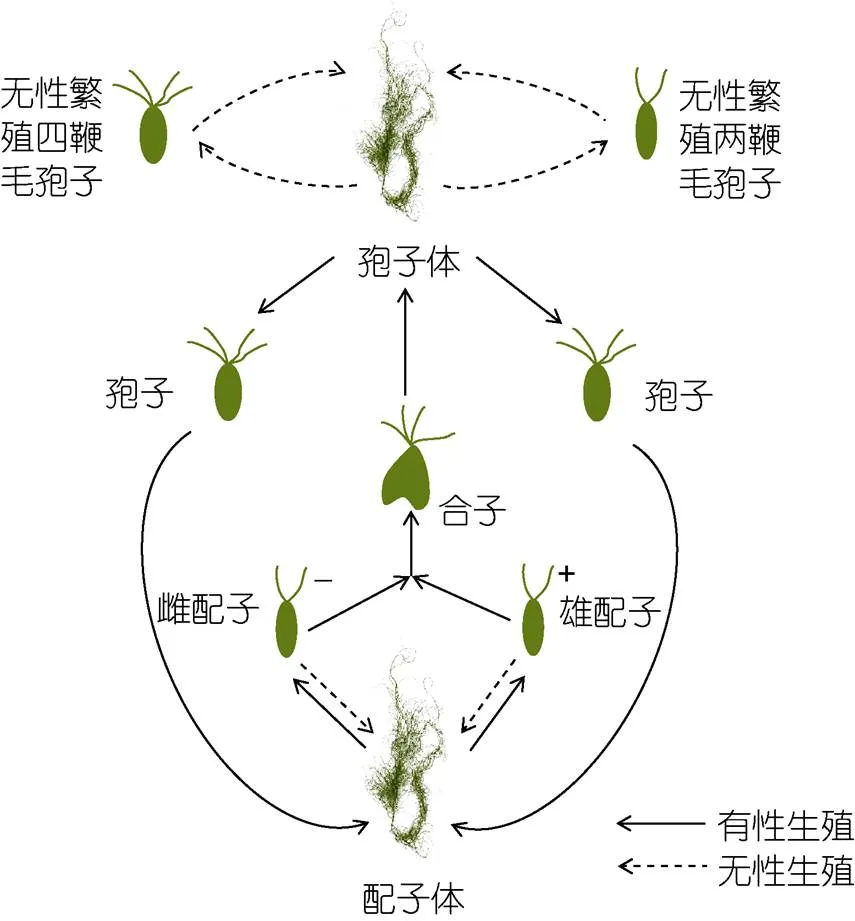
图1 浒苔的生活史
注: 改绘自王广策等(2016)
盐度对浒苔生活史不同阶段影响的研究较多, 大部分研究都是围绕其生活史中某一个或某几个阶段进行的, 连续观察盐度对浒苔整个生活史不同阶段的影响方面的研究较少。两地盐度水平的差异是如何影响浒苔整个生活史过程的, 孢子和配子在应对苏北浅滩变化的盐度环境(盐度降低)时是否存在差异, 孢子和配子在萌发和繁殖过程中对浒苔暴发的贡献是否相同, 这些都是亟需解决的问题。
因此, 本研究综合考虑苏北浅滩和青岛海域盐度变化特点, 设置固定盐度和变化盐度两组实验, 系统研究了不同盐度梯度及不同盐度变化形式对浒苔微观繁殖体固着萌发, 幼苗生长, 繁殖等关键生活史过程的影响, 进一步探讨了不同盐度条件下浒苔微观繁殖体的萌发生长过程, 浒苔孢子配子对变化盐度(苏北浅滩)的响应及其生殖策略。本研究对认识浒苔在不同盐度及盐度变化环境下生长生殖的生物学特征, 深入理解浒苔生活史过程, 揭示盐度在绿潮发生发展过程中作用机制具有重要意义。
1 材料与方法
1.1 浒苔的培养与微观繁殖体的获得
微观繁殖体来自实验室长期保种培养的浒苔, 通过断裂法获得微观繁殖体(Dan, 2002), 挑选主枝明显的成熟浒苔藻体, 去除多余的分支, 将其剪成1~2 cm的藻段, 放入装有f/2培养液的培养皿中, 每天更换培养液, 2~3天后, 藻体逐渐发黄至变白, 释放出微观繁殖体, 培养皿的边缘出现明显的绿色痕迹。迅速收集微观繁殖体, 加入Lugol’s试剂固定染色, 用血球计数板计算繁殖体的初始密度, 便于后续实验接种使用, 整个过程需迅速完成, 避免微观繁殖体固着。
1.2 盐度实验设计
实验采用连续培养的方法进行盐度对浒苔微观繁殖体萌发、生长、繁殖影响实验。实验分为固定盐度和变化盐度两部分。
1.2.1 固定盐度实验
(1) 固着萌发实验
实验设置8个盐度梯度, 分别为5、10、15、20、25、30、33、35, 每个梯度设置4个重复。低盐度通过自然海水(盐度32)加蒸馏水稀释而来, 高盐度通过添加NaCl提高盐度, 使用盐度计(ATAGO PAL-06S, 日本)标定盐度梯度。实验使用GXZ-380B型光照培养箱进行培养, 温度20 °C, 光照强度70 μmol/(m2·s), 光暗比12 h:12 h。实验所用的微观繁殖体为配子, 培养容器为50 mL小烧杯, 微观繁殖体密度为1× 104ind./mL, 烧杯底部放置一块盖玻片用于镜检, 培养水体体积为40 mL, 烧杯的位置随机摆放以保证受光均匀。实验前先避光24 h确保微观繁殖体的随机固着, 24 h后每天镜检微观繁殖体的萌发情况(以萌发分裂成两个细胞为萌发标准), 显微镜下随机选取20个视野(400倍), 记录微观繁殖体总数以及萌发的数量, 以此来计算固着量和萌发率。使用徕卡倒置显微镜(Leica, 德国), 每天拍照记录微观繁殖体的形态变化。实验期间每天更换培养液, 培养水体为添加f/2营养盐的灭菌海水, 确保营养盐充足。
(2) 生长实验
当微观繁殖体完全萌发或者萌发率达到稳定时, 随机取一定数量的浒苔进行生长实验, 盐度梯度与固着萌发阶段相同。每个烧杯随机取15根幼苗放入一个培养皿中培养, 每组4个重复, 每个盐度组共60根幼苗。培养容器为100 mL培养皿(SPL 310100, 韩国)。温度、光照等条件和萌发阶段相同, 每3天测量一次幼苗的长度, 同时更换培养液。由于初始的幼苗太小, 肉眼测量困难, 使用蔡司光学显微镜(Zeiss SteREO Discovery.V20, 德国)拍照测量前期幼苗的长度, 待幼苗肉眼可见, 使用数显游标卡尺进行长度测量。
(3) 繁殖实验
生长试验结束后取浒苔幼苗繁殖实验, 盐度梯度与萌发生长阶段相同。每个培养皿中随机取10根浒苔幼苗进行单株培养, 共设置8个梯度, 每组4个重复。繁殖实验每个盐度梯度下有40根(10根×4)单株培养的幼苗, 共320根幼苗。温度光照等培养条件与固着萌发阶段相同, 实验容器为100 mm培养皿(NEST, 704004, 江苏无锡), 定期更换培养液水体, 待幼苗长成成熟藻体后, 定期观察藻体微观繁殖体释放情况。将释放的微观繁殖体进行镜检, 按照文献报道通过大小、趋光性以及鞭毛数量判断其类型(孢子或配子)。浒苔配子和孢子的区分标准: 配子大小约为5~10 μm, 孢子大小约为10~13 μm; 配子具有2根鞭毛, 具有正趋光性, 孢子具有4根鞭毛, 没有趋光性(Zhang, 2013; Liu, 2015)。
1.2.2 变化盐度实验
(1) 固着萌发实验
变化盐度组一共设置5个处理组, 实验组初始盐度均为30, 之后每天逐渐下降一个盐度直至保持稳定, 每个处理组设置4个重复, 各实验组盐度设置如下表1所示。不同盐度通过自然海水(盐度32)加蒸馏水稀释而来, 使用盐度计(ATAGO PAL-06S, 日本)标定海水盐度。实验使用GXZ-380B型光照培养箱进行培养, 温度20 °C, 光照强度70 μmol/(m2·s), 光暗比12 h:12 h。实验所用微观繁殖体分别为配子和孢子, 微观繁殖体的密度为1×104ind./L, 培养条件以及显微观测方法同1.2.1。
表1 变化盐度实验组每天培养的水体盐度
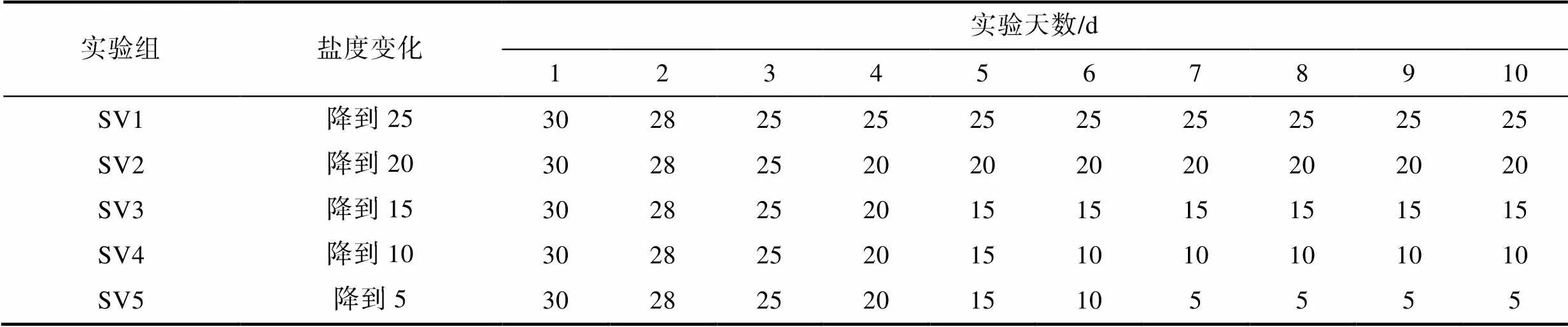
Tab.1 Daily salinity of the experimental group with various salinities
(2) 繁殖实验
萌发实验结束后, 每组随机取10根浒苔幼苗单株培养进行繁殖实验。繁殖实验中各组培养盐度与该组幼苗在萌发实验结束时的培养盐度相同, 共设置5个盐度组, 分别为5、10、15、20、25, 每组实验4个重复。繁殖实验每个盐度梯度下有40根(10根×4)单株培养的幼苗, 共200根幼苗。温度光照等培养条件与萌发阶段相同, 实验容器为100 mm培养皿(NEST 704004, 江苏无锡), 定期更换培养水体, 待幼苗长成成熟藻体后, 定期观察藻体微观繁殖体释放情况。将释放的微观繁殖体进行镜检, 通过大小、趋光性以及鞭毛数量判断其类型(孢子或配子), 方法同1.2.1。
1.3 数据处理与分析
固着量(单位: ind./mm2)计算公式:
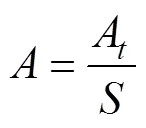
式中,为单位面积内微观繁殖体的固着量,A为一个视野中微观繁殖体的数量均值,为Leica显微镜400倍下一个视野的面积。
萌发率(%)计算公式:
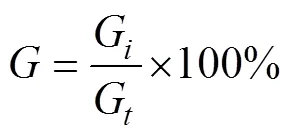
式中,为萌发率,G为一个视野中萌发的微观繁殖体的数量,G为一个视野中微观繁殖体的总数。
浒苔幼苗的总生长量(mm)计算公式:
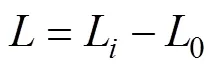
式中,代表浒苔幼苗的总生长量,L表示最后一次测量的长度,0表示初始长度。
浒苔幼苗长度相对生长率(单位: %/d)计算公式:
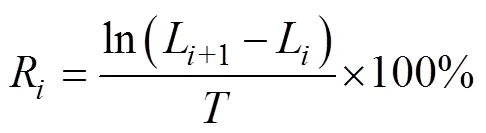
式中,R代表第到第(+1)次测量之间每天浒苔幼苗长度的相对增长率,L代表第次测量的平均长度,L+1代表第(+1)次测量的长度,代表每次测量长度的时间间隔。
放散率计算公式:
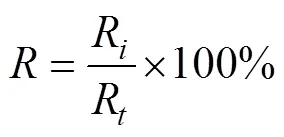
式中为放散率,R释放微观繁殖体的浒苔数量,R用于释放微观繁殖体的浒苔总数。
实验数据均采用均值±标准差表示, 使用Origin 2019绘图, 采用SPSS 26进行ANOVA进行单因素方差分析, LSD进行多重比较差异性(<0.05)分析; 对于方差不齐的数据进行数据转换, 无法进行方差分析时使用非参检验分析。
2 结果
2.1 不同盐度下浒苔微观繁殖体固着萌发、幼苗生长、藻体繁殖情况
2.1.1 不同盐度下浒苔微观繁殖体的萌发过程 不同盐度水平下微观繁殖体的萌发过程类似: 第1天配子固着在玻片上, 呈球形单细胞, 未萌发; 第4天配子开始萌发分裂成两个细胞, 部分配子形成2~8细胞的丝状体; 第7天, 各组配子几乎完全萌发, 形成叶状体。第10天, 随着叶状体的生长发育, 藻体长出大量分支, 藻体长度迅速增加。
2.1.2 不同盐度下浒苔微观繁殖体的固着量及萌发率 各盐度组24 h浒苔微观繁殖体固着量如图2所示。不同盐度水平下浒苔繁殖体固着量之间的差异显著(<0.05)。当盐度为5时, 微观繁殖体固着量最低, 为(9±2) ind./mm2, 显著低于其他盐度组(<0.05)。微观繁殖体固着量最大值为(47±8) ind./mm2, 出现在盐度35组。当盐度为20时, 微观繁殖体固着量为(35±3) ind./mm2, 显著低于盐度35组(<0.05)。其余盐度组微观繁殖体固着量在(39±6)~(46±3) ind./mm2范围内, 各组之间的差异不显著(>0.05)。
当盐度为5~35时, 浒苔微观繁殖体各盐度组萌发率随着培养时间的增加逐渐升高, 各组变化趋势相同(图3)。统计结果显示, 不同盐度水平下浒苔微观繁殖体萌发率之间的差异不显著(>0.05), 7天左右完全萌发。前3天, 盐度5水平下微观繁殖体一直没有萌发; 其余盐度组微观繁殖体萌发率也很低, 约为2%; 第4天所有盐度组萌发率开始升高, 达到24%左右; 第5天萌发率迅速升高到80%左右; 第7天所有盐度水平下微观繁殖体完全萌发, 萌发率为100%。
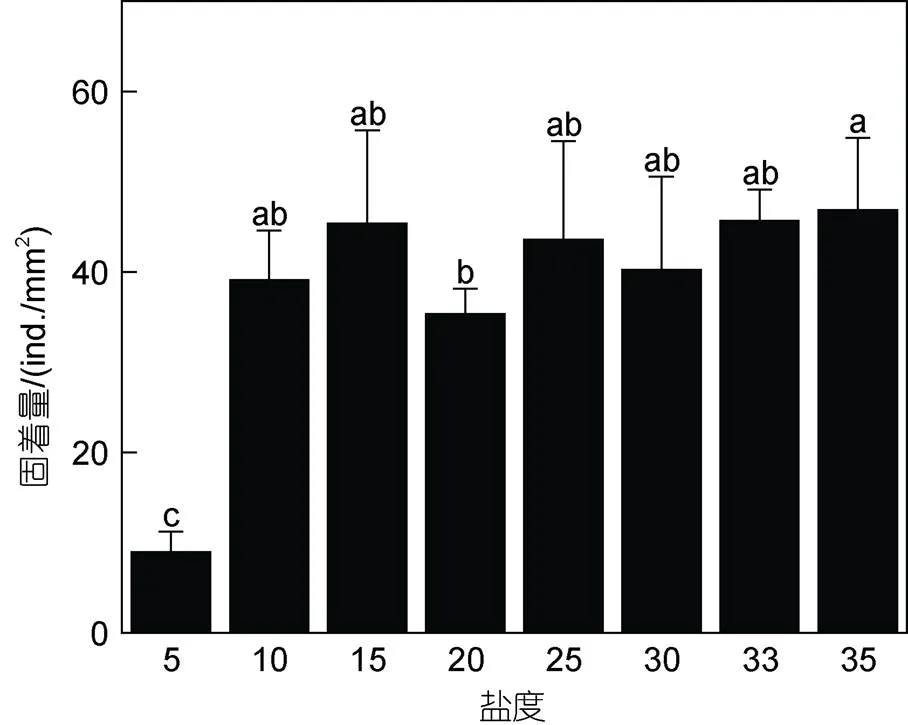
图2 不同盐度水平下浒苔微观繁殖体固着量
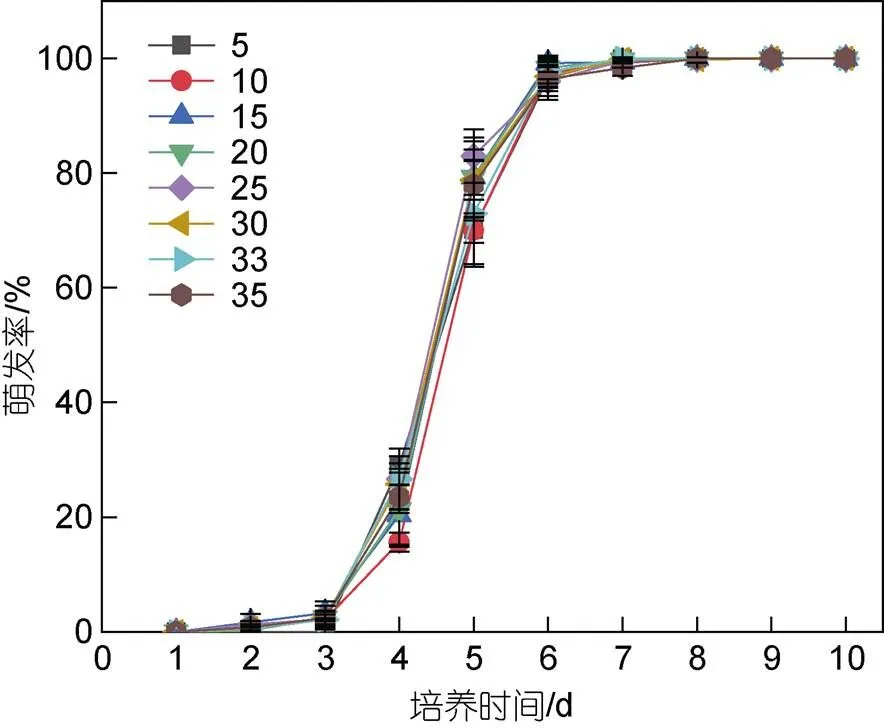
图3 不同盐度下浒苔微观繁殖体萌发率随时间的变化
2.1.3 不同盐度下浒苔幼苗总生长量及相对生长率 不同盐度下浒苔幼苗生长情况如图4所示, 幼苗总生长量最大值为(44.9±20.7) mm, 出现在盐度25实验组; 最小值为(14.0±2.1) mm, 出现在盐度5实验组。盐度显著影响浒苔幼苗总生长量(<0.05), 当盐度低于15时, 各组总生长量之间的差异不显著(>0.05),整体低于盐度20~35实验组。随着培养时间的增加, 浒苔幼苗相对生长率逐渐降低, 不同盐度水平下相对生长率之间的差异显著(<0.05, 图5)。实验1~12天, 盐度5~15实验组浒苔幼苗相对生长率低于盐度20~35实验组(<0.05); 实验13~15天, 盐度30~35实验组相对生长率较高; 实验16~18天, 不同盐度水平下浒苔幼苗的相对生长率之间的差异不显著(>0.05)。
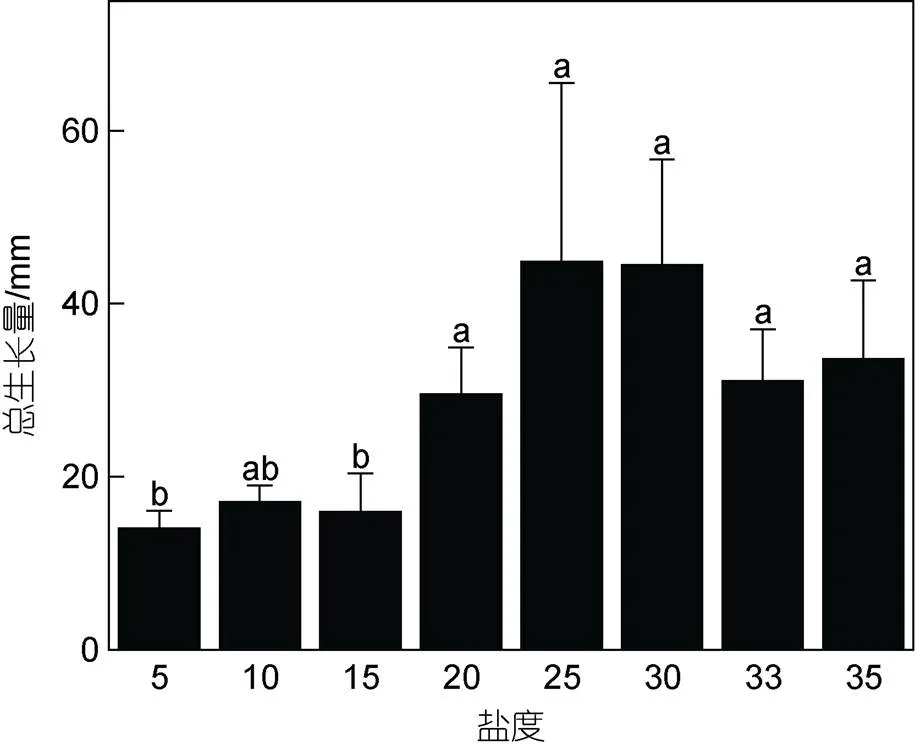
图4 不同盐度水平对浒苔幼苗总生长量的影响
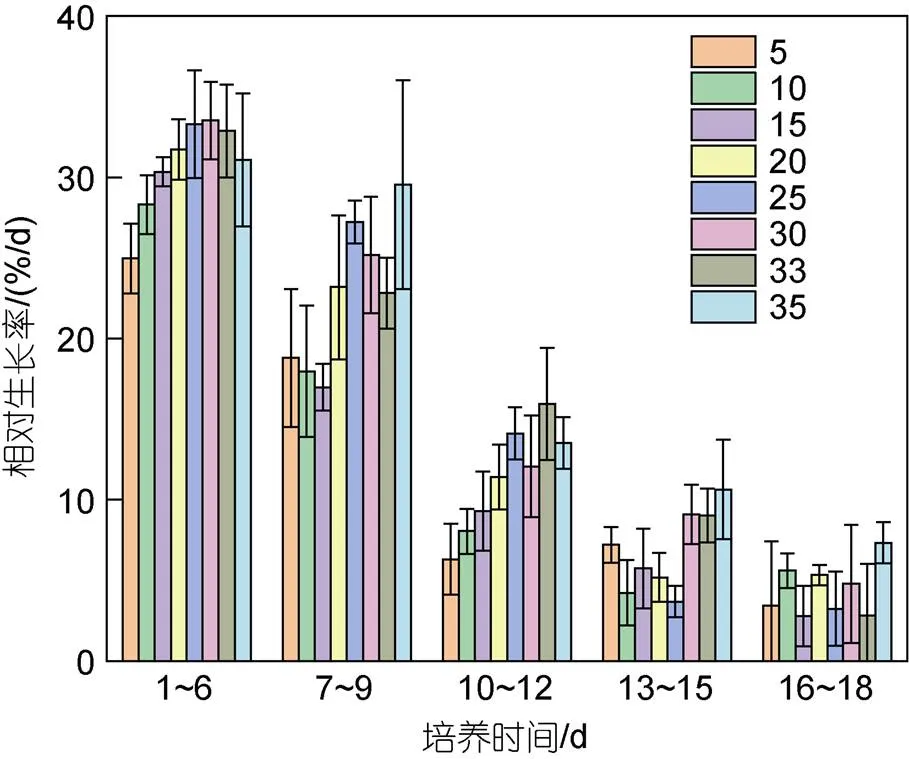
图5 不同盐度水平对浒苔幼苗相对生长率的影响
不同盐度下浒苔幼苗相对生长率随时间的变化示意图如图6所示, 不同盐度下浒苔幼苗的快速萌发期(浒苔幼苗相对生长率大于20 %/d的天数)不同, 低盐条件下浒苔幼苗的快速萌发期约为9天, 高盐条件下快速萌发期约为12天。
2.1.4 不同盐度下浒苔藻体繁殖情况 本实验所用藻体为配子萌发长成的藻体, 各组藻体的放散率如图7所示。盐度5和10实验组没有观测到藻体释放微观繁殖体, 盐度15~35范围内浒苔均可释放微观繁殖体。统计结果显示, 不同盐度下浒苔放散率之间的差异显著, 盐度5和10实验组放散率最低为0 (<0.05), 其余盐度组放散率在43%~95%。藻体放散后, 镜检结果显示, 不同盐度水平下浒苔释放出的微观繁殖体均具有4根鞭毛, 具有负趋光性, 认为产生的微观繁殖体为孢子。由于微观繁殖体固着速度较快, 部分实验组微观繁殖体的鞭毛随固着而消失, 实际镜检到4鞭毛孢子的藻体数量少于所有实验组放散的藻体数量(表2)。
2.2 变化盐度下浒苔微观繁殖体的固着萌发及繁殖情况
2.2.1 变化盐度组浒苔孢子和配子的萌发过程 变化盐度下浒苔孢子和配子的萌发过程有所不同, 孢子整体萌发早于配子。前3天配子未萌发, 第4天配子开始萌发分裂。第1天孢子已经有萌发的迹象, 细胞膨大开始延伸, 第2天部分孢子已经开始萌发分裂成2细胞, 第3~5天孢子分裂生长形成丝状体。孢子的萌发速度快于配子, 7天内孢子和配子完全萌发成叶状体, 第10天随着叶状体的发育, 藻体可见大量分支, 部分藻体基部形成假根。
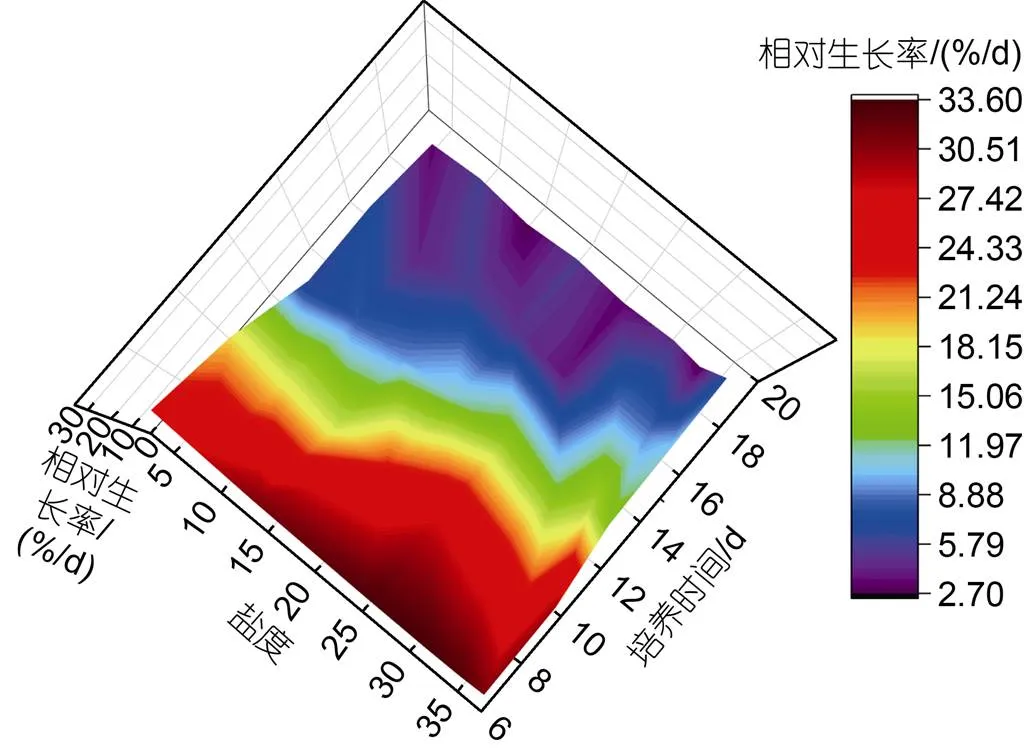
图6 不同盐度水平下浒苔幼苗相对生长率随时间的变化示意图
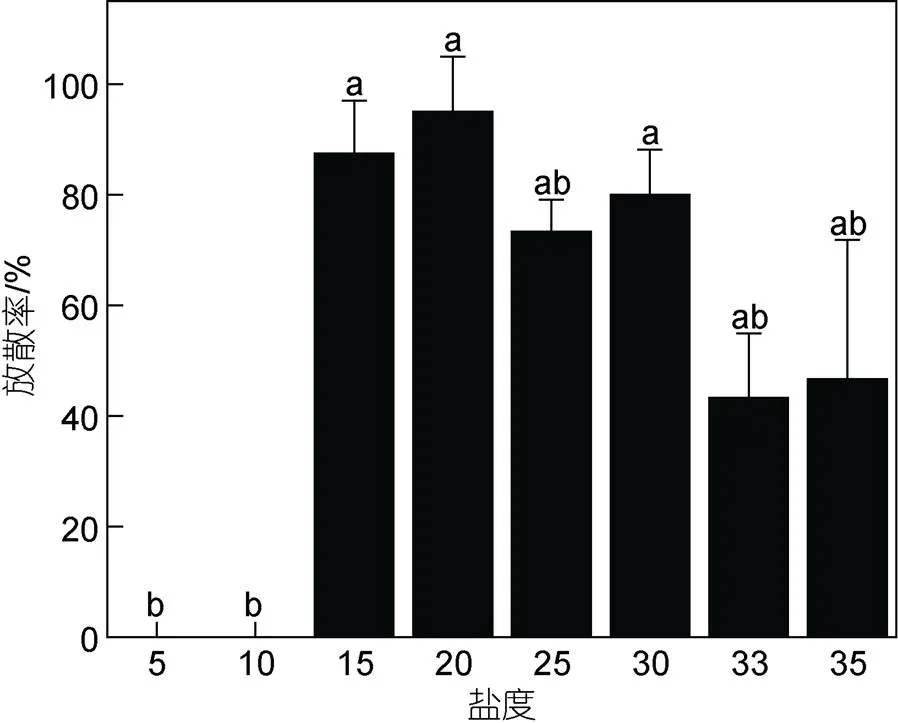
图 7 不同盐度水平对浒苔(微观繁殖体萌发成藻体)放散率的影响
表2 不同盐度水平下浒苔放散微观繁殖体类型
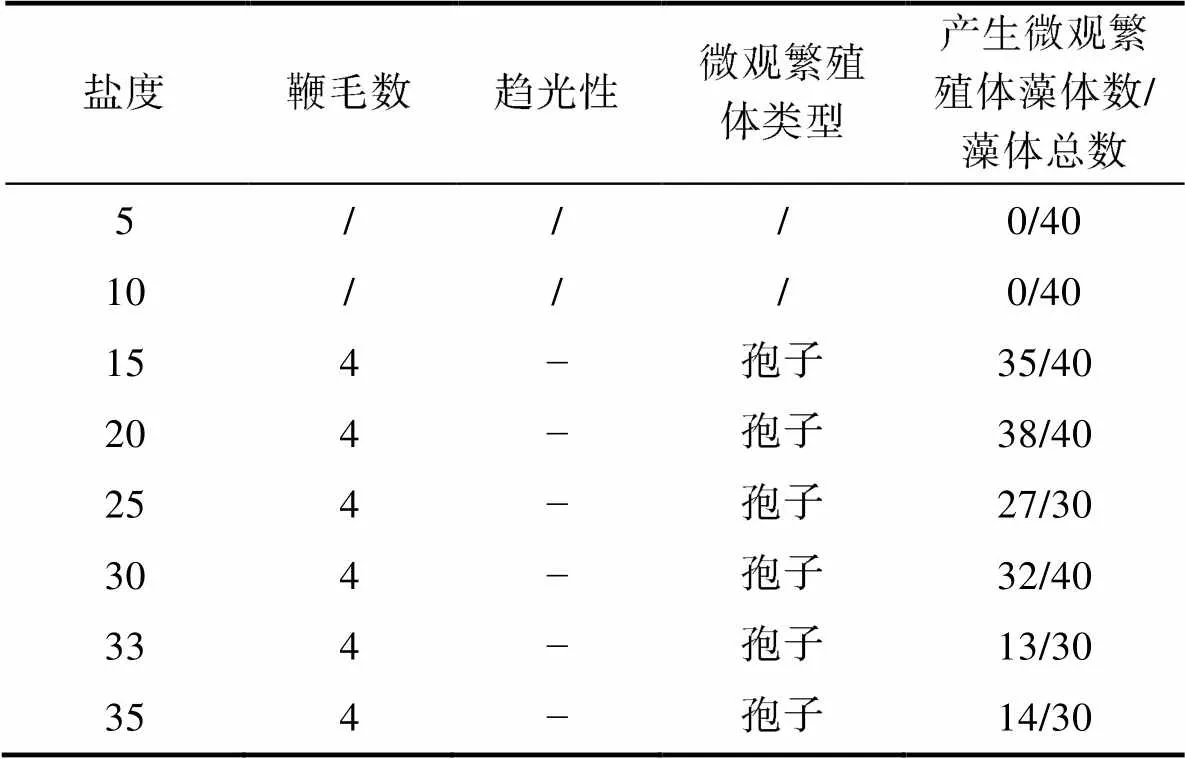
Tab.2 The dispersal micropropagules types of Ulva prolifera under different salinity levels
注: /代表未观测到; −代表负趋光性
2.2.2 变化盐度组浒苔孢子和配子的固着量及萌发率 变化盐度实验中, 不同变化盐度实验组中第一天盐度均为30, 浒苔配子和孢子固着量24 h固着量分别为(34±6)和(93±14) ind./mm2(图8), 统计结果显示, 孢子和配子固着量之间的差异极显著(<0.01)。
浒苔孢子和配子的萌发率随着培养时间的增加逐渐升高(图9), 最终萌发率均为100%, 统计结果显示, 盐度变化对孢子和配子萌发率的影响不显著(>0.05)。从萌发过程来看, 孢子萌发速度快于配子。前3天配子的萌发率较低, 不到1%; 第2天孢子开始快速萌发, 萌发率约为20%, 第3天孢子萌发率达到50%左右。第5天, 配子的萌发率达到50%左右, 孢子的萌发率约为90%。7天内孢子和配子几乎完全萌发, 萌发率接近100%。
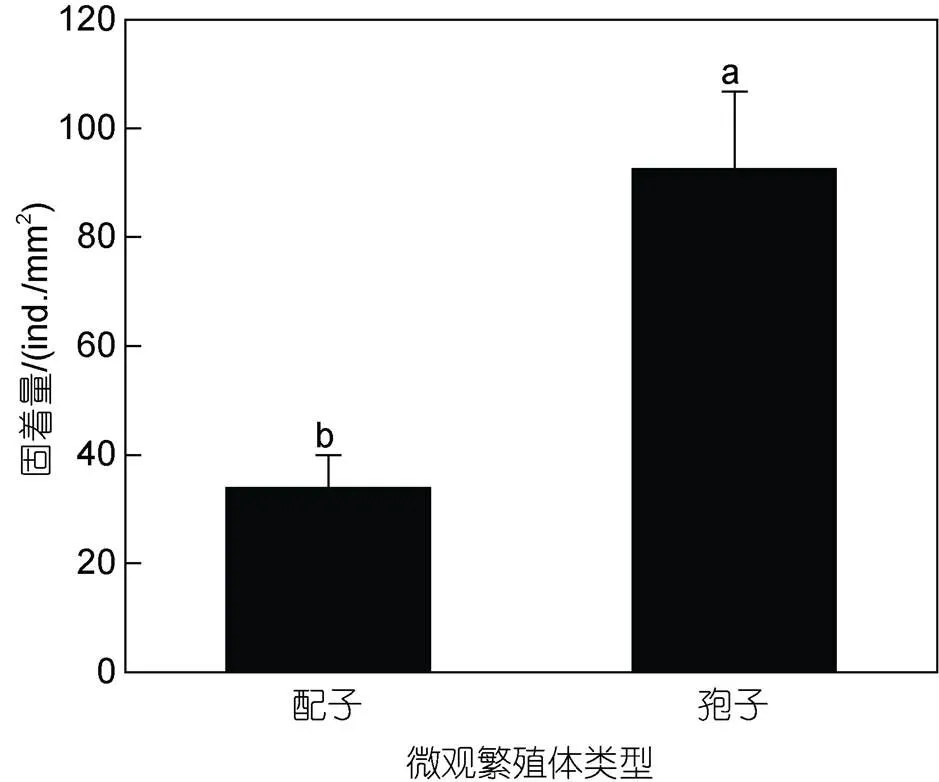
图8 固着萌发实验中浒苔孢子和配子24 h固着量
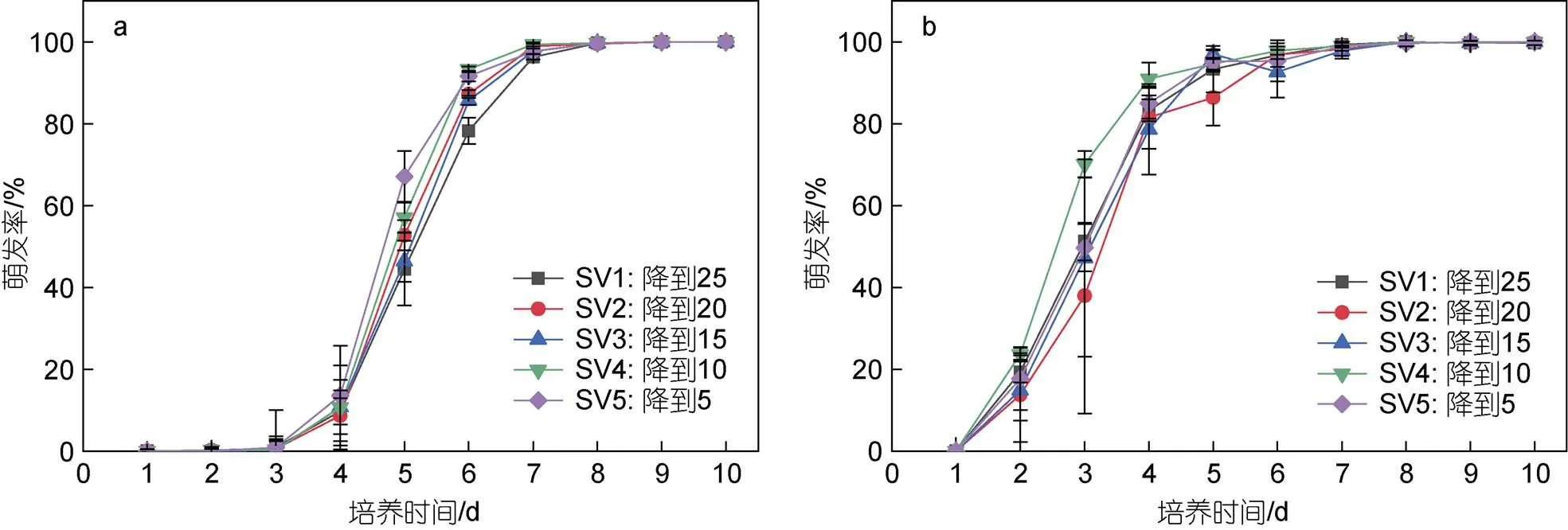
图9 变化盐度对浒苔孢子和配子萌发率随时间的变化
注: a: 浒苔配子; b: 浒苔孢子
2.2.3 变化盐度组浒苔藻体的繁殖情况 变化盐度组的繁殖实验中使用了两种藻体, 一种藻体来自固着萌发实验中配子萌发长成的成体, 下文简称为配子长成的藻体; 另一种藻体是由固着萌发实验中孢子萌发长成的成体, 下文简称为孢子长成的藻体。变化盐度实验繁殖阶段的盐度为变化盐度最后保持稳定的盐度, 故盐度不再变化。
图10a展示了各盐度梯度下配子长成的藻体的放散率, 盐度显著影响藻体的放散率(<0.05)。其中, 盐度5和10实验组, 藻体均未释放微观繁殖体。其他三个盐度组藻体都释放了微观繁殖体, 放散率在70%~80%范围内。统计结果显示, 这三个盐度下放散率之间的差异不显著(>0.05)。镜检结果显示, 配子长成的藻体释放的微观繁殖体均具有4根鞭毛, 具有负趋光性, 认为产生的微观繁殖体为孢子。由于微观繁殖体固着速度较快, 部分实验组微观繁殖体的鞭毛随固着而消失, 实际镜检到4鞭毛孢子的藻体数量少于实验中放散的藻体数量(表3)。
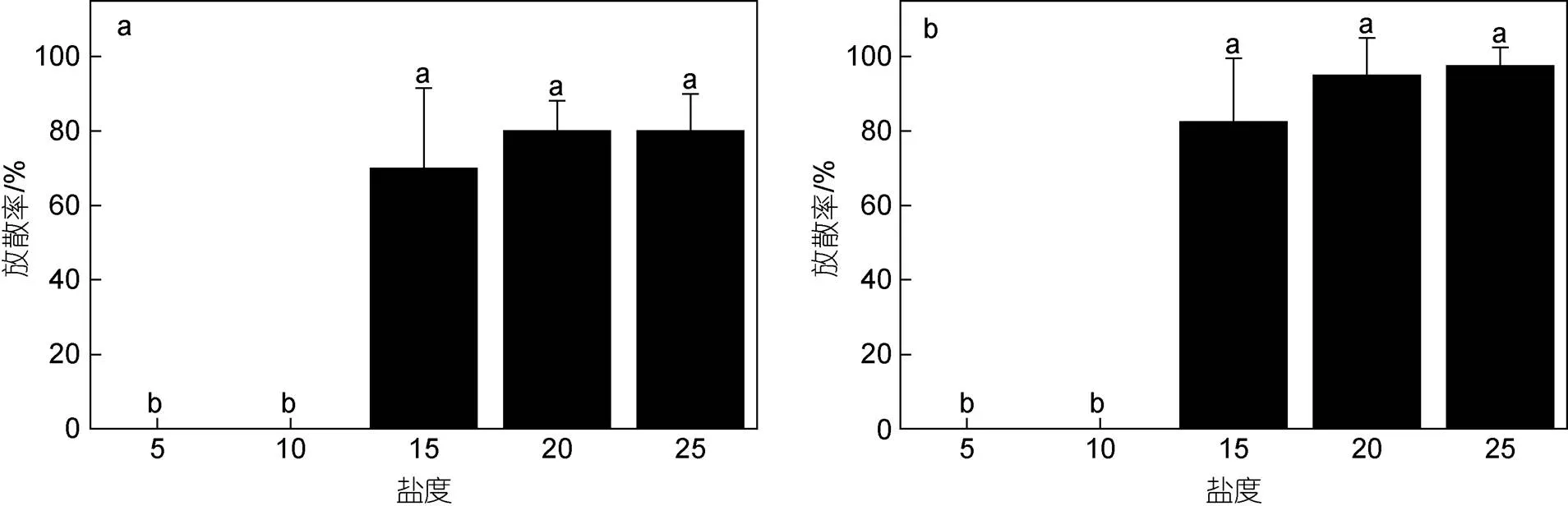
图10 不同盐度对浒苔(微观繁殖体萌发长成的藻体)放散率的影响
注: a: 配子萌发而成的浒苔产生微观繁殖体的放散率; b: 孢子萌发而成的浒苔产生微观繁殖体的放散率
表3 不同盐度水平下配子发育成浒苔放散微观繁殖体类型

Tab.3 The dispersal micropropagules types of Ulva prolifera germinated from gametes under different salinity levels
注:/代表未检测到; −代表负趋光性
盐度显著影响孢子长成的藻体繁殖情况(<0.05),各盐度梯度下藻体放散率如图10b所示, 放散率的规律与配子长成的藻体相同。当盐度为5和10时, 藻体没有释放微观繁殖体。当盐度为15~25时, 藻体均释放了微观繁殖体, 放散率在83%~98%范围内。镜检结果显示, 本组实验中孢子长成的藻体释放的微观繁殖体均具有2根鞭毛, 具有正趋光性, 认为产生的微观繁殖体为配子。由于微观繁殖体固着速度较快, 部分实验组微观繁殖体的鞭毛随固着而消失, 实际镜检到2鞭毛配子的藻体数量少于实验中放散的藻体数量(表4)。
我们进一步分析了相同盐度下, 配子长成的藻体的繁殖情况与孢子长成的藻体是否有差异。当盐度为15和20时, 相同盐度下孢子长成的藻体和配子长成的藻体的放散率之间的差异不显著(>0.05)。当盐度为25时, 相同盐度下孢子的放散率显著高于配子的放散率(<0.05)。
表4 不同盐度水平下孢子发育成浒苔放散微观繁殖体类型
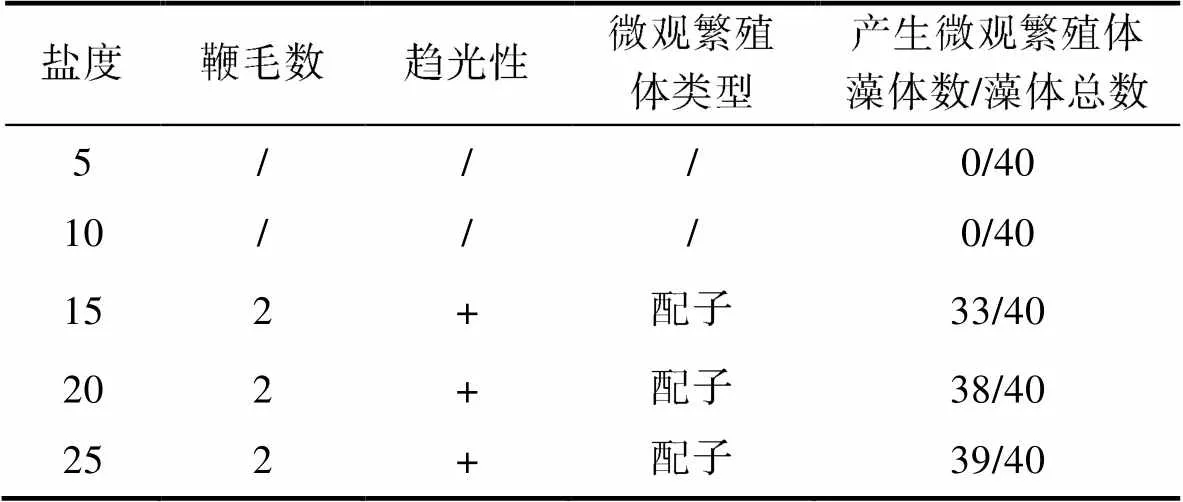
Tab.4 The dispersal micropropagules types of Ulva prolifera germinated from spores under different salinity levels
注: /代表未检测到; +代表正趋光性
3 讨论
本研究系统地研究了盐度对浒苔的整个生活史不同阶段的影响, 实验设置的盐度梯度(5~35)涵盖了苏北浅滩和青岛海域的盐度变化范围, 同时设置变化盐度模拟变化的盐度环境对浒苔孢子和配子的影响, 下文将分别阐明盐度在浒苔生活中微观繁殖体的固着萌发、幼苗生长及藻体繁殖阶段的作用。
3.1 盐度对浒苔微观繁殖体固着萌发阶段的影响
盐度对微观繁殖体的萌发生长以及繁殖具有重要作用, 尽管浒苔微观繁殖体对盐度适应范围广, 在盐度5水平下微观繁殖体固着量显著低于其他盐度, 仅为其他盐度的四分之一, 说明低盐(≤5)不利于微观繁殖体固着。已有研究表明, 盐度在一定程度下会影响藻细胞的渗透压, 盐度过低会对藻细胞造成伤害, 导致微观繁殖体固着量降低(Choi, 2010; Chokshi, 2017)。盐度为30时, 浒苔孢子固着量高于配子, 这可能是因为孢子体积较大, 且具有负趋光性, 比配子更容易沉降附着到培养容器底部。
盐度对浒苔微观繁殖体萌发过程及最终萌发率的影响不大, 各盐度下微观繁殖体7天内均能完全萌发。赵瑾等(2018)发现在单株培养条件下不同盐度对微观繁殖体萌发阶段没有影响, 与本实验结果一致, 在多种藻类共存时, 盐度通过影响种间竞争, 进而对微观繁殖体萌发率产生显著影响, 未来需要进一步研究多种藻类共存情况下盐度对浒苔微观繁殖体固着萌发的影响。本实验中, 盐度5实验组的微观繁殖体萌发过程及萌发率均未受到低盐的影响, 可能是因为实验培养水体为f/2培养液(NO3-N为882 μmol/L, PO4-P为42 μmol/L), 为微观繁殖体萌发提供了充足的营养盐, 培养水体中高浓度的NO3-N减轻了低盐对萌发过程产生的负面影响。Kamer等(2001)发现高浓度的NO3-N可以减轻低盐对的负面影响, 其他学者在研究盐度和营养盐对石莼属绿藻萌发生长过程也得出类似结论(Imchen, 2012; Bews, 2021)。
浒苔不同类型生殖细胞的萌发速度存在显著差异, 孢子的萌发速度快于配子, 两者完全萌发所需的时间相同, 均为7天。不同形式的盐度变化对孢子配子的最终萌发率影响不显著, 最终萌发率均为100%, 这说明微观繁殖体对盐度的适应性很强, 能够在各种变化的盐度环境中快速固着萌发。本实验中发现相同盐度下孢子的固着量是配子的2倍, 且孢子萌发速度快于配子, Zhang等(2013)发现在苏北浅滩采集浒苔样本中孢子萌发率为96.1%, 配子萌发率为91.6%, 与本实验结果较为一致。然而Cui等(2018)研究浒苔不同类型微观繁殖体的萌发过程发现, 孢子的萌发率(91.67%)是配子(30%)的三倍多, 整体低于本研究中孢子配子最终萌发率, 主要原因在于萌发率的计算方法不同。本实验中通过计数显微镜下一个视野内微观繁殖体的萌发个数与该视野下微观繁殖体, 而其他研究中萌发率为萌发的幼苗数量和加入总数的比值来计算萌发率, 前者是通过萌发的幼苗数量和微观繁殖体总量的比值计算萌发率, 不同的方法产生不同结果。此外, 实验中浒苔微观繁殖体的状态和培养条件都会对萌发率产生影响。
3.2 盐度对浒苔幼苗生长阶段的影响
本实验结果表明, 浒苔对盐度适应范围广, 在5~35范围内均可以生长, 与吴洪喜等人的研究结果一致(吴洪喜等, 2000; 王建伟等, 2007; Xiao, 2016)。低盐通常会抑制大型藻类孢子的萌发, 对藻体生长也有类似抑制作用(Martins, 1999; Kamer, 2000; Choi, 2010)。本实验中, 盐度≤15时, 浒苔幼苗总生长量显著低于其他盐度组。因为低盐条件下, 浒苔需要更多能量抵抗低盐导致的渗透胁迫(Touchette, 2007), 因此光合作用产生的物质及能量主要用于调节渗透压, 分配到生长的能量会降低, 表现为低盐抑制了浒苔的生长(Li, 2017)。在石莼属(Sousa, 2007),(Chen, 2015),(Bisson, 1979)中均存在低盐限制其萌发生长的现象。本实验中, 盐度高于15时, 对浒苔幼苗的生长量影响不显著, 该盐度梯度涵盖了苏北浅滩和青岛海域盐度变化区间, 结果表明, 盐度不是影响两地浒苔幼苗生长的关键环境因子。
实验发现不同盐度下浒苔幼苗快速萌发期不同(图6), 低盐条件下浒苔幼苗的快速萌发期短于高盐条件, 同时, 低盐水平下浒苔幼苗的相对生长率低于高盐水平, 与已有研究结果一致, 这可能是因为浒苔幼苗对环境更加敏感, 长期处于低盐环境会抑制浒苔幼苗的生长(王津果等, 2022)。
3.3 盐度对浒苔繁殖阶段的影响
本实验中浒苔释放微观繁殖体的盐度范围为15~ 35, 低盐水平5和10不进行生殖活动, 与相关报道一致(Dan, 2002; 王建伟等, 2007)。这可能因为当盐度低于10对浒苔造成了渗透胁迫, 抑制了浒苔孢子囊形成, 从而无法释放微观繁殖体(罗民波等, 2011)。Christie等(1962)曾发现肠浒苔在盐度低于10时不会释放孢子。当盐度在15~30范围内时, 对浒苔繁殖的影响不显著, 这说明在苏北浅滩和青岛海域盐度不是影响浒苔繁殖过程的关键环境因子。
在浒苔生活史中, 配子体孢子体交替出现的有性生殖类型较为常见, 此外浒苔可以进行单性生殖, 即配子可以直接萌发成新藻体, 但是在本实验中, 配子体产生的配子不经单性生殖, 萌发成藻体释放出四鞭毛的孢子, 即配子体释放的配子直接发育成孢子体(图11)。由于本实验藻体都是单株放散, 排除雌雄配子融合的可能性, 认为配子出现了二倍体化现象。其他学者在进行浒苔室内生活史研究中也出现二倍体化的现象(刘青, 2015)。在石莼属()绿藻中有过类似报道,在经过多个单性配子体世代后, 出现了配子体孢子体世代交替的过程, 由配子发育成孢子体(Hoxmark, 1974; Hoxmark, 1975)。为了进一步验证二倍体化, 本实验将收集的孢子液通过流式细胞仪检测孢子的倍性, 由于收集到孢子浓度较低, 孢子液中硅藻数量过多(萌发实验中显微镜下可见大量的硅藻), 干扰了孢子的峰值, 无法判断四鞭毛孢子的倍性, 未来工作中需要分子生物学手段进一步确认微观繁殖体的倍性研究。
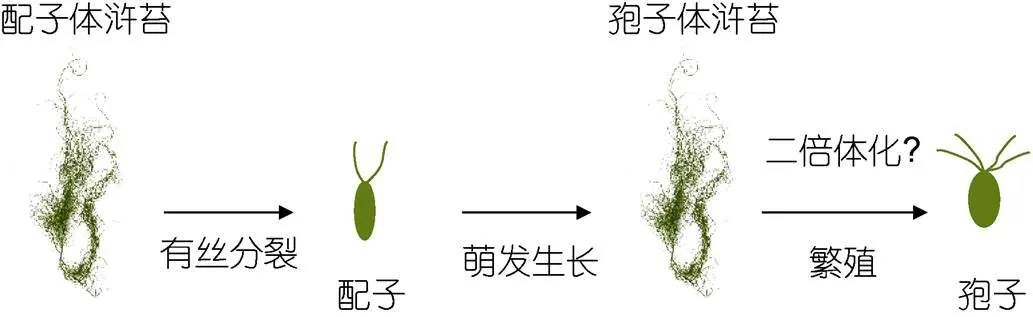
图11 盐度实验中浒苔生活史过程示意图
漂浮浒苔藻体处于生活史的哪个阶段, 孢子体还是配子体, 有性生殖还是无性生殖对于理解漂浮浒苔生物量剧增, 揭示浒苔生活史和繁殖方式在绿潮形成中作用具有重要意义。有学者认为, 单性生殖和无性生殖是漂浮浒苔主要生殖方式, 漂浮浒苔多为配子体, 能够产生大量的配子, 同时配子具有正趋光性, 有利于附着在漂浮浒苔藻体上萌发生长; 此外, 配子无需结合可以直接附着萌发, 这种繁殖方式可以快速增加浒苔的繁殖速度和数量(张华伟等, 2011)。Zhao等(2019)通过细胞核型分析的方法鉴定浒苔的倍性, 证明漂浮浒苔基本是孢子体, 有性生殖是漂浮浒苔的典型生活史特征。原因在于孢子体生长期长于配子体, 有性生殖有利于清除有害突变, 积累有益突变, 更好地适应浒苔漂浮期间的环境变化。Liu等(2015)对漂浮浒苔进行生活史研究发现漂浮浒苔既有有性生殖又有无性生殖, 没有明显规律。对于漂浮浒苔处于哪个生活史阶段, 仍没有明确答案。
成熟浒苔可以持续释放数量巨大的微观繁殖体, 强大的繁殖能力是浒苔生物量快速增加引起暴发的原因之一(Lotze, 1999; 张华伟等, 2011)。浒苔主要存在孢子和配子两种类型微观繁殖体。漂浮浒苔在暴发期间迅速形成孢子囊, 释放孢子可以直接在原来藻体上萌发生长, 加快浒苔繁殖速率(郑阵兵等, 2018), 本实验表明, 孢子具有更快的固着及萌发速度, 为浒苔生物量快速积累提供基础。成熟浒苔产生的配子量约是孢子量的两倍(王晓坤等, 2007), 配子可以直接固着萌发成新的藻体 (Zhang, 2013; 韩红宾等, 2015), 萌发速度比孢子慢。
从孢子和配子两类微观繁殖体的产生量、固着量和萌发速度来看, 我们认为孢子和配子在绿潮形成中生殖策略不同: 孢子为K生殖对策, 个体大, 释放量小, 固着萌发速度快, 在绿潮发生发展过程中以“质”取胜; 配子为R生殖对策, 个体小, 释放量大, 固着萌发速度相对较慢, 以“量”取胜。
3.4 盐度在黄海绿潮形成中的作用
通过对比固定盐度和变化盐度下浒苔配子固着、萌发、和藻体繁殖的影响发现, 浒苔微观繁殖体对盐度适应范围广, 对变化盐度适应性很强, 固定盐度和变化盐度对浒苔发生发展过程的影响均不显著。具体地说: 在固着阶段, 实验所涉及的固定盐度和变化盐条件下配子平均固着量在(34±5)~(38±12) ind./mm2。在萌发阶段, 固定盐度和变化盐度下浒苔配子萌发过程相似, 7天内均能够完全萌发。
综上所述, 盐度在5~35范围内微观繁殖体均可完全萌发生长, 盐度在15~35可以生殖产生新的微观繁殖体, 完成一个完整的生活史过程。但是, 低盐(≤10)会限制浒苔的生长和繁殖过程。本实验盐度范围涵盖了苏北浅滩盐度区间(25~30), 在苏北浅滩盐度范围, 微观繁殖体可以萌发生长, 长成的藻体也可以完成繁殖过程, 产生新的微观繁殖体, 为浒苔发生发展不断补充微观繁殖体; 在青岛盐度范围(30~31)内, 盐度不会影响微观繁殖体的生长发育, 可以完成生活史。本文在已有科学认知上进一步明确了盐度在浒苔生活史不同阶段的作用, 揭示了盐度不是限制苏北浅滩和青岛海域浒苔微观繁殖体生长和藻体繁殖的关键环境因子, 推测在绿潮漂移过程中环境条件复杂多变, 当盐度变化剧烈时, 微观繁殖体也可以萌发生长完成生活史, 保证漂浮绿潮的生物量, 同时浒苔采用不同的生殖对策应对多变的环境, 浒苔产生的孢子量少但个体较大, 则通过快速固着萌发发育成藻体, 保证“质量”为漂浮绿藻提供来源; 配子产生量大, 固着萌发速度较慢, 通过“数量”为漂浮藻体提供生物量基础。
4 结论
本文通过室内实验研究了不同盐度梯度以及变化盐度对浒苔配子和孢子固着、萌发、生长以及繁殖过程的影响, 主要结论如下。固着萌发阶段, 盐度5不利于浒苔微观繁殖体的固着; 盐度5~35范围内, 微观繁殖体均可以在7天内完全萌发。盐度变化对微观繁殖体的萌发没有影响。孢子固着及萌发速度均快于配子。生长阶段, 低盐条件下5~15不利于浒苔幼苗的生长。繁殖阶段, 浒苔释放微观繁殖体的盐度范围为15~35, 低盐(5~10)浒苔藻体不会进行生殖活动。在绿潮形成过程中, 孢子的生殖策略为K对策, 配子的生殖策略为R对策。
综上, 在苏北浅滩和青岛海域, 盐度不是限制浒苔发生发展及繁殖过程的关键环境因子, 明确了盐度对浒苔生活史不同阶段的影响及在绿潮发展过程中作用, 探讨了不同微观繁殖体类型应对变化环境的生殖策略, 加深对绿潮发生及发展机制的理解, 为应对和防控黄海绿潮问题提供重要的思路。今后研究中, 对于控制绿潮早期发展过程的关键环境因素, 以及绿潮防控治理等仍需开展进一步研究。
于仁成, 孙松, 颜天等, 2018. 黄海绿潮研究: 回顾与展望[J]. 海洋与湖沼, 49(5): 942-949.
王广策, 唐学玺, 何培民等, 2016. 浒苔光合作用等关键生理过程对环境因子响应途径的研究进展[J]. 植物生理学报, 52(11): 1627-1636.
王建伟, 阎斌伦, 林阿朋等, 2007. 浒苔()生长及孢子释放的生态因子研究[J]. 海洋通报, 26(2): 60-65.
王津果, 陈泽宇, 倪嘉璇等, 2022. 光照强度和盐度对浒苔幼苗生长和光合生理的影响[J]. 江苏海洋大学学报(自然科学版), 31(4): 1-10.
王晓坤, 马家海, 叶道才等, 2007. 浒苔()生活史的初步研究[J]. 海洋通报, 26(5): 112-116.
刘青, 2015. 黄海绿潮浒苔与浮游植物间的相互作用研究[D]. 青岛: 中国科学院研究生院(海洋研究所).
吴洪喜, 徐爱光, 吴美宁, 2000. 浒苔实验生态的初步研究[J]. 浙江海洋学院学报(自然科学版), 19(3): 230-234.
张华伟, 马家海, 胡翔等, 2011. 绿潮漂浮浒苔繁殖特性的研究[J]. 上海海洋大学学报, 20(4): 600-606.
张晓红, 王宗灵, 李瑞香等, 2012. 不同温度、盐度下浒苔()群体增长和生殖的显微观测[J]. 海洋科学进展, 30(2): 276-283.
罗民波, 刘峰, 2011. 黄海绿潮浒苔()的生长生殖对不同盐度的响应研究[C] // 十一五农业环境研究回顾与展望——第四届全国农业环境科学学术研讨会论文集. 呼和浩特: 中国农业生态环境保护协会: 481-486.
郑阵兵, 高山, 王广策, 2018. 2017年绿潮浒苔()生理特征及孢子囊形成情况分析[J]. 海洋与湖沼, 49(5): 999-1005.
赵瑾, 马莹莹, 解威峰, 等, 2018. 盐度与种间竞争对漂浮生态型浒苔微繁体萌发和生长的影响[J]. 海洋与湖沼, 49(5): 991-998.
韩红宾, 韦章良, 霍元子, 等, 2015. 温度与光照强度对浒苔孢子/配子放散和萌发的影响[J]. 海洋渔业, 37(6): 517-524.
颜天, 于仁成, 周名江, 等, 2018. 黄海海域大规模绿潮成因与应对策略——“鳌山计划”研究进展[J]. 海洋与湖沼, 49(5): 950-958.
BEWS E, BOOHER L, POLIZZI T, 2021. Effects of salinity and nutrients on metabolism and growth of: Implications for bioremediation of coastal watersheds [J]. Marine Pollution Bulletin, 166: 112199.
BISSON M A, KIRST G O, 1979. Osmotic adaption in the marine alga(Rhodophyceae): the role of ions and organic compounds [J]. Functional Plant Biology, 6(4): 523-538.
CAO J X, LIU J L, ZHAO S, 2023. Advances in the research on micropropagules and their role in green tide outbreaks in the Southern Yellow Sea [J]. Marine Pollution Bulletin, 188: 114710.
CHEN B B, ZOU D H, 2015. Altered seawater salinity levels affected growth and photosynthesis of(Ulvales, Chlorophyta) germlings [J]. Acta Oceanologica Sinica, 34(8): 108-113.
CHOI T S, KANG E J, KIM J H, 2010. Effect of salinity on growth and nutrient uptake of(Chlorophyta) from an eelgrass bed [J]. Algae, 25(1): 17-26.
CHOKSHI K, PANCHA I, GHOSH A, 2017. Salinity induced oxidative stress alters the physiological responses and improves the biofuel potential of green microalgae[J]. Bioresource Technology, 244: 1376-1383.
CHRISTIE A O, EVANS L V, 1962. Periodicity in the liberation of gametes and zoospores ofLink [J]. Nature, 193(4811): 193-194.
CUI J J, SHI J T, ZHANG J H, 2018. Rapid expansion ofblooms in the Yellow Sea, China through sexual reproduction and vegetative growth [J]. Marine Pollution Bulletin, 130: 223-228.
DAN A, HIRAOKA M, OHNO M, 2002. Observations on the effect of salinity and photon fluence rate on the induction of sporulation and rhizoid formation in the green alga(Muller) J. Agardh (Chlorophyta, Ulvales) [J]. Fisheries Science, 68(6): 1182-1188.
DING L P, FEI X G, LU Q Q, 2009. The possibility analysis of habitats, origin and reappearance of bloom green alga () on inshore of western Yellow Sea [J]. Chinese Journal of Oceanology and Limnology, 27(3): 421-424.
DUAN W J, GUO L X, SUN D, 2012. Morphological and molecular characterization of free-floating and attached green macroalgaespp. in the Yellow Sea of China [J]. Journal of Applied Phycology, 24(1): 97-108.
HOFFMANN A J, SANTELICES B, 1991. Banks of algal microscopic forms: hypotheses on their functioning and comparisons with seed banks [J]. Marine Ecology Progress Series, 79(1/2): 185-194.
HOXMARK R C, 1975. Experimental analysis of the life cycle of[J]. Botanica Marina, 18(2): 123-129.
HOXMARK R C, NORDBY Ø, 1974. Haploid meiosis as a regular phenomenon in the life cycle of[J]. Hereditas, 76(2): 239-249.
HUO Y Z, HAN H B, HUA L, 2016. Tracing the origin of green macroalgal blooms based on the large scale spatio-temporal distribution ofmicroscopic propagules and settled maturevegetative thalli in coastal regions of the Yellow Sea, China [J]. Harmful Algae, 59: 91-99.
HUO Y Z, HUA L, WU H L, 2014. Abundance and distribution ofmicroscopic propagules associated with a green tide in the southern coast of the Yellow Sea [J]. Harmful Algae, 39: 357-364.
HUO Y Z, ZHANG J H, CHEN L P, 2013. Green algae blooms caused byin the southern Yellow Sea: identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period [J]. Limnology and Oceanography, 58(6): 2206-2218.
IMCHEN T, 2012. Recruitment potential of a green algaWulfen dark preserved zoospore and its development [J]. PLoS One, 7(3): e32651.
KAMER K, FONG P, 2000. A fluctuating salinity regime mitigates the negative effects of reduced salinity on the estuarine macroalga,(L.) link [J]. Journal of Experimental Marine Biology and Ecology, 254(1): 53-69.
KAMER K, FONG P, 2001. Nitrogen enrichment ameliorates the negative effects of reduced salinity on the green macroalga[J]. Marine Ecology Progress Series, 218: 87-93.
LELIAERT F, ZHANG X W, YE N H, 2009. Research note: identity of the Qingdao algal bloom [J]. Phycological Research, 57(2): 147-151.
LI Y H, WANG D, XU X T, 2017. Physiological responses of a green algae () exposed to simulated acid rain and decreased salinity [J]. Photosynthetica, 55(4): 623-629.
LIN A P, SHEN S D, WANG J W, 2008. Reproduction diversity of[J]. Journal of Integrative Plant Biology, 50(5): 622-629.
LIU F, PANG S J, ZHAO X B,, 2012. Quantitative, molecular and growth analyses ofmicroscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred [J]. Marine Environmental Research, 74: 56-63.
LIU Q, YU R C, YAN T, 2015. Laboratory study on the life history of bloom-formingin the Yellow Sea [J]. Estuarine, Coastal and Shelf Science, 163: 82-88.
LOTZE H K, SCHRAMM W, SCHORIES D, 1999. Control of macroalgal blooms at early developmental stages:versusspp. [J]. Oecologia, 119(1): 46-54.
MARTINS I, OLIVEIRA J M, FLINDT M R,, 1999. The effect of salinity on the growth rate of the macroalgae(Chlorophyta) in the Mondego estuary (west Portugal) [J]. Acta Oecologica, 20(4): 259-265.
RYBAK A S, 2018. Species of(Ulvophyceae, Chlorophyta) as indicators of salinity [J]. Ecological Indicators, 85: 253-261.
SOUSA A I, MARTINS I, LILLEBØ A I, 2007. Influence of salinity, nutrients and light on the germination and growth ofsp. spores [J]. Journal of Experimental Marine Biology and Ecology, 341(1): 142-150.
SUN S, WANG F, LI C L, 2008. Emerging challenges: massive green algae blooms in the Yellow Sea [J]. Nature Precedings, doi: 10.1038/npre.2008.2266.1.
TOUCHETTE B W, 2007. Seagrass-salinity interactions: physiological mechanisms used by submersed marine angiosperms for a life at sea [J]. Journal of Experimental Marine Biology and Ecology, 350(1/2): 194-215.
WANG H, LIN A P, GU W H, 2016. The sporulation of the green algais controlled by changes in photosynthetic electron transport chain [J]. Scientific Reports, 6: 24923.
WANG H, WANG G C, GU W H, 2020. Macroalgal blooms caused by marine nutrient changes resulting from human activities [J]. Journal of Applied Ecology, 57(4): 766-776.
WANG Z L, XIAO J, FAN S L, 2015. Who made the world's largest green tide in China?-An integrated study on the initiation and early development of the green tide in Yellow Sea [J]. Limnology and Oceanography, 60(4): 1105-1117.
XIAO J, ZHANG X H, GAO C L, 2016. Effect of temperature, salinity and irradiance on growth and photosynthesis of[J]. Acta Oceanologica Sinica, 35(10): 114-121.
YE N H, ZHANG X W, MAO Y Z, 2011. ‘Green tides’ are overwhelming the coastline of our blue planet: taking the world’s largest example [J]. Ecological Research, 26(3): 477-485.
ZHANG J H, HUO Y Z, YU K F, 2013. Growth characteristics and reproductive capability of green tide algae in Rudong coast, China [J]. Journal of Applied Phycology, 25(3): 795-803.
ZHANG H B, WANG G S, ZHANG C S, 2020. Characterization of the development stages and roles of nutrients and other environmental factors in green tides in the Southern Yellow Sea, China [J]. Harmful Algae, 98: 101893.
ZHAO X H, CUI J J, ZHANG J H, 2019. Reproductive strategy of the floating algain blooms in the Yellow Sea based on a combination of zoid and chromosome analysis [J]. Marine Pollution Bulletin, 146: 584-590.
ZHAO S B, XU B C, YAO Q Z, 2021. Nutrient-rich submarine groundwater discharge fuels the largest green tide in the world [J]. Science of the Total Environment, 770: 144845.
ZHOU M J, LIU D Y, ANDERSON D M, 2015. Introduction to the Special Issue on green tides in the Yellow Sea [J]. Estuarine, Coastal and Shelf Science, 163: 3-8.
EFFECT OF SALINITY ON THE GERMINATION AND GROWTH OF MICROPROPAGULES AND ALGAL REPRODUCTION OF
MA Wei-Wei1, 2, 3, WANG Nan1, 2, SUN Yan1, 2, SUN Song1, 2, 3
(1. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Jiaozhou Bay Marine Ecosystem Research Station, Chinese Academy of Sciences, Qingdao 266071, China)
The Yellow Sea green tide originates from the Subei shoal and drifts to the coast of Qingdao every summer, causing serious damage to the ecological environment. The salinity of Qingdao coastal waters is more stable and slightly higher than that of Subei shoal. Salinity plays an important role in the germination of micropropagules, algal growth, and reproduction process of. Therefore, the effects of fixed salinity (5, 10, 15, 20, 25, 30, 33, 35) and variable salinity (salinity gradually decreases) on different stages oflife history attachment, germination, growth, and reproduction were systematically studied through indoor continuous controlled experiments. Results show that the effect of salinity 10~35 on micropropagules attachment was not significant, and the attachment amount of spores was significantly higher than that of gametes at the same salinity. In the germination stage, different salinities (5~35) and the forms of salinity changes did not show significant effects on the germination of micropropagules (spores and gametes), the germination of spores was faster than that of gametes, and both eventually germinated completely. In the growth stage, low salinity (5~15) was not conducive to the growth ofseedlings. In the reproduction stage, when the salinity was ≤10, thedid not reproduce. In the range of salinity 15~35,could produce micropropagules and completed its life history. In the process of green tide formation, the reproductive strategy of spores was the K response and that of gametes was the R response. The above findings indicate that salinity was not a key environmental factor limiting the development and reproduction process ofin the Subei Shoal and Qingdao coastal waters, clarifying the role of salinity in the process of green tide occurrence and providing a scientific basis for understanding the mechanism of green tide outbreak.
salinity;; micropropagules of; germination and growth; reproduction
* 崂山实验室科技创新项目资助, LSKJ202204005号。马薇薇, 博士研究生, E-mail: 836938134@qq.com
孙 松, 博士生导师, 研究员, E-mail: sunsong@qdio.ac.cn
2023-04-13,
2023-05-05
P76
10.11693/hyhz20230400085

