α-三联噻吩对舞毒蛾幼虫的杀虫活性和生理生化影响
李奇萌,陈运泽,赵国成,杨璟,张国财
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.贵州师范学院生物科学学院,贵州 贵阳 550018;3.宾县太平山林场,黑龙江 宾县 150424;4.贵州大学林学院,贵州 贵阳 550025)
舞毒蛾Lymantria disparLinnaeus,隶属鳞翅目Lepidoptera 毒蛾科Lymantriidae,是一种杂食性食叶害虫,在我国分布范围广泛,能够危害杨树、柳树及榆树等500 多种寄主植物,危害重且经常周期性发生,对林木生长造成严重影响,给我国林业生产造成巨大经济损失[1]。目前,舞毒蛾的防治大多采用化学防治方法,由于化学农药的不合理使用,“3R”问题愈演愈烈。植物源农药的有效成分是植物次生代谢物质,其来源于植物体内,具有易降解、安全性较高、昆虫不易产生抗药性等优点[2];植物次生代谢物质不仅具有杀虫作用,还具有抗真菌作用[3]。因此,开发利用植物源农药防治有害生物能够降低化学药剂引起的系列问题。
α-三联噻吩(α-terthienyl,α-T),作为一种重要的植物次生代谢产物,广泛存在于万寿菊Tagetes erecta、孔雀草Tagetes patula、鳢肠Eclipta prostrata等菊科植物中[4],对烟草天蛾Manduca sexta和欧洲玉米螟Ostrinia nubilalis及合毒蛾Orgyia leucostigma等农林害虫具有较强的杀虫活性[5],亚致死剂量的α-T 能够诱导棉铃虫Helicoverpa armigera和亚洲玉米螟Ostrinia furnacalis中肠细胞产生明显病变[6]。蛋白质、碳水化合物和脂肪是昆虫生长发育所必需的营养成分和能量来源,昆虫能够通过调节自身特定的代谢途径,将其转化成为能够保障生命活动所需的各种营养和能量,以维持其正常的生命活动[7]。当受到不良胁迫时,昆虫自身会产生一系列生理反应,体内原有的营养积累和组分发生变化起到保护昆虫有机体的作用[8]。在重金属胁迫下,舞毒蛾幼虫的营养取食和营养成分均受到影响,舞毒蛾幼虫通过提升自身抗氧化力来应对重金属的胁迫[9]。昆虫的抗氧化系统主要由包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)等抗氧化酶和抗氧化剂构成[10],在昆虫受到外界不良因素的危害时,起到保护昆虫正常生长发育、生理功能正常发挥的防御作用[11]。荧蒽能够提高舞毒蛾幼虫中肠中SOD 和CAT 活性,随着荧蒽浓度的变化,SOD和CAT 活性也有所不同[12]。昆虫抗氧化酶活性受到抑制,会导致氧化应激和细胞凋亡[13]。中肠是昆虫食物消化和营养吸收的主要器官,对昆虫的生长发育有着至关重要的影响[14]。昆虫中肠上皮细胞分泌消化酶,可以作用于蛋白质 、碳水化合物和脂肪等基质[15]。
α-T 对16 种陆生昆虫均有杀虫活性,鳞翅目幼虫除黑行军虫Actebia fennica具有高度耐受性外,均为敏感昆虫,α-T 对舞毒蛾2 龄幼虫具有毒杀作用,但α-T 对舞毒蛾幼虫生理生化的影响尚不明确[16]。笔者以舞毒蛾3 龄幼虫为供试昆虫,测定α-T 对舞毒蛾3 龄幼虫的生物杀虫活性,对其生长发育、基本营养物质、抗氧化酶(SOD、CAT 和POD)酶活性以及对中肠结构的影响,旨在为α-T 的开发利用和舞毒蛾的防治提供依据。
1 材料与方法
1.1 供试材料
纯度大于97% 的分析纯α-三联噻吩(α-terthienyl),上海阿拉丁生化科技股份有限公司;分析纯二甲基亚砜(DMSO),天津市永大化学试剂有限公司;过氧化氢酶、超氧化物歧化酶、过氧化物酶酶活性试剂盒(货号分别为G0105W、G0101W、G0107W,说明书均可在官网上查到),苏州格锐思生物科技有限公司。
舞毒蛾卵块采自东北林业大学哈尔滨实验林场,采回后放置于4 ℃冰箱保存备用。舞毒蛾饲料购于中国林业科学研究院森林生态环境与自然保护研究所。将舞毒蛾虫卵放入10%甲醛溶液中浸泡30 min 后,用流水将虫卵表面的甲醛冲净,置于温度(25 ± 1)℃,光周期16L∶8D,相对湿度(75 ±1)%的人工培养箱内饲养;随机挑选大小一致、饥饿12 h 的3 龄幼虫,用于测定[17]。
1.2 α-T 对舞毒蛾3 龄幼虫的毒力测定
根据饲料混药法[18],将α-T 溶于体积含量为10%的DMSO 溶液中形成α-T 母液,用蒸馏水将此母液对半稀释,配制成质量浓度为1 000,500,250,125,62.50,31.25 μg/mL 的药液,置于黑光灯下(功率15 W,灯管与桌面距离为17 cm)光照3 h。选取体型相近的舞毒蛾3 龄幼虫,饥饿处理12 h,每个质量浓度的α-T 处理30 头幼虫,重复3 次,以10%DMSO溶液处理为对照,于处理后72 h 统计死亡虫数,计算死亡率和校正死亡率,利用SPSS19.0软件计算α-T 对舞毒蛾3 龄幼虫处理72 h 的亚致死浓度(LC20)和致死中浓度(LC50)。
死亡率(%)=死亡虫数/供试虫数×100;校正死亡率(%)=(处理死亡率-对照死亡率)/(1-对照死亡率)×100。
1.3 α-T 对舞毒蛾3 龄幼虫生长发育影响的测量
根据毒力测定结果,采用LC20和LC50的α-T处理舞毒蛾3 龄幼虫,以10% 的DMSO 溶液处理为对照组,每处理组30 头幼虫,重复3 次;分别在0,12,24,48,72 h 称量幼虫体质量、饲料和粪便的质量,参考邹传山 等[19]的方法,校正饲料的自然失水率,计算体质量增长量、取食量和粪便量。
1.4 α-T 对舞毒蛾3 龄幼虫基本营养物质含量影响的测定
采用LC20和LC50的α-T 处理舞毒蛾3 龄幼虫,以10% DMSO 溶液处理为对照组,每组30 头幼虫,重复3 次,分别于24,48,72 h 将试虫液氮速冻,-80 ℃保存备用。用液氮对试虫进行充分研磨后,取0.1 g样品,加入1 mL 的生理盐水冰浴匀浆,4 ℃条件下12 000 r/m 离心10 min,取上清液作为蛋白质、碳水化合物和海藻糖含量的测定样品。蛋白质含量的测定采用Bradford 考马斯亮蓝G-250 法[20],碳水化合物含量的测定参考Roe[21]的方法,海藻糖含量的测定采用雷芳 等改进的蒽酮法[22],脂质含量的测定采用石中斌 等的方法测定[23]。
1.5 α-T 对舞毒蛾3 龄幼虫中肠抗氧化酶活性的测定
挑选舞毒蛾3 龄幼虫,用LC20和LC50的α-T处理,以10% 的DMSO 溶液处理为对照组,每组30 头幼虫,重复3 次,分别于24,48,72 h 时解剖舞毒蛾幼虫,中肠取出后放入PE 管分装液氮速冻,放入-80 ℃冰箱备用,根据曾健勇 等[24]的方法,采用分光光度法进行测定。
1.6 α-T 对舞毒蛾3 龄幼虫中肠组织影响的观察
以10%DMSO 溶液处理为对照组,LC50的α-T为处理组处理舞毒蛾3 龄幼虫72 h 后解剖,采用HE 染色法[25],将中肠组织浸泡于4%多聚甲醛溶液中固定12 h,制作石蜡切片并于光学显微镜200 倍下观察。
1.7 数据的统计分析
采用SPSS19.0 统计分析舞毒蛾幼虫死亡率、取食量、体质量增长量、粪便量,体内糖、脂及蛋白含量,抗氧化酶活性,并进行单因素方差分析,采用独立样本t检验的方法比较对照组与处理组的差异显著性,并计算相应的统计学参数。
2 结果与分析
2.1 α-T 对舞毒蛾3 龄幼虫的杀虫活性
不同质量浓度α-T 处理舞毒蛾3 龄幼虫72 h后,表现出良好的杀虫活性(表1)。随着质量浓度增加,舞毒蛾3 龄幼虫的死亡率呈上升趋势,在质量浓度1 000 μg/mL 时,舞毒蛾3 龄幼虫的校正死亡率达到(68.97 ± 7.18)%。α-T 处理舞毒蛾3 龄幼虫72 h 的毒力回归方程为y=-2.011 + 0.894x,R2=0.990,卡方检验值χ2=6.98,亚致死浓度(LC20)为20.37 μg/mL,置信区间2.76~46.23 μg/mL,致死中浓度(LC50)为178.13 μg/mL,置信区间97.89~322.70 μg/mL。
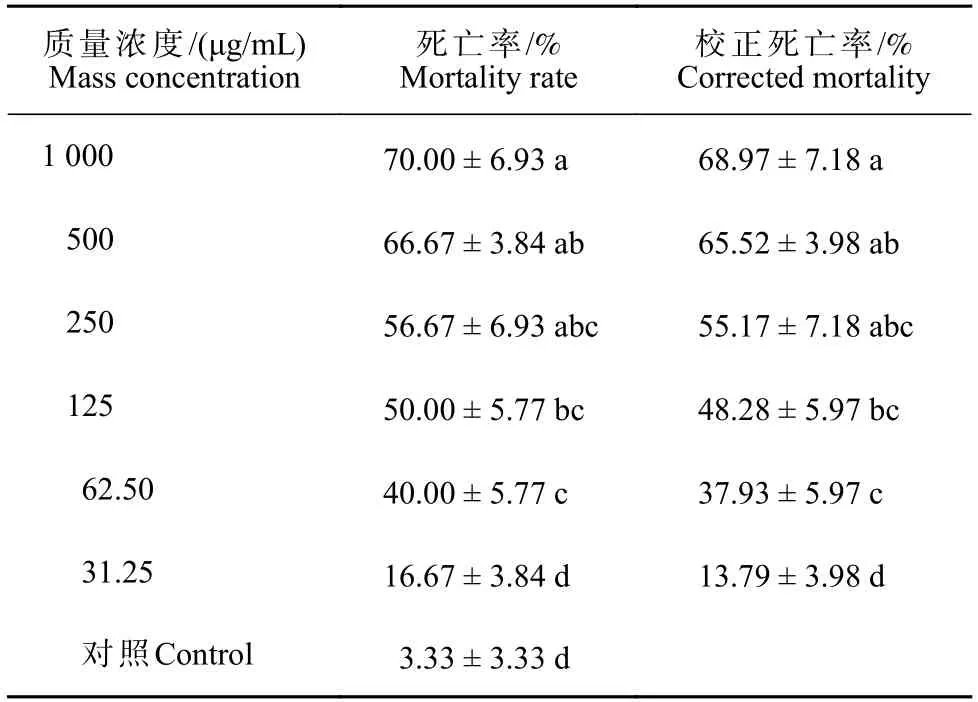
表1 不同质量浓度α-三联噻吩处理72 h 后舞毒蛾幼虫死亡率Tab.1 Mortality rate of L.dispar larvae treated with different mass concentrations of α-T after 72 hours
2.2 α-T 对舞毒蛾幼虫生长发育的影响
LC20和LC50的α-T 处理72 h 后,舞毒蛾幼虫的体质量增长量、取食量、粪便量均显著低于对照组(P<0.05),生长抑制率分别为44.26% 和62.29%,取食量分别降低了35.25%和48.55%,粪便量分别降低了44.71%和63.82%(表2)。

表2 α-三联噻吩对舞毒蛾幼虫生长发育的影响Tab.2 Effects of α-T on the growth and development of L.dispar larvae
2.3 α-T 对舞毒蛾幼虫营养物质含量的影响
α-T 处理72 h 后,LC20和LC50处理组舞毒蛾3龄幼虫体内的可溶性蛋白含量分别为对照组的69.46%和64.87%,显著低于对照组幼虫可溶性蛋白的含量(F=21.514,df=8,P<0.05);LC20与LC50处理组舞毒蛾幼虫体内碳水化合物含量,分别为对照组的75.95% 和65.88%,均显著低于对照组幼虫的含量(F=95.688,df=8,P<0.01);LC20与LC50的α-T处理组舞毒蛾幼虫体内的海藻糖含量分别为对照组的87.64%和82.54%,均显著低于对照组(F=8.519,df=8,P<0.05);LC20与LC50处理组舞毒蛾幼虫体内脂质含量分别为对照组的67.77%和62.68%,显著降低了舞毒蛾幼虫体内脂质的含量(F=42.237,df=8,P<0.01)。见表3。
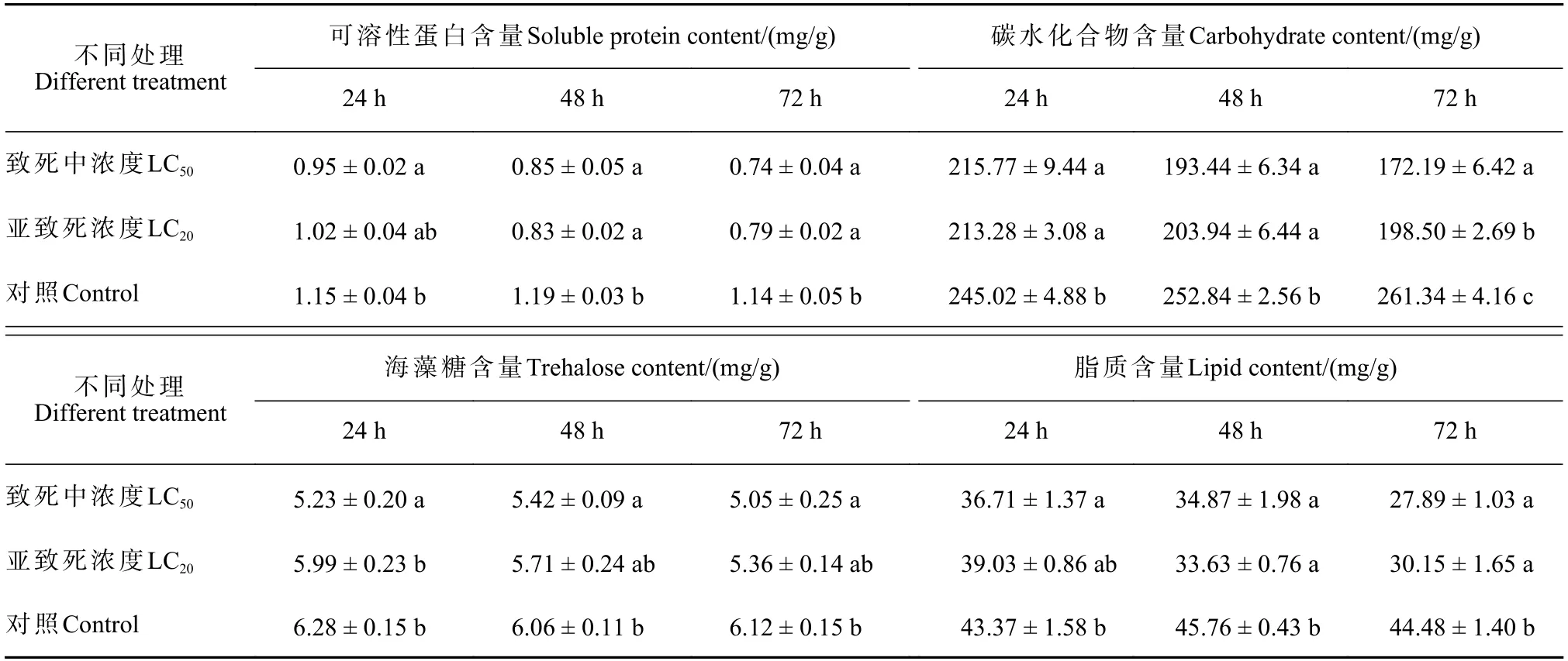
表3 α-三联噻吩对舞毒蛾幼虫体内营养物质含量的影响Tab.3 Effects of α-T on nutrient contents of L.dispar larvae
2.4 α-T 对舞毒蛾幼虫中肠抗氧化酶活性的影响
LC50的α-T 处理舞毒蛾3 龄幼虫中肠72 h 后,CAT 活性显著降低,仅为对照组的82.78%,SOD 活性显著降低,为对照组的70.68%,α-T 对CAT,SOD 活性具有抑制作用;舞毒蛾3 龄幼虫中肠经过α-T 处理72 h 后,POD 酶活性和对照组幼虫相比差异显著,LC50处理组的POD 酶活性显著降低,为对照组的86.67%,LC20处理组的POD 酶活性显著提高,为对照组的1.13 倍。见表4。
2.5 α-T 对舞毒蛾幼虫中肠组织的影响
对照组10%DMSO 溶液处理的舞毒蛾3 龄幼虫中肠细胞结构清晰完整,细胞间排列紧密,肠绒毛分布密集且完整(图1A);LC50的α-T 处理72 h后,舞毒蛾3 龄幼虫中肠组织损伤明显,柱状细胞结构模糊,杯状细胞出现空泡化,肠腔内可见细胞碎片,肠绒毛顶端空泡变性(图1B)。
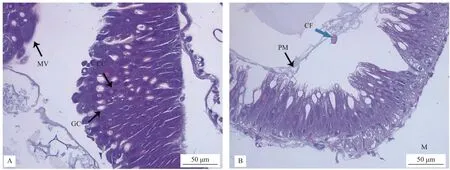
图1 α-三联噻吩处理对舞毒蛾幼虫中肠组织的影响 (A.对照组;B.LC50 处理组)Fig.1 Effects of LC50 α-T on midgut tissue of L.dispar larvae (A.Control group;B.LC50 exposure group)
3 结论与讨论
植物体内含有多种活性物质,受到昆虫侵袭时,植物会主动释放活性物质来抵御昆虫。噻吩类化合物作为植物体内一种重要的活性物质,能够影响昆虫的正常生长发育,甚至导致昆虫死亡[26]。潘忠玉[27]研究发现,植物次生代谢物槲皮素、绿原酸及1-脱氧野尻霉素能够抑制美国白蛾5 龄幼虫的取食和生长发育,并能通过破坏美国白蛾幼虫中肠及脂肪体细胞而产生毒性,处理3 d 后美国白蛾幼虫开始出现死亡个体,死亡高峰期出现在第3~5 天。本研究中,α-T 作为一种植物次生代谢物质,对舞毒蛾3 龄幼虫具有良好的杀虫活性,能够影响幼虫生长发育,经过α-T 处理过的舞毒蛾幼虫体内可溶性蛋白含量、碳水化合物含量、海藻糖含量和脂质含量均有不同程度的下降。Nath 等[28]研究发现有机磷杀虫剂能够影响家蚕脂肪体中的蛋白质、碳水化合物的含量,从而改变它们的代谢功能,以满足杀虫剂胁迫下所需要的能量需求。当舞毒蛾幼虫受到酸碱胁迫时,碳水化合物含量下降30.03%,海藻糖含量和脂质含量均显著降低,同时舞毒蛾幼虫的抗氧化系统被激活[29]。昆虫的抗氧化系统主要由抗氧化酶(SOD、CAT 及POD 等)和小分子化合物组成。昆虫的SOD 主要存在于中肠、血淋巴、脂肪体及体壁等组织中,SOD 能将超氧阴离子如O2-转化为H2O2[30],然后通过CAT 的催化将过氧化氢分解为水和氧气[31]。高浓度荧蒽可以提高蚯蚓体内的CAT活性,从而导致蚯蚓的急性应激反应[32]。香芹酚能够显著提高舞毒蛾幼虫体内SOD、CAT 的酶活性,舞毒蛾体内SOD 活性增加是为了消除由香芹酚引起的氧化应激反应[33]。本研究中,低质量浓度α-T能够激活舞毒蛾幼虫体内超氧化物歧化酶、过氧化物酶等抗氧化酶活性,而高质量浓度的α-T 能够抑制抗氧化酶活性,表明α-T 能够通过调节抗氧化酶活性引起氧化应激反应造成对舞毒蛾幼虫中肠组织的损伤。这与章杰 等[34]研究α-T 对埃及伊蚊Aedes aegypti4 龄幼虫影响的结果相吻合。
消化和吸收是中肠的主要功能,中肠是消化道最活跃的区域,对于昆虫来说是不可或缺的[35]。本研究中,通过HE 染色法,观察到α-T 对舞毒蛾3 龄幼虫中肠组织细胞具有损伤作用。中肠异常可能会导致舞毒蛾幼虫蛋白质、碳水化合物、脂肪、维生素和矿物质等营养物质消化和吸收功能的紊乱。因此,中肠可能是α-T 作用的主要部位。
α-T 能够抑制舞毒蛾3 龄幼虫体内抗氧化酶活性,诱发中肠组织氧化应激反应,并对幼虫中肠细胞造成损伤,从而严重影响舞毒蛾幼虫营养代谢过程,导致舞毒蛾幼虫的生长发育受到抑制,进而产生毒性。推测α-T 对舞毒蛾幼虫的主要作用部位可能是中肠,但α-T 对舞毒蛾幼虫mRNA 表达水平上的影响尚不明确,下一步将基于mRNA 表达水平测定α-T 对舞毒蛾3 龄幼虫中肠的影响,为植物源农药的开发利用及舞毒蛾无公害防治提供理论依据。

