食用木薯粉脂肪酸组成分析及贮藏时间对其影响
王琴飞,余厚美,吴若娜,林立铭,谭婉碧,2,张振文, ,羊贤月
(1.中国热带农业科学院热带作物品种资源研究所/国家薯类加工技术研发分中心,海南海口 571101;2.武汉轻工大学食品科学与工程学院,湖北武汉 430023)
木薯(Manihot seculentaCrantz)富含淀粉、膳食纤维、维生素及多种矿物质元素,是世界重要的粮食作物之一,为全世界近10 亿人提供口粮,具有低糖、低脂,饱腹感强,有助于预防和控制肥胖症、心血管疾病和消化系统疾病等特点[1-3],木薯相关食品研发和推广已经成为当前稳定世界粮食危机有效供给的重要保障[3-4]。食用木薯粉是木薯“食用化”主要利用方式,与小麦面粉类似,是制作糕点、面条、饼干等食品的重要原料[4-6]。木薯种植和加工企业多处于热带、亚热带高温高湿气候环境,这种高温高湿是促进木薯粉变质的主要外界因素[7]。Hawa 等[7]和林立铭等[8]研究表明,食用木薯粉贮藏过程易吸潮,存在营养品质下降和明显的吸潮现象,过氧化值和酸价在贮藏4 个月时显著升高,证明食用木薯粉贮藏过程中存在脂肪酸酸败可能。多不饱和脂肪酸的组成和含量影响食品的酸败进程,继而影响食品的风味和货架期[9]。然而木薯粉中脂肪酸组成并不明确,了解和掌握木薯粉脂肪酸的组成和含量,是评价木薯粉营养品质的重要依据,也是评价酸败进程的重要指标之一。目前,常用气相色谱-质谱联用(GC-MS)、气相色谱-火焰光度(GC-FID)法对多种脂肪酸进行定性定量检测[10],而检测结果的准确性和重复性常与脂肪酸甲酯化方法有关,不同样品和脂肪酸种类采用的脂肪酸甲酯化方法不相同[11]。因此,本研究通过优化食用木薯粉脂肪酸甲酯化和检测方法,对不同品种(系)和不同贮藏时间食用木薯粉的脂肪酸组成和含量进行分析,以期为评价不同品种(系)食用木薯粉中脂肪酸的营养品质差异,食用木薯粉贮藏过程中脂肪酸的变化提供检测依据。
1 材料与方法
1.1 材料与仪器
食用木薯块根 采收于海南儋州国家木薯种质资源圃,木薯种植后第9 个月采收,参试品种(系)分别为‘华南9 号’(SC9)、‘华南12 号’(SC12)、‘华南14 号’(SC14)、‘1301’(1301)、‘华南6068’(SC6068);正己烷(纯度≥99.0%)色谱纯,美国Fisher Chemical 公司;正己烷、甲醇、氢氧化钾等 分析纯,国药集团化学试剂有限公司;标准试剂:三甲基氢氧化硫溶液、棕榈酸甲酯(Methyl Palmitate)、硬脂酸甲酯(Methyl Stearate)、油酸甲酯(Methyl Oleate)、亚油酸甲酯(Methyl Linoleate)、亚麻酸甲酯(Methyl Linolenic Acid)、37 种脂肪酸甲酯混合标样(C4~C22,纯度≥99.0%)美国Sigma-Aldrich 公司。
Agilent7890 型气相色谱系统,配备G4513 型自动进样器,5977A 型质谱检测器;色谱柱为Agilent DB FastFAME 3903-12013(60 m×0.25 mm×0.25 μm)购于美国安捷伦科技有限公司;Eppendorf 5810R型离心机 购于德国艾本德股份有限公司;NDK200-2型氮吹仪 购于杭州米欧仪器有限公司。
1.2 实验方法
1.2.1 食用木薯粉的制备和贮藏 木薯块根采收后,参照林立铭等[12]方法,当天进行剥皮、清洗、切丝、烘干,最后粉碎、过筛制成木薯粉保存。不同品种(系)木薯块根制成木薯粉后,随机分取200.0 g 以上的样品放置于-18 ℃冰箱保存待测(表1)。选用SC9 品种制成的木薯粉,考察不同贮藏时间脂肪酸的变化,木薯粉混合后,随机称取200.0 g 装入密封袋中,置于人工气候箱中常温贮藏(温度25±5 ℃,湿度60%±5%),在贮藏0~26 周(182 d)时间内,每隔2 周取样1 次,每次取4 袋,共取样13 次。取样后木薯粉放置于-18 ℃冰箱保存待测。
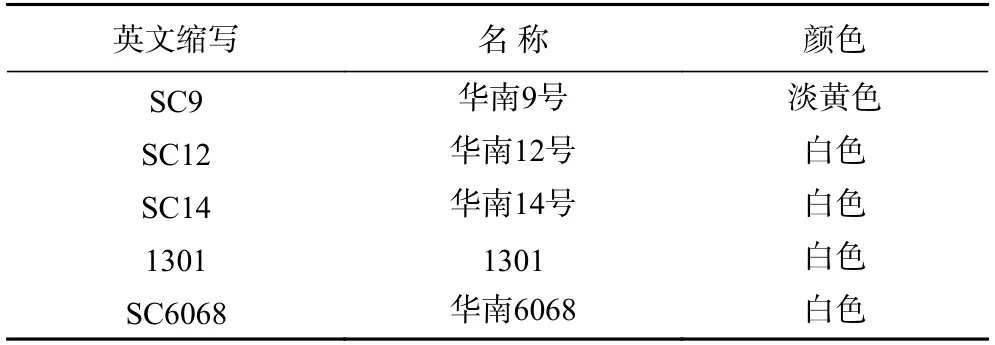
表1 参试食用木薯品种(系)的木薯粉性状Table 1 The characteristics of cassava powder of tested cassava varieties (strains)
1.2.2 食用木薯粉脂肪酸提取 准确称取食用木薯粉3.00 g(精确到0.01 g),置于50 mL 离心管,加入正己烷15.0 mL,混匀,漩涡震荡2 min。离心10 min(10000 r/min,25 ℃),吸取上清液5.0 mL 转入15 mL离心管,室温下氮气吹干,即得木薯粉脂质。
1.2.3 食用木薯粉脂肪酸甲酯化方法优化 参考文献[13-14]方法稍做修改,选择两种甲酯化方法进行比较。方法(a)加入正己烷100 μL 溶解1.2.2 获得的脂质,再加入800 μL 甲醇混匀,加入100 μL 三甲基氢氧化硫(TMSH)进行甲酯化反应,静置30 min后,经0.45 μm 针头式微孔滤膜过滤,即为待测液。方法(b)加入正己烷100 μL 溶解1.2.2 获得的脂质,再加入1 mL 0.5 mol/L 的KOH-甲醇溶液,具塞于65 °C 下皂化 30 min,反应期间每10 min 振荡5 s,随后加入1 mL 现配的BF3(三氟化硼)甲醇溶液(v/v,1:3),具塞后在70 ℃下保持10 min,冷却至室温后加入1 mL 正己烷萃取脂肪酸甲酯。振荡、静置分层后,加入饱和NaCl 溶液以提升有机相,取有机相1 mL 加入无水Na2SO4,10000 r/min 离心5 min,上清液经0.45 μm 针头式微孔滤膜过滤,即为待测液。每个样品重复3 次。
1.2.4 GC-MS 分析条件 气相色谱条件:使用色谱柱DB FastFAME 3903-12013(60 m×0.25 mm×0.25 μm),氦气流量为1.0 mL/min;在60 ℃保持1 min,先以30 ℃/min 的速率升温至200 ℃保持18 min,再以5 ℃/min 的速率升温至235 ℃保持8 min;分流比20:1;进样量2 μL;采用混合脂肪酸甲酯标准品对脂肪酸进行定性分析。
质谱条件:EI 电离源,电子能量为70 eV,离子源温度250 ℃,扫描方式为全扫描(Scan:50~500 u)。
1.2.5 GC-FID 色谱条件优化 根据参考色谱柱的推荐方法和性能设置升温程序,以37 种脂肪酸甲酯混合标样,对GC-FID 方法的恒定压力25 psi、30 psi和40 psi 进行优化,按如下色谱条件进样,计算单次进样的载气用量,根据脂肪酸的分离效果,考察最优色谱条件。
色谱条件:气相色谱柱DB FastFAME 3903-12013(60 m×0.25 mm×0.25 μm),以高纯度氮气为载气;分流比25:1;进样口温度250 ℃,程序升温为80 ℃保持1 min,40 ℃/min 升温至200 ℃保持8 min,4 ℃/min 升温至235 ℃保持10 min;进样量5 μL。在该色谱条件下分析标准样品和样品中脂肪酸,每个样品重复3 次。
1.2.6 标准溶液的配制 分别称取适量的棕榈酸甲酯、硬脂酸甲酯、油酸甲酯、亚油酸甲酯和亚麻酸甲酯标准样品,用色谱纯正己烷配制成质量浓度分别为5.0、10.0、50.0、50.0 和50.0 mg/mL 单个标准品母液,保存于-20 ℃冰箱。在分析前用色谱纯正己烷稀释,配制成不同浓度的混合标准溶液,保存于-20 ℃冰箱,待用。
1.3 数据处理
利用Microsoft Excel 2010 和SPSS22.0 软件对脂肪酸含量进行计算和统计分析,采用Tukey 检验分析不同甲酯化方法脂肪酸含量差异显著性,最小显著差数法(LSD)分析品种(系)间脂肪酸含量差异显著性;采用Origin 2021 软件作图。
2 结果与分析
2.1 脂肪酸甲酯化方法选择
食品中脂肪酸多采用正己烷溶液提取,其酸、碱催化两种甲酯化方法的不同,直接影响脂肪酸测定的准确性,实验对甲酯化方法进行了比较,发现两种方法都可以检测到5 种脂肪酸,除硬脂酸外,方法(a)比方法(b)的甲酯化效果更好,达到了极显著性差异(图1),证明方法(a)利用TMSH 对木薯粉脂肪酸进行甲酯化效果更好,而方法(b)0.5 mol/L 的KOH-甲醇溶液反应时间更长,反应步骤更繁琐。寇秀颖等[11]研究表明,酸催化适合游离脂肪酸的甲酯化,而碱催化法更适合脂肪的甲酯化。木薯粉以游离脂肪酸为主,硬脂酸含量相对较少,方法(a)中TMSH 组成为0.25 moL 硫酸-甲醇溶液,更适合木薯粉中脂肪酸的甲酯化。因此,后续实验选择方法(a)甲酯化处理木薯粉样品中脂肪酸。
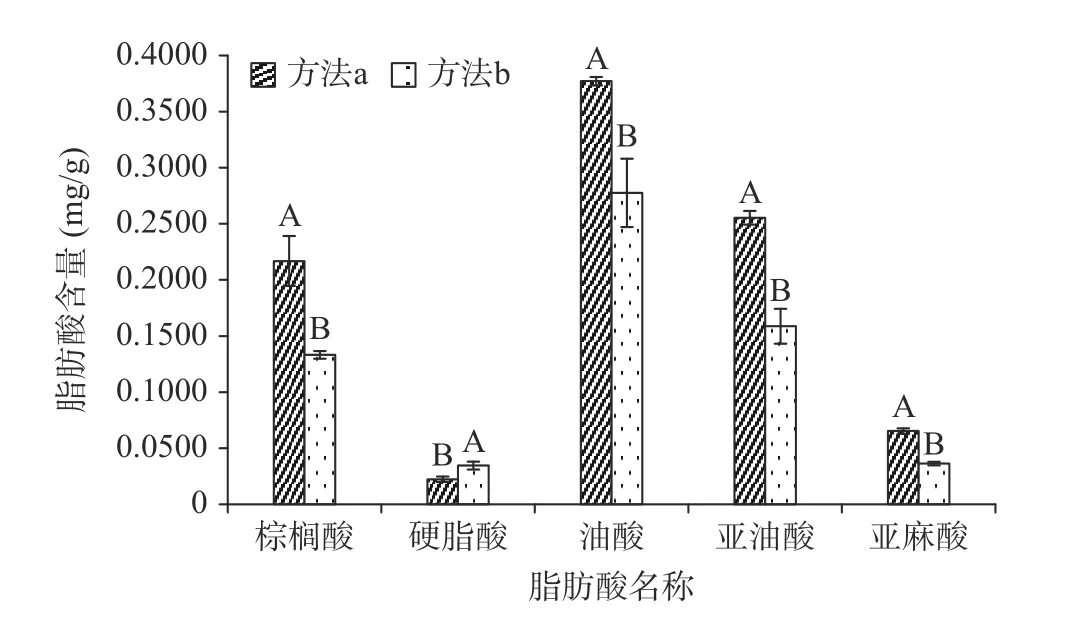
图1 不同甲酯化方法对木薯粉脂肪酸含量的影响Fig.1 Effect of different methyl esterification methods on the content of fatty acids in edible cassava flour
2.2 脂肪酸的定性
在木薯粉脂肪酸组成不明确的情况下,利用GC-MS-Scan 扫描模式,分别以37 种脂肪酸甲酯标准样品与不同品种(系)的木薯粉试样进行比对,结合脂肪酸特征离子,共鉴定出5 种脂肪酸,分别为棕榈酸甲酯、硬脂酸甲酯、油酸甲酯、亚油酸甲酯和亚麻酸甲酯,如图2 所示,5 种脂肪酸甲酯的保留时间分别为13.759、16.743、17.396、18.522 和20.143 min,其特征离子如表2 所示,与标准样品中棕榈酸甲酯、硬脂酸甲酯、油酸甲酯、亚油酸甲酯和亚麻酸甲酯保留时间和特征离子一致。
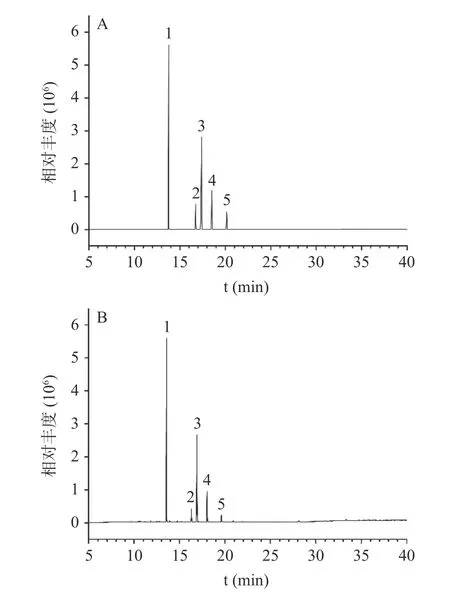
图2 5 种脂肪酸甲酯标准样品与木薯粉试样中脂肪酸总离子流色谱图Fig.2 Total ion chromatogram of fatty acid methyl esters in cassava flour and standard samples of five fatty acid methyl esters
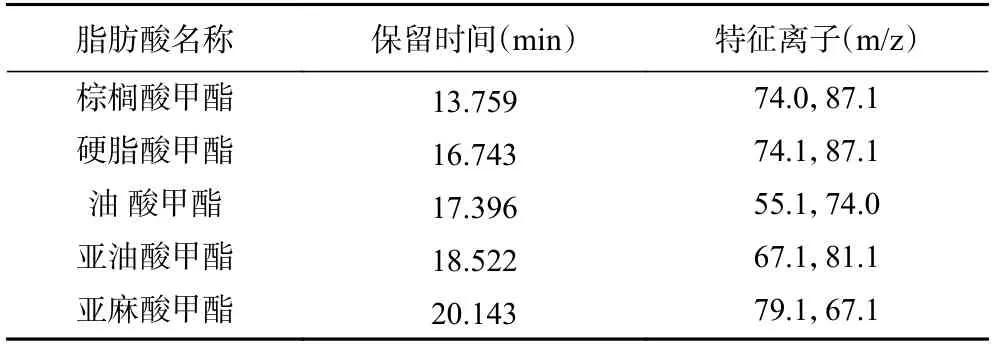
表2 食用木薯粉中脂肪酸甲酯SIM 定量参数Table 2 SIM quantitative parameters of fatty acids of edible cassava flour
2.3 气相色谱分析条件优化
利用37 个脂肪酸甲酯混合标准样品,考察了25、30、40 psi 恒定压力时,样品分析时的载气流速、气体流量和样品分析时间。随着色谱柱恒定压力的升高,载气流速、气流量也升高,样品分析时间减少(表3)。当恒定压力为25 psi 时,单个样品总载气消耗量较30 psi 和40 psi 压力节省载气,且保留时间延长后,相邻两个色谱峰分离更佳(图3~图5)。若色谱柱恒定压力过低(<25 psi),当柱温升高时,载气粘度系数变大,载气速度降低,保留时间延长,出峰时间延长,载气用量反而增加。因此,在保证分离度且目标峰完全分离的前提下,恒定压力设定25 psi,单次进样30 min 后可获得较好的色谱峰形,相邻两个色谱峰分离较好(图5),因此后续实验设定恒定压力25 psi 进行样品分析。
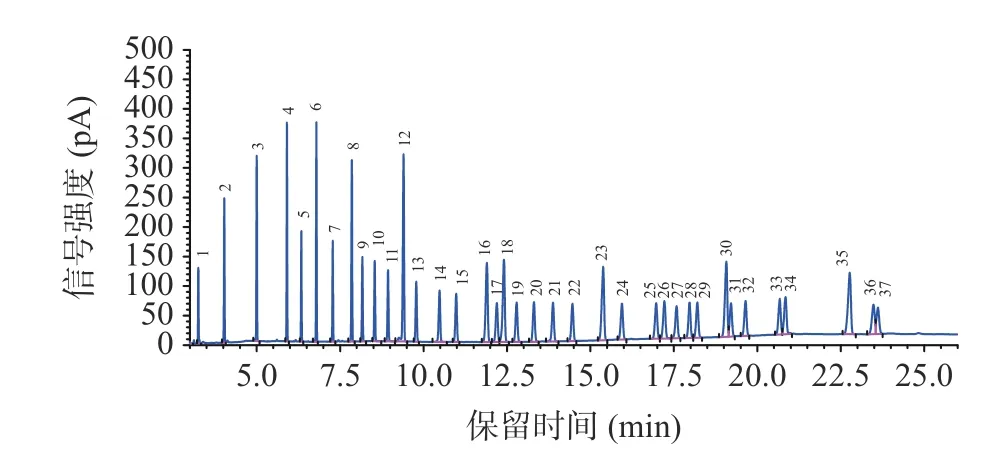
图3 恒定压力为40 psi 时的37 种脂肪酸标准样品色谱图Fig.3 Chromatogram of 37 fatty acid methyl esters standard samples at constant pressure of 40 psi
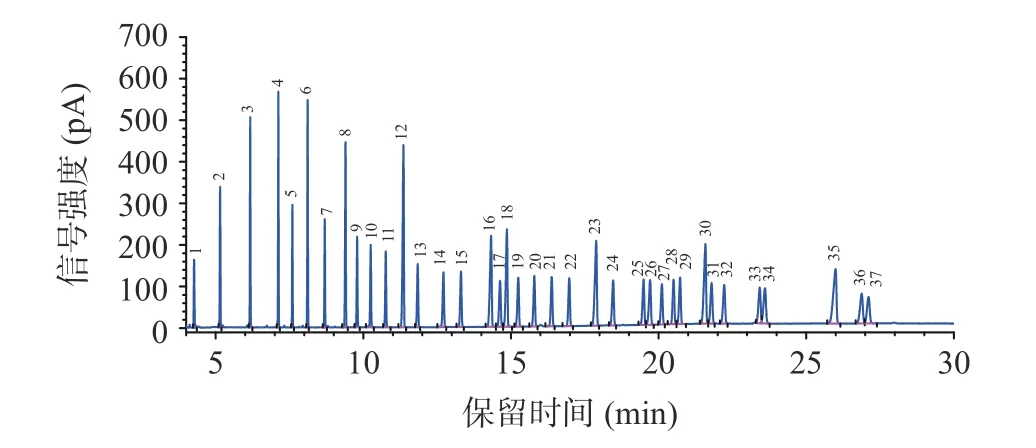
图4 恒定压力为30 psi 时的37 种脂肪酸标准样品色谱图Fig.4 Chromatogram of 37 fatty acid methyl esters standard samples at constant pressure of 30 psi
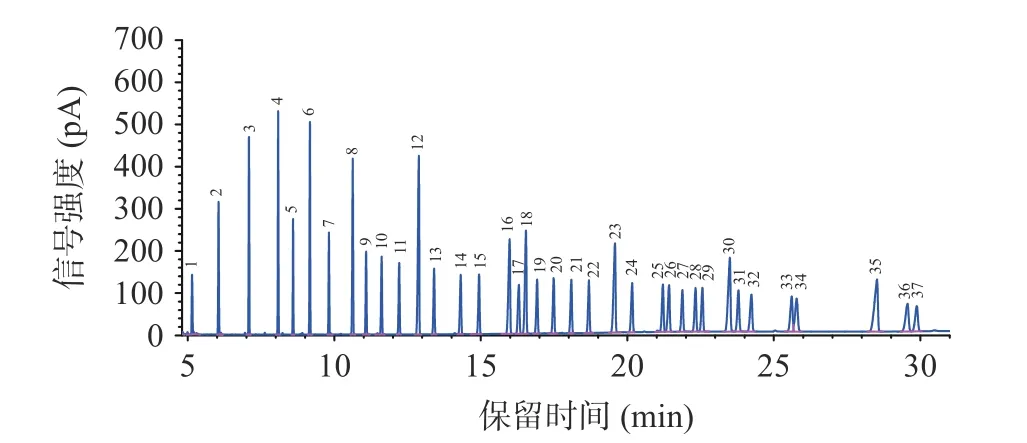
图5 恒定压力为25 psi 时的37 种脂肪酸标准样品色谱图Fig.5 Chromatogram of 37 fatty acid methyl esters standard samples at constant pressure of 25 psi

表3 不同恒定压力下气相色谱柱气体流速、气流量和分析时间Table 3 Gas chromatographic column gas flow rate,gas flow rate,and analysis time at different constant pressures
2.4 方法学考察实验结果
2.4.1 线性关系、检出限和定量限考察 将5 种脂肪酸甲酯混合标准溶液按(1.2.4)进样分析,以峰面积为纵坐标(y),标准溶液浓度(μg/mL)为横坐标(x),制作标准曲线并进行线性回归分析,根据标准曲线得到每种脂肪酸成分的含量。如表4 所示,5 种脂肪酸甲酯的线性关系良好,决定系数(R2)在0.9992~0.9999之间。按3 倍信噪比和10 倍信噪比确定5 种脂肪酸甲酯的检出限和定量限,5 种脂肪酸甲酯的检出限在0.4828~1.4280 μg/g 之间;定量限在1.6090~4.7590 μg/g 之间。
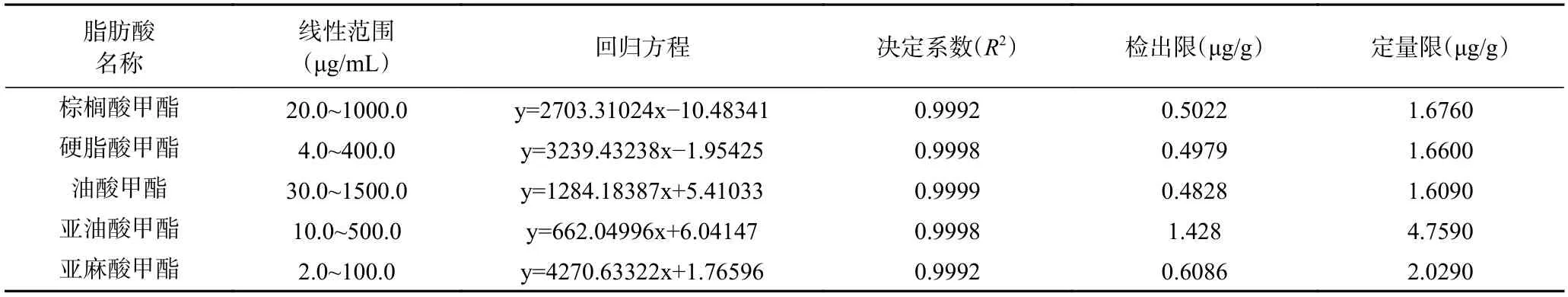
表4 5 种脂肪酸甲酯线性范围、相关系数、检出限和定量限Table 4 Linear range,correlation,detection limit and quantification limit of five fatty acid methyl esters
2.4.2 仪器精密度 任选一个标准样品溶液,按前述1.2.4 的色谱条件连续进样6 次,测定峰面积,考察仪器的精密度。5 种脂肪酸甲酯的平均峰面积RSD 在0.5%~3.2%之间(表5),表明仪器精密度较好。
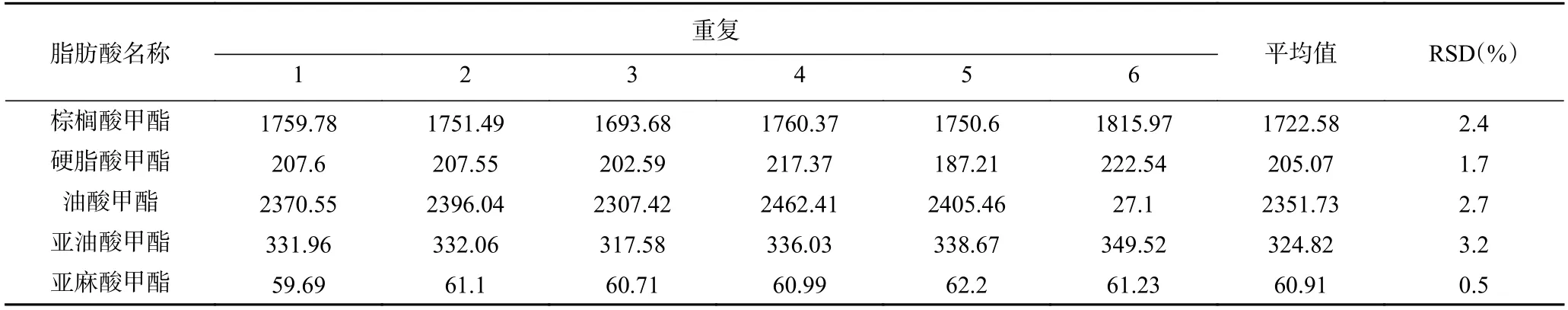
表5 仪器精密度Table 5 Test of instrument precision
2.4.3 样品稳定性 任意选择一个加标样品,在室温下放置,在24 h 内每隔4 h 进样一次,计算脂肪酸浓度及其RSD 值,考察样品的稳定性。结果显示(表6),棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸平均质量浓度分别为0.8917、0.0938、1.1977、0.1687 和0.0135 mg/g,样品中的5 种脂肪酸含量变化RSD在0.7%~1.1%,表明24 h 内样品中棕榈酸甲酯、硬脂酸甲酯、油酸甲酯、亚油酸甲酯、亚麻酸甲酯稳定性较好。
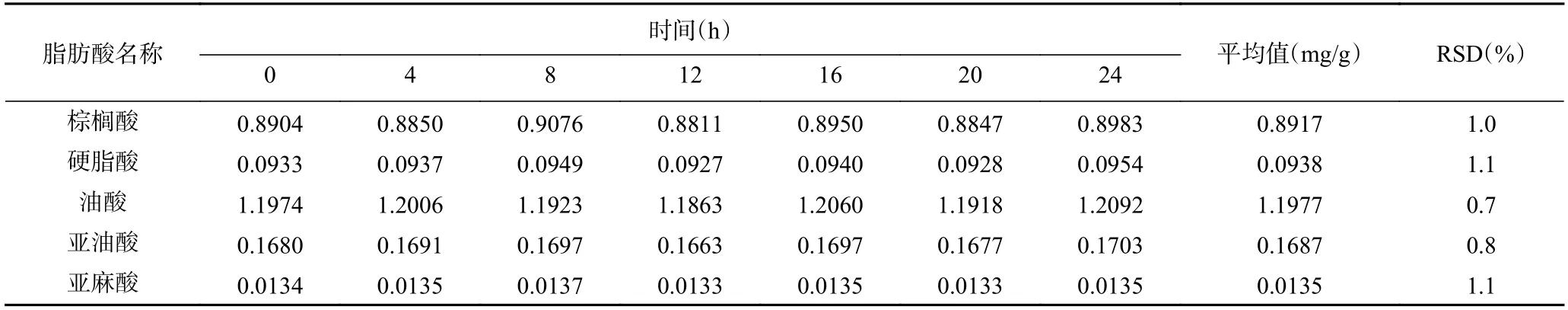
表6 样品稳定性试验Table 6 Test of sample stability
2.4.4 方法回收率试验 准确称取木薯粉3.00 g,用色谱正己烷配制高、中、低3 个浓度水平5 种脂肪酸混合标准样品,加入称取的样品中吸收后,在氮气下挥发干正己烷,按前述1.2.2 提取和甲酯化方法提取处理样品,每个水平重复5 次,进行回收率试验。由标准曲线回归方程计算样品浓度,以回收率=(测得量-加入量)/加入量计算样品回收率,重复性RSD 和平均回收率RSD 评价方法的重复性和准确度。加标试验结果表明(表7),棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸的平均回收率在88.0%~105.4%之间;相同加标样品回收率重复性较好,平均回收率RSD 在3.4%~10.4%之间;证明方法加标回收率和重复性较好,准确度较高,能满足样品测定需要。
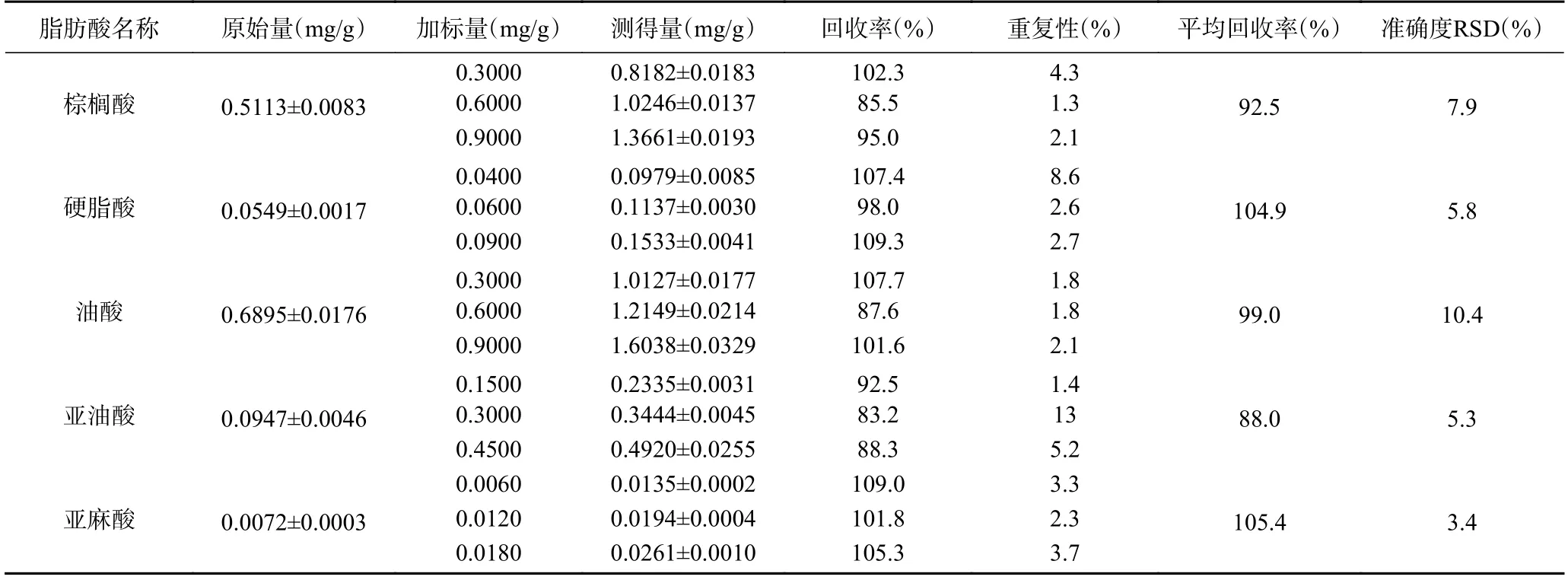
表7 加标回收率试验结果Table 7 Recovery test for the method
2.5 不同品种(系)和不同贮藏时间木薯粉的脂肪酸组成分析
2.5.1 不同品种(系)木薯粉饱和脂肪酸(SFA)与不饱和脂肪酸(UFA)的比例 利用建立的脂肪酸定性定量检测方法,对不同品种(系)木薯粉脂肪酸含量进行测定,考察的品种中检测到棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸5 种脂肪酸(图6)。木薯粉中饱和脂肪酸(SFA)占总脂肪酸37.88%~49.14%,单不饱和脂肪酸(MUFA)占总脂肪酸44.84%~51.89%,多不饱和脂肪酸(PUFA)仅占总脂肪酸5.43%~14.67%(表8)。脂肪酸成分及合理的比例对生长、发育及疾病防治具有重要的作用,尤其是UFA。如PUFA 的亚油酸是人体必需的脂肪酸,可调节体内电解质平衡、改善高血压、降低胆固醇、预防心脑血管病等;MUFA 的油酸具有多种保健作用,如降低血脂、降低心脏病风险、抗氧化、抗炎等[15]。蔡妙颜等[16-17]提出合理膳食的脂肪酸比例(SFA 与MUFA、PUFA)约为1:1:1。考察的5 种木薯粉的脂肪酸比例(SFA/MUFA/PUFA)为1:(0.91~1.35):(0.12~0.39),低于合理膳食的脂肪酸比例。
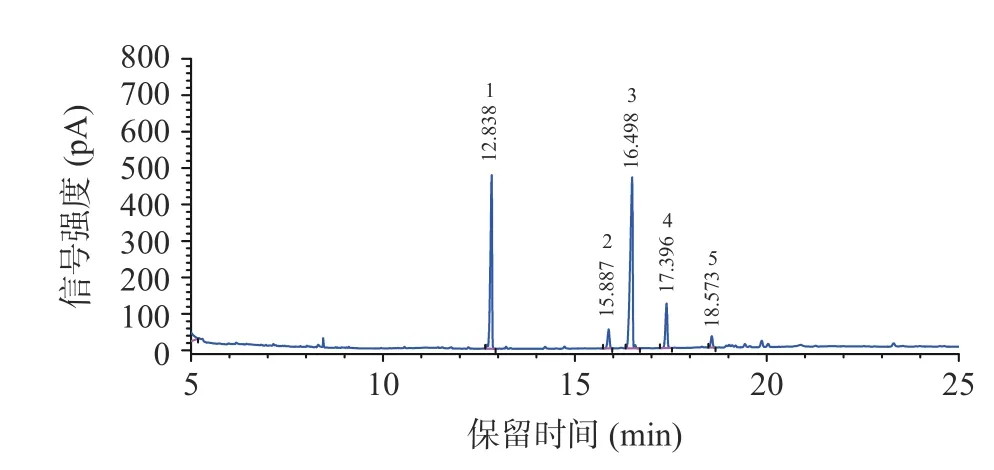
图6 木薯粉样品中脂肪酸甲酯色谱图Fig.6 Chromatogram of fatty acid methyl ester in edible cassava flour
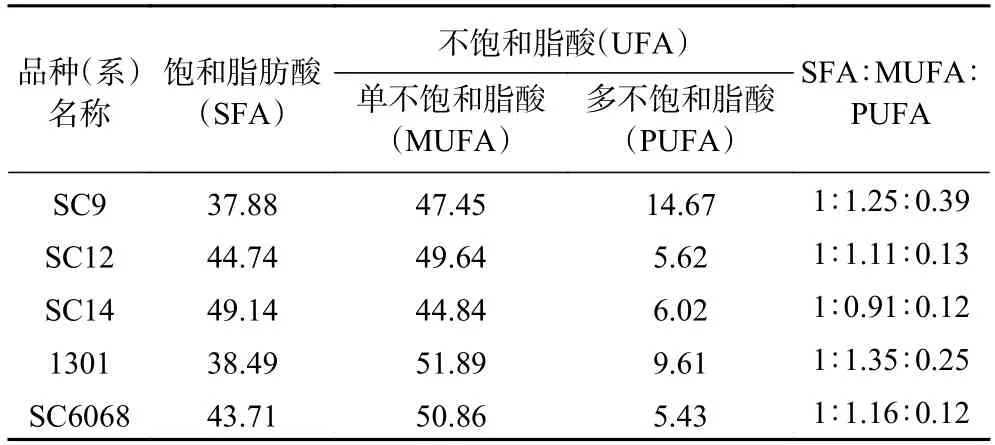
表8 不同品种(系)木薯粉饱和脂肪酸和不饱和脂肪酸的比例Table 8 Proportion of saturated and unsaturated fatty acids in edible cassava flour of different varieties (strains)
不同品种5 种脂肪酸含量差异较大(表9),其中SC9 的棕榈酸、油酸、亚油酸和亚麻酸4 种脂肪酸含量显著高于SC12、SC14、1301 和SC6068(P<0.05),含量分别达到0.7818、1.088、0.2967 和0.0398 mg/g;硬脂酸含量最低,仅为0.0868 mg/g。食用木薯粉中油酸含量相对较高,油酸在降低血清胆固醇方面的效果与亚油酸、亚麻酸等多烯酸相当,能保护肝细胞,降低黄曲霉毒素引发的肝细胞损伤[15,18]。由总脂肪酸及几种对人体具有营养学价值的脂肪酸含量分析可见,综合性价比较高的制粉品种为SC9。木薯粉中淀粉含量高,通过简单的高温高压、酶解、酸解或机械作用,获得15%~30%左右的抗性淀粉[19-21]。研究表明,淀粉-脂质复合体的存在影响了抗性淀粉的形成[22],木薯粉中棕榈酸和硬脂酸低于0.1%,可不经过脱脂处理获得较多抗性淀粉。因此,从脂肪酸对抗性淀粉形成的影响及加工角度考虑,制备抗性淀粉的适宜品种为SC12 和SC14,但品种间抗性淀粉含量的差异对于抗性淀粉获得也是需要考虑的重要因素。木薯粉总脂肪酸含量约为0.2%,属于低脂食品,低脂肪含量会导致木薯粉食品的口感和风味不佳,无法满足消费者的需求,可选择合适的木薯品种和加工方式,以提高木薯粉不饱和脂肪酸含量,比如发酵木薯粉的脂类含量较发酵前显著升高[23]。因此,通过微生物发酵提高木薯粉中多不饱和脂肪酸和营养价值成为可能。
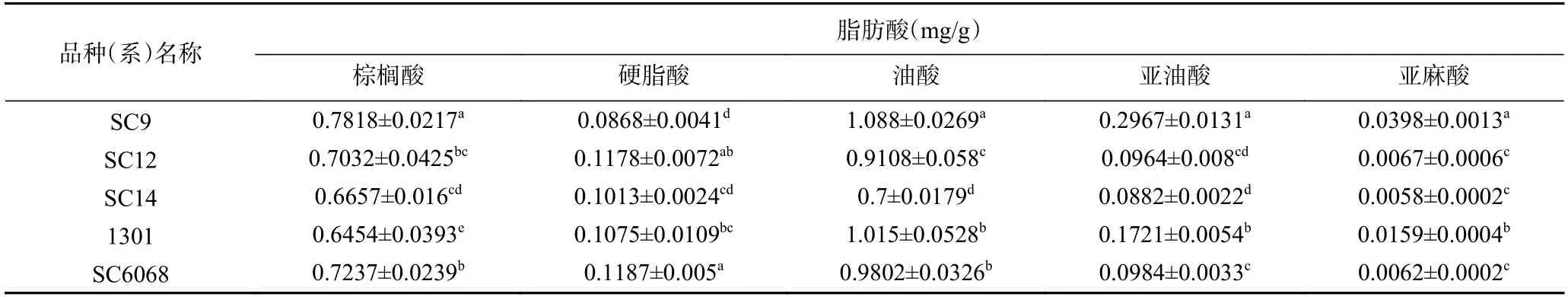
表9 不同品种(系)食用木薯粉脂肪酸含量Table 9 Fatty acid content of in edible cassava flour from different varieties (strains)
2.5.2 不同贮藏时间木薯粉脂肪酸变化 木薯粉(SC9)贮藏0~26 周内,5 种脂肪酸均有下降趋势,并在贮藏12 周最低,后趋于平缓(图7)。从贮藏开始到贮藏26 周,棕榈酸由0.8246 mg/g 下降至0.7373 mg/g(图7a),硬脂酸由0.0911 mg/g 下降至0.0758 mg/g(图7b),油酸由1.1315 mg/g 下降至0.9261 mg/g(图7c),亚油酸由0.3115 mg/g 下降至0.0766 mg/g(图7d),亚麻酸由0.0418 mg/g 下降至检测不到(图7e),含量分别下降了10.6%、16.8%、18.2%、75.4%和100.0%。结果显示,不饱和脂肪酸亚油酸和亚麻酸下降趋势最为明显(图7d、7e),这与多不饱和脂肪酸不稳定、易发生水解酸败和氧化酸败形成挥发性物质有关。双变量Pearson 检验结果显示(图8),木薯粉贮藏天数与棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸等脂肪酸呈负相关,相关系数(r)分别为-0.274、-0.254、-0.822、-0.968 和-0.944,其中油酸、亚油酸和亚麻酸达到极显著(P<0.01)。证明在木薯粉贮藏过程中,饱和脂肪酸和不饱和脂肪酸含量是逐渐降低的(图7f),其不饱和脂肪酸含量降低较快。不饱和脂肪酸的氧化降解可能会产生一系列的异味物质,例如己醛、庚醛、奎醛等。这些异味物质通常表现为“哈喇味”、“腐臭”、“鱼腥味”等,会影响食品的口感和食用品质[24-25]。然而,贮藏过程中木薯粉中亚油酸和亚麻酸含量显著降低,但氧化产物的异味并不明确;同时,影响木薯粉酸败的主要因素除脂肪酸组成外,木薯粉的水分、贮藏温度、氧气含量、光照、病虫害以及添加剂等也是需要考虑的因素[26-29]。研究表明,高水分会加快脂肪酸的水解酸败[28];另外,高温贮藏会加快食品的氧化酸败进程,而短期的高温可以降低脂肪酶活性,降低水解酸败[30-31]。前期研究显示,木薯粉在常温贮藏过程中存在吸潮现象,粗蛋白、粗纤维和脂肪酸等达到极显著降低[8]。木薯粉不饱和脂肪酸降解产生挥发性物质组成并不明确,其酸败过程中脂质化合物(脂肪酸过氧化氢物)是否会与其他一种或者多种化合物(如氨基酸或蛋白质)偶联而降低木薯粉的食用和营养价值并无研究报道[32],因此,控制木薯粉加工过程中的含水量和贮藏环境,是保证其贮藏品质的重要因素;进一步研究探索木薯粉贮藏风味物质变化,选择合适的加工或贮藏方式,获得影响的关键因素是保障木薯粉品质的重要措施。
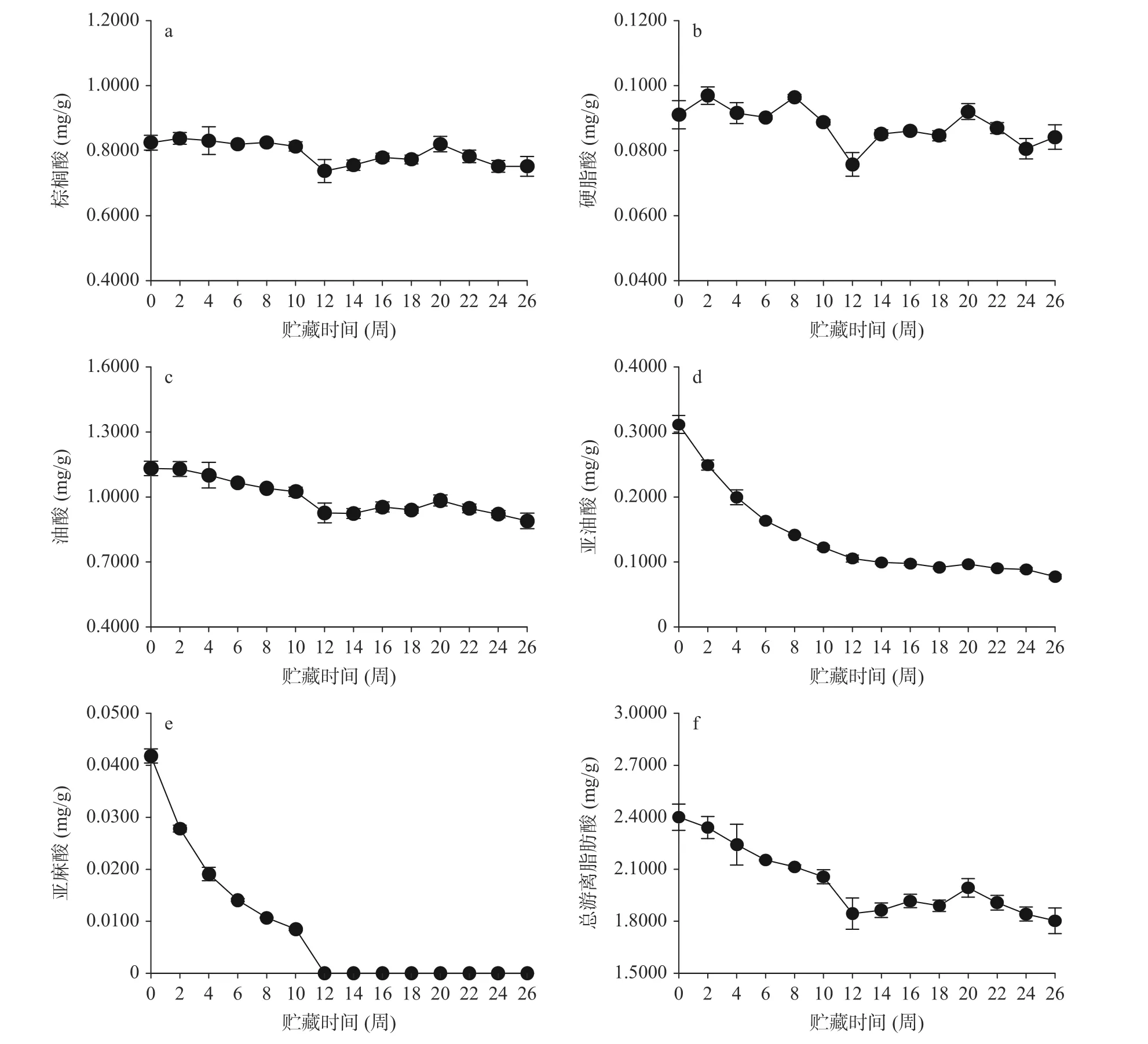
图7 常温贮藏过程中食用木薯粉脂肪酸含量变化Fig.7 Changes of fatty acid contents of in edible cassava flour during storage at room temperature
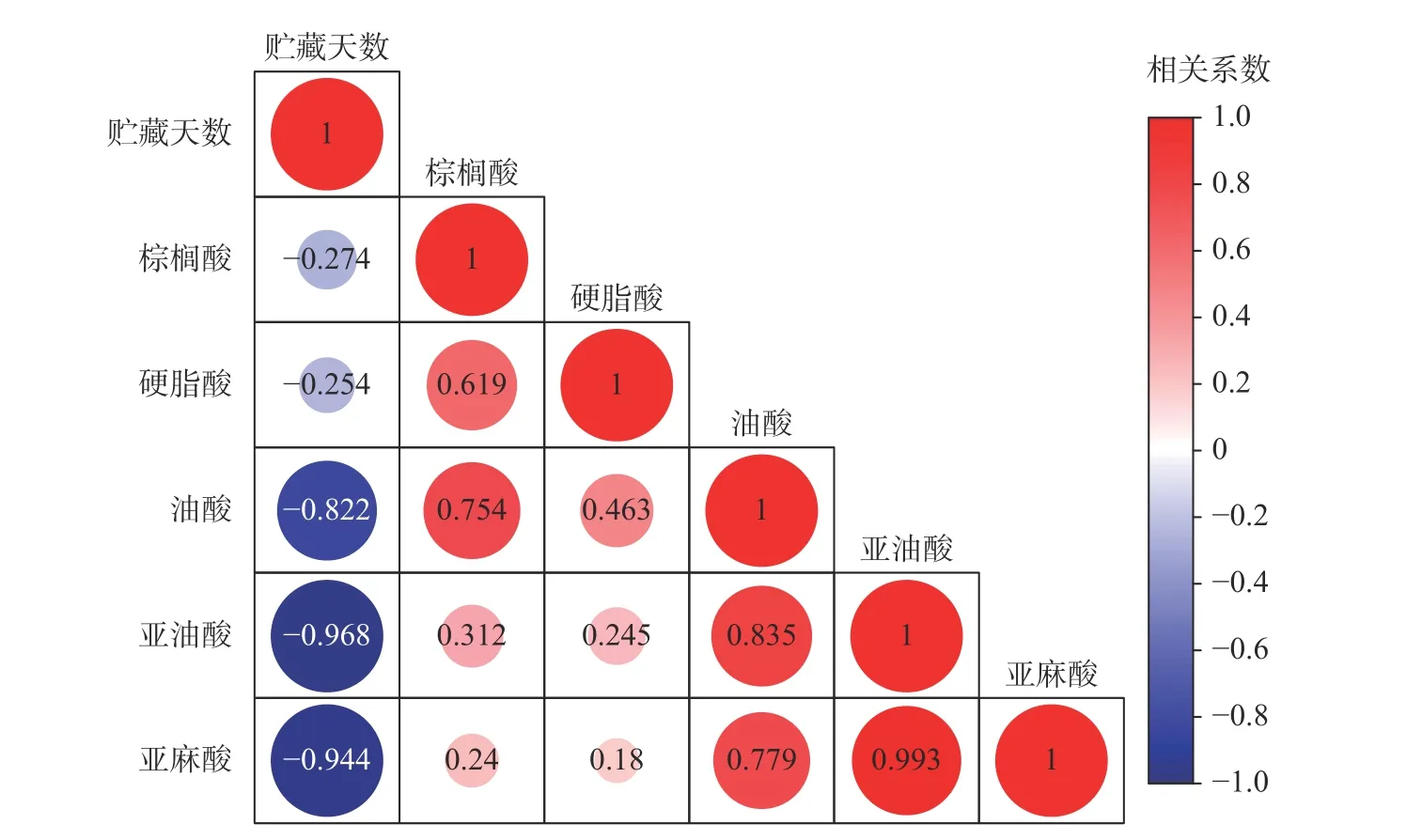
图8 贮藏时间与5 种脂肪酸的相关性热图Fig.8 Heat map of correlation between storage time and five fatty acids
3 结论
脂肪酸甲酯化方法比较显示,酸催化法更适合游离脂肪酸含量较高的木薯粉脂肪酸甲酯化;GC 和GC-MS 联用可准确对食用木薯粉中多种脂肪酸进行定性定量检测分析;GC 方法优化后,可在30 min内完成37 种脂肪酸的测定,并发现其分离度与设定的恒定压力相关,恒定压力25 psi,可有效分离37 种脂肪酸,该方法节省载气,大批量处理样品时更加经济;气相(GC-FID)及气质联用技术(GC-MS)可用于不同品种食用木薯粉脂肪酸的定性定量分析,木薯粉中主要有棕榈酸、硬脂酸、油酸、亚油酸和亚麻酸5 种脂肪酸;方法验证结果表明,建立的脂肪酸分析方法重复性好,准确度高,适用于不同品种食用木薯粉脂肪酸的定性定量分析。考察了5 个食用品种(系)木薯粉脂肪酸组成和含量差异,发现品种间脂肪酸含量差异较大,脂肪酸种类相对简单,以饱和脂肪酸棕榈酸和单不饱和脂肪油酸为主,含有少量的多不饱和脂肪酸亚油酸和亚麻酸;脂肪酸比例(SFA/MUFA/PUFA)为1:(0.91~1.35):(0.12~0.39),其低于合理膳食的脂肪酸比例。SC9 食用木薯粉常温贮藏26 周(182 d),饱和脂肪酸和不饱和脂肪酸都显著降低,其中亚油酸、亚麻酸降低最为明显,证明木薯粉在贮藏过程中存在脂肪酸酸败降解,其具体的酸败机理有待于进一步研究探索。虽然木薯粉不饱和脂肪含量较少,但不饱和脂肪酸是人体必需的脂肪酸,改变贮藏环境或包装方式,最大限度的保留木薯粉中不饱和脂肪酸是值得关注和研究的问题。

