响应面法优化龙须菜多糖快速溶剂萃取提取工艺及其抗炎活性研究
王慧颖,刘燕飞,张敬远,杜 彬,杨越冬
(河北省天然产物活性成分与功能重点实验室,河北秦皇岛 066004)
龙须菜(Gracilaria lemaneiformis)又名江蓠、海发菜,属江蓠科红藻界天然海洋植物,其藻体直立,线形分支。其广泛分布在中国沿海地区,利于维持海洋生态环境,作为琼脂的主要来源,具有很高经济价值[1]。龙须菜富含多糖、膳食纤维、蛋白质、氨基酸、矿物质、多酚等可供人体吸收和利用的营养物质,其中多糖含量超过干重的30%[2]。研究表明,龙须菜多糖具有免疫调节[3]、降血糖[4]、抗氧化[5]、抗肿瘤[6]等优异活性,在功能食品、化妆品、医用材料和生物肥料领域实现高值化应用。
目前,多糖提取[7]的传统方法有微波辅助提取法[8]、溶剂提取法[9]和酶提取法[10]等。此外,快速溶剂萃取技术[11]是一种新兴的高压自动萃取技术,通过改变温度和压力影响多糖的提取率。该方法具有工序简单、自动化提取、效率高、成本低等优点,在食品[12]、化工[13]和环境[14]领域有广泛的应用。王国明等[15]研究发现快速溶剂萃取法提取人参粗多糖得率高于传统水提法;金建华等[16]探究了快速溶剂萃取法提取唐古特白刺果实多糖的最佳工艺为温度102 ℃、时间10 min、压力10 MPa、循环提取2 次;王宇晴等[17]探究了快速溶剂萃取法提取灵芝多糖的最佳工艺参数为提取温度110 ℃,提取压力90 Pa,提取时间20 min,循环2 次。然而,快速溶剂萃取技术提取龙须菜多糖尚未报道。
本文将探究快速溶剂萃取法提取龙须菜多糖的提取工艺参数(提取温度、提取时间、循环次数),以获得龙须菜多糖的最高得率。系统分析提取工艺参数对龙须菜多糖得率的影响及其相互作用,并对其结构和抗炎活性进行实验,有望为龙须菜多糖提取方法和生物活性提供一定参考价值。
1 材料与方法
1.1 材料与仪器
龙须菜 2021 年采自河北省秦皇岛海域,经除杂、清洗和晾晒后,得到的龙须菜在50 ℃恒温干燥箱中干燥至恒重,粉碎过40 目筛,得到龙须菜粉末并置于-20 ℃冰箱内储存备用;3500 Da 透析袋 上海源叶有限公司;RAW264.7(小鼠单核巨噬细胞白血病细胞)武汉普诺赛生命科技有限公司;DMEM高糖培养基 上海富衡生物科技有限公司;胎牛血清上海源培生物科技股份有限公司;CCK-8 试剂盒上海七纯生物科技有限公司;一氧化氮(nitric oxide,NO)检测试剂盒 上海碧云天生物技术有限公司;LPS(0111:B4)美国Sigma 公司;硫酸铵、叔丁醇、无水乙醇等 分析纯,天津欧博凯化工有限公司。
APLE-3000 全自动加压溶剂萃取仪(配有100 mL萃取池)北京吉天仪器有限公司;ALpha2-4L D plus 冷冻干燥机 德国CHRIST 公司;TENSOR27傅立叶变换红外光谱仪 德国Bruker 公司;HPLC 1100 高效液相色谱仪 美国Agilent 公司;1300Ⅱ级A2 型生物安全柜、3111 型CO2细胞培养箱、MultifugeX1R 型高速冷冻离心机 美国Thermo Fisher Scientific 公司;XSZ-D2 普通倒置显微镜 德国ZEISS 公司;SPECTRA MAX 190 型酶标仪 美谷分子仪器(上海)有限公司。
1.2 实验方法
1.2.1 龙须菜多糖提取 参照何俊平等[18]的实验方法,并做修改。精确称取龙须菜粉末(5.0000±0.0003)g 并与硅藻土(1:1,w/w)混合均匀,装入100 mL 不锈钢萃取池中,用硅藻土填满萃取池剩余空间后放到加压溶剂萃取仪中,以水为溶剂,固定加载溶剂25 mL;固定10 MPa 压力,在一定温度下静态萃取一定时间,循环一定次数,后将萃取液离心(5000 r/min,10 min),记录体积,加四倍体积无水乙醇4 ℃条件下醇沉过夜、离心取沉淀,将沉淀复溶;然后加入20%(w/v)硫酸铵和1.5 倍(v/v)叔丁醇,35 ℃反应30 min,过3500 Da 透析膜,透析48 h,浓缩至四分之一,冷冻干燥得龙须菜粗多糖GLP-K。提取工艺流程见图1。
1.2.2 单因素实验
1.2.2.1 提取温度对多糖得率的影响 以水为溶剂,固定投料量为5 g,提取压力为10 Mpa,提取时间2 min,循环次数1 次,探究提取温度(40、50、60、70、80 ℃)对龙须菜多糖得率的影响。每个实验平行重复三次。
1.2.2.2 提取时间对多糖得率的影响 以水为溶剂,固定投料量为5 g,提取压力为10 Mpa,提取温度60 ℃,循环次数1 次,探究提取时间(2、4、6、8、10 min)对龙须菜多糖得率的影响。每个实验平行重复三次。
1.2.2.3 循环次数对多糖得率的影响 以水为溶剂,固定投料量为5 g,提取压力为10 Mpa,提取温度60 ℃,提取时间2 min,探究循环次数(1、2、3、4、5 次)对龙须菜多糖得率的影响。每个实验平行重复三次。
1.2.3 响应面试验优化龙须菜多糖提取工艺 基于Box-Benhnken 试验设计原理,综合单因素实验结果,固定提取投料量为5 g,提取压力为10 MPa,以多糖得率为响应值,选择提取温度(A)、提取时间(B)和循环次数(C)为自变量,设计三因素三水平响应面优化试验,响应面试验设计表见下表1。
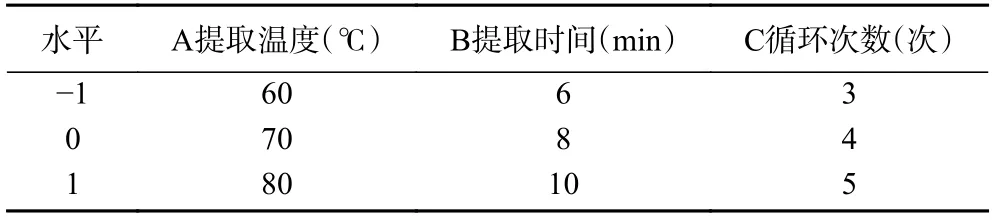
表1 响应面试验设计因素与水平Table 1 The design factors and levels of response surface test
1.2.4 龙须菜多糖得率的测定 参考任鑫等[19]的方法,按公式(1)计算龙须菜多糖得率:
式中:Y 为龙须菜多糖得率,%;M1为龙须菜粗多糖质量,g;M2为龙须菜粉的质量,g。
选用苯酚硫酸法测定多糖含量。标准曲线:先配制0.1 mg/mL 葡萄糖标准液母液,再配成一系列浓度(0、4、8、12、16、20、24、28、32、36、40 μg/mL)的标准溶液,各取1 mL 于试管中,加1 mL 6%苯酚和5 mL 浓硫酸,静置20 min,在490 nm 处测定吸光度值,作图得标准曲线。配制1 mg/mL 的GLP-K溶液,按上述步骤加苯酚和浓硫酸,静置20 min,在490 nm 处测吸光度值。
1.2.5 傅里叶变换红外光谱(FTIR)分析 将干燥多糖样品与干燥KBr 于研钵中顺时针充分研磨至混匀,置于专用模具内手动压成透明薄片后测试。扣除KBr 的空白背景,扫描范围:500~4000 cm-1,扫描间隔2 cm-1。
1.2.6 分子量分布 采用高效液相色谱法[20](HPLC)对龙须菜多糖进行测定。将样品溶解在蒸馏水中,过0.22 μm 的微孔滤膜后上机检测。色谱条件:Agilent PL aquagel-OH MIXED-H 凝胶色谱柱(300×7.5 mm,8 μm),流动相为蒸馏水,流速为0.8 mL/min,柱温为35 ℃;配制2 mg/mL 葡聚糖标准品及样品,测样体积为20 μL。实验平行重复三次。
1.2.7 体外RAW264.7 细胞实验
1.2.7.1 细胞培养 将RAW 264.7 细胞株采用生长培养液(含89% DMEM 培养基、10%胎牛血清和1%的青霉素、链霉素双抗混悬液)于37 ℃含5%CO2的培养箱中常规培养。将培养皿放在普通倒置显微镜下,放大不同倍数观察细胞密度和生长情况。
1.2.7.2 对RAW 264.7 细胞活力的影响 取生长状态良好的RAW 264.7 制备细胞悬液,将细胞按1×104/孔接种到96 孔板中,每孔100 μL 培养基,贴壁培养24 h 后弃培养基,空白组(无细胞)和对照组分别加入100 μL 培养基,实验组加入100 μL 含有不同浓度(7.8125、15.625、31.25、62.5、125、250、500、1000 μg/mL)龙须菜多糖的培养基干预24 h后,弃培养基,再将100 μL 含有10% CCK-8 试剂的细胞培养基加入空白组、对照组和实验组中,37 ℃避光孵育1 h。用酶标仪在450 nm 处测量每个孔的吸光度(A450),计算细胞存活率。每组设三个复孔。存活率计算见公式(2)。
式中:As为实验组吸光度;Ac为对照组吸光度;Ab为空白组吸光度。
1.2.7.3 细胞中NO 含量检测 取生长状态良好的RAW 264.7 制备细胞悬液,将细胞按2×105/孔接种到48 孔板中,每孔200 mL 培养基,贴壁培养24 h后弃培养基,实验组加入200 μL 含有不同浓度(50、100、200、300、400、500 μg/mL)龙须菜多糖的培养基,LPS 组和对照组加200 μL 新鲜培养基,预处理2 h 后,LPS 组和实验组加入22.2 μL 含10 μg/mL LPS 的培养基,对照组加入22.2 μL 新鲜培养基,刺激22 h 后,根据NO 试剂盒说明书步骤检测培养基上清中NO 含量。
1.3 数据处理
通过Excel 软件处理三次平行实验的实验结果作平均值和标准差分析,响应面试验数据采用Design-Expert8.0.6.1 软件进行分析。采用Origin 9软件进行结构作图,GraphPad prism8.0.1 软件进行活性作图分析。P<0.05 表示差异显著,P<0.01 表示差异极显著,P<0.001 表示差异高度显著。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取温度对多糖得率的影响 如图2 所示,随着反应温度的升高,多糖的得率随之提高,当温度达到70 ℃时,多糖得率达到最大,继续升高温度时,得率略有下降,可能是温度的上升有利于溶剂与细胞壁的相互作用,使胞内物质溶出,但在10 MPa 的压力加持下,高温导致多糖发生了热降解。因此后继试验中提取温度取值范围为60~80 ℃。
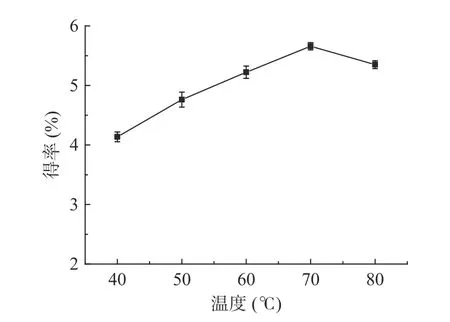
图2 提取温度对龙须菜多糖得率的影响Fig.2 Effect of extracting temperature on the yield of GLP-K
2.1.2 提取时间对多糖得率的影响 如图3 所示,在2~8 min 内,龙须菜多糖的得率随反应时间增加而提高,提取时间为8 min 时得率达到最大值,为5.59%;继续延长时间后,得率下降,分析可能是在较短时间范围内,随着提取时间的延长,细胞组织遭到持续性破坏,多糖溶出,得率增加;多糖在长时间[21-22]的高压作用下发生水解或氧化。因此后继试验中提取时间取值范围为6~10 min。
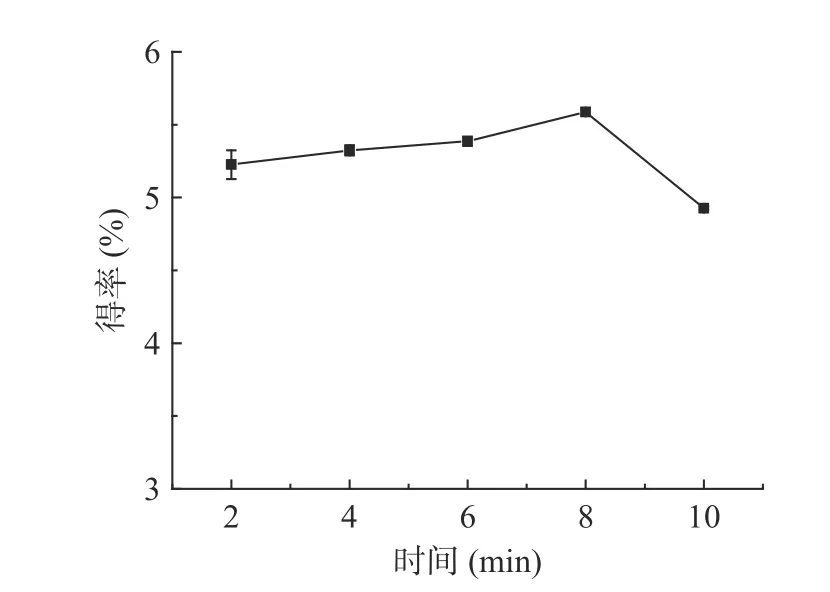
图3 提取时间对龙须菜多糖得率的影响Fig.3 Effect of extracting time on the yield of GLP-K
2.1.3 循环次数对多糖得率的影响 如图4 所示,多糖得率随着循环次数的增加而提高,当循环次数为4 时得率最高,继续增加循环次数,得率没有增加,分析是多糖在水中溶解度是一定的,达到平衡后不再溶出,更换新溶剂后多糖会继续溶出至再次达到平衡,但随着提取次数的增加,其他水溶性杂质会占据多糖的位置,因此后继试验中循环次数取值范围为3~5次。循环次数对多糖得率的影响结果与Du 等[21]在青稞中β-葡聚糖的快速溶剂萃取试验结果一致。
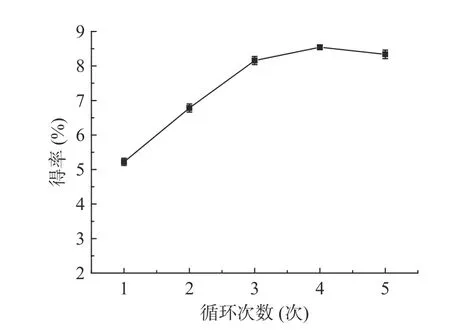
图4 循环次数对龙须菜多糖得率的影响Fig.4 Effect of cycle times on the yield of GLP-K
2.2 响应面试验优化分析
2.2.1 响应面多元回归方程的建立 以龙须菜多糖的得率为响应值,采用三因素三水平的响应面试验设计得到最佳提取工艺参数,实验结果见表2,方差分析结果见表3,龙须菜多糖得率在7.38%~9.75%之间,对表2 中的响应面试验数据结果进行多元回归方程拟合,并获得以龙须菜多糖为响应值的多元回归方程:
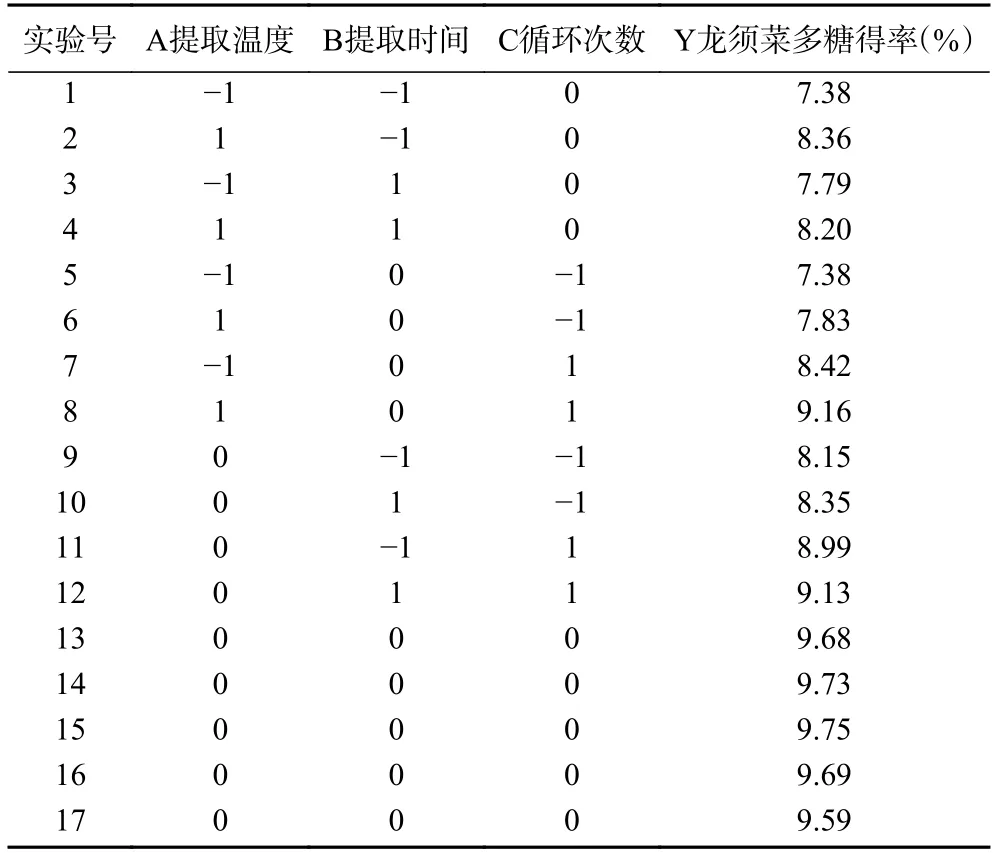
表2 龙须菜多糖提取工艺条件响应面优化方案及结果Table 2 Response surface optimization scheme and results of extraction process conditions of GLP-K
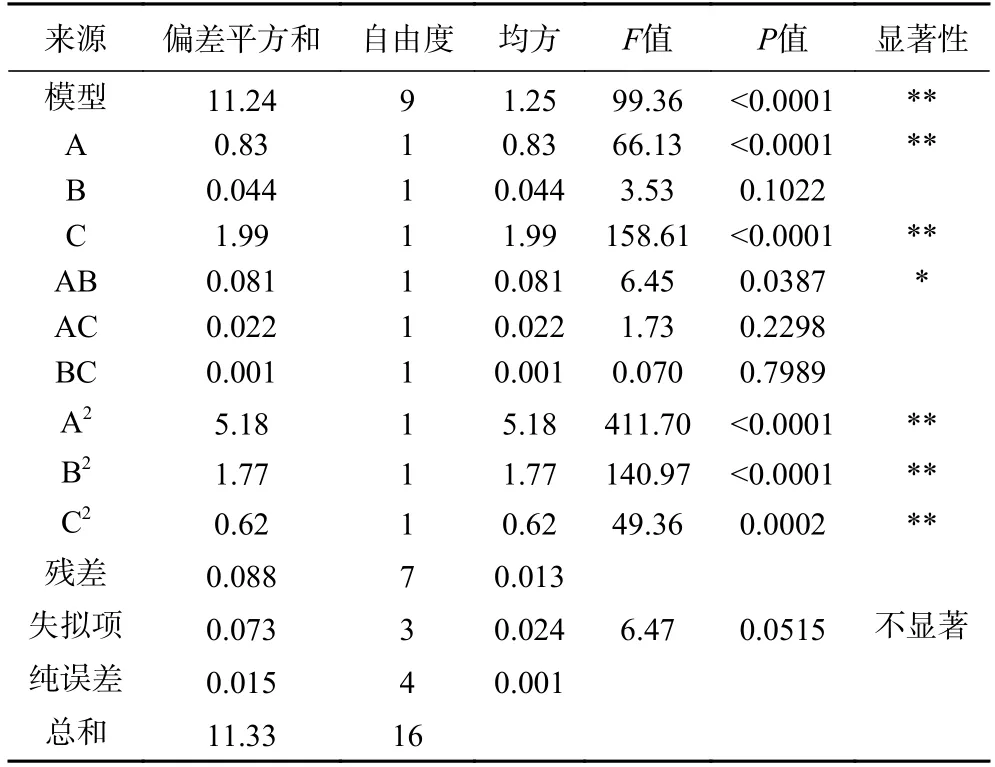
表3 响应面回归方程模型方差分析Table 3 Analysis of variance of response surface regression equation model
Y=9.69+0.32A+0.075B+0.50C-0.14AB+0.074AC-0.015BC-1.11A2-0.65B2-0.38C2
结合表3 可知,F值越高,P值越低,显著性则越高[23]。回归模型P<0.01,失拟项P=0.0515,A 和C 对响应值影响极显著(P<0.01),B 对响应值影响不显著(P>0.05);交互项AB 对响应值影响显著(P<0.05),AC、BC 对响应值影响不显著(P>0.05);二次项对响应值影响均极显著(P<0.01);表明优化实验结果具有较高的相关性和真实性,三个因素显著性影响大小分别为循环次数>提取温度>提取时间。
2.2.2 响应面及等高线图分析 图5 展示了三因素(提取温度、提取时间和循环次数)两两交互的响应曲面和等高线图。如图所示,相对比较而言,多糖得率在提取温度较低(60~70 ℃)时随提取时间的增大呈递增趋势,在提取温度较高时(70~80 ℃),呈递减趋势。提取温度和提取时间的响应面图的曲面较陡,表明其交互作用显著(P<0.05);多糖得率在提取温度较低(60~70 ℃)时随循环次数的增大呈递增趋势,在提取温度较高时(70~80 ℃),呈缓慢递减趋势(P>0.05);多糖得率在提取时间较低(6~8 min)时随循环次数的增大呈递增趋势,在提取时间较高时(8~10 min),呈缓慢递减趋势(P>0.05)。综合分析可得,温度和时间交互作用最强烈,温度和循环次数交互作用次之,时间和循环次数交互作用最弱,和表3 方差分析结果相符。
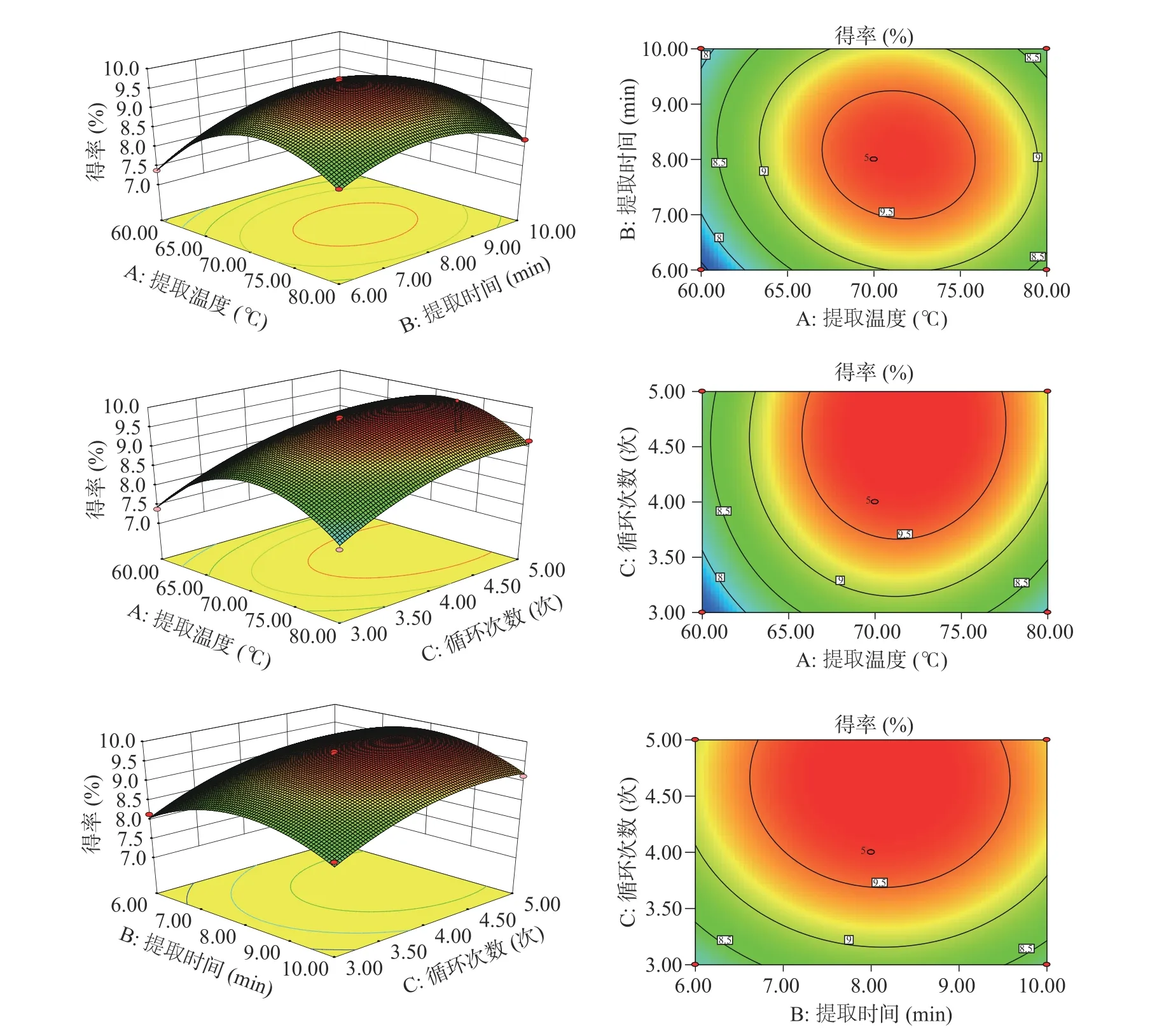
图5 AB、AC、BC 对龙须菜多糖得率影响的响应面图和等高线图Fig.5 Response surface plots and contour plots of the effects of AB,AC and BC on the yield of GLP-K
2.2.3 响应面优化试验结果验证 通过响应面软件对最佳提取工艺条件进行预测,得到龙须菜多糖快速溶剂萃取的最佳工艺条件为:蒸馏水为溶剂,萃取压力10 MPa,提取温度70.41 ℃,提取时间8.53 min,循环次数4.24 次,预测得率为9.82%。基于实际情况,将最优条件调整为温度70 ℃,时间8.5 min,循环次数4 次,在此条件下进行三次平行水平验证实验,龙须菜多糖得率为9.58%±0.31%,与多元回归方程得到的预测值相近,表明该模型的优化参数基本可靠,具有可行性。
2.3 多糖纯度测定
通过苯酚-硫酸法对葡萄糖标准溶液作图,得葡萄糖标准曲线方程:Y=0.006X+0.002,R2=0.998,代入方程计算GLP-K 中总糖含量为75.28%。
2.4 红外光谱分析
如图6 所示,在3386 cm-1处的宽而强的吸收峰是-OH 伸缩振动特征吸收峰;在2916 cm-1处有一个-CH 伸缩振动引起的弱而小的吸收峰,表明该样品类属于多糖类化合物[24];在1643 cm-1和1444 cm-1处的吸收峰分别对应C=O 和C-O 的拉伸振动,表明此多糖存在糖醛酸[25];1239 cm-1处的峰代表S=O 的拉伸振动,表明含有硫酸基;1152 cm-1和1071 cm-1的吸收表示半乳糖和葡萄糖的存在[26]。综上表明GLP-K 是一种含有硫酸基和糖醛酸的粗多糖。
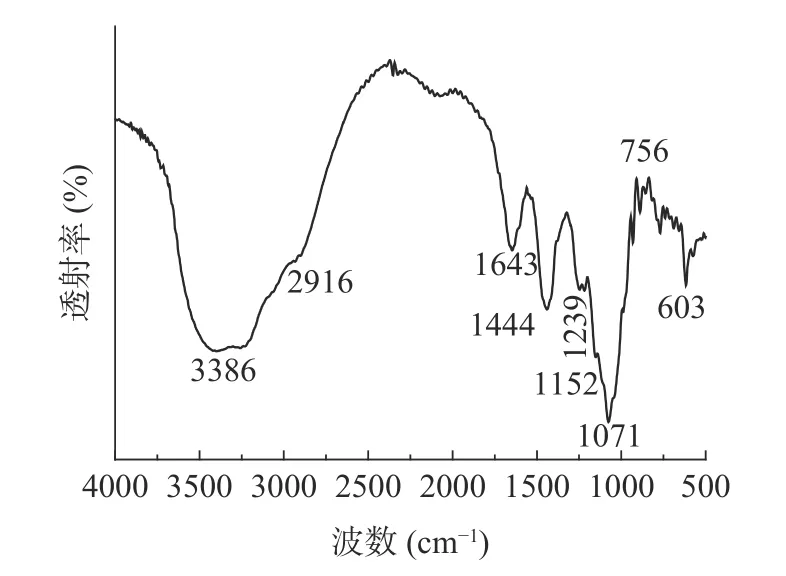
图6 龙须菜多糖红外光谱图Fig.6 FT-IR of GLP-K
2.5 分子量分析
在最佳工艺参数下得到龙须菜多糖。图7 给出了龙须菜多糖的HPLC 洗脱曲线以及葡聚糖标准品[27](重均分子量Mw分别为180、667、47100、344000、708000 Da)的标准矫正曲线。得到标准曲线的线性方程lgMw=-0.9822t+14.9794,其中R2=0.994,呈良好的线性关系[28]。由表4 可知,此方法得到的多糖分子量范围较宽,在4.4~747.1 kDa,响应信号最大值对应的Mw为29787 Da。
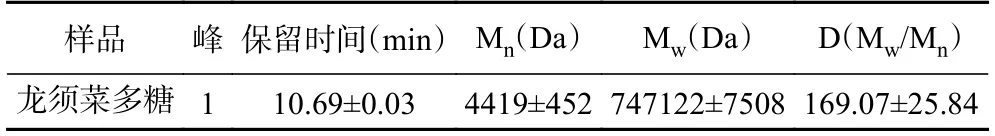
表4 保留峰时间和分子量Table 4 Retention peak time and molecular weight
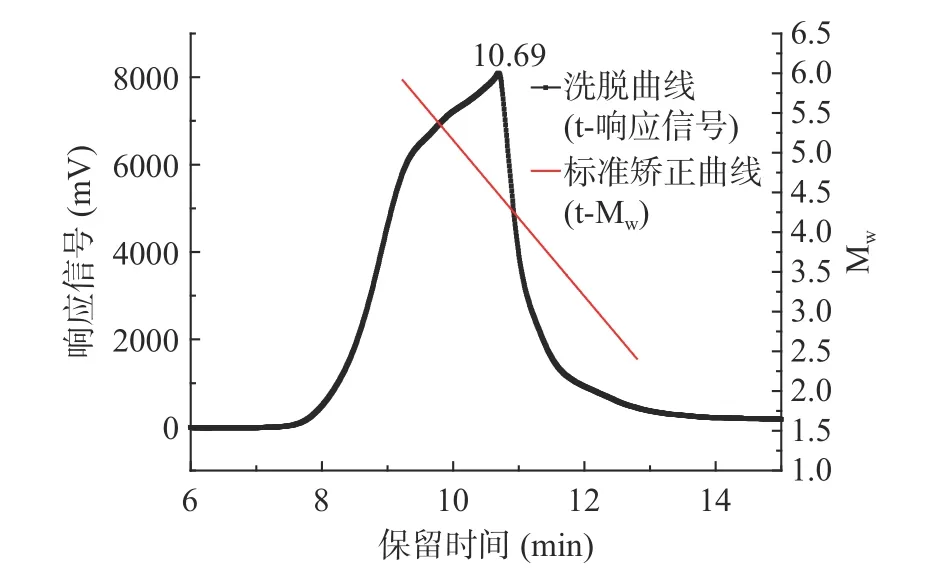
图7 HPLC 的标准矫正曲线和龙须菜多糖的HPLC洗脱曲线Fig.7 Standard calibrationcurve of HPLC and the HPLC elution profile of GLP-K
2.6 体外抗炎活性研究
2.6.1 GLP-K 对RAW 264.7 细胞活性的影响 如图8 所示,本实验探究在7.8125~1000 μg/mL 浓度的GLP-K 的细胞存活率[29-31]。结果显示,与对照组相比,7.8125~1000 μg/mL 浓度范围内的GLP-K 组对巨噬细胞的活力分别增加了10.3%~46.7%,表明快速溶剂法萃取龙须菜多糖对细胞没有毒性作用。
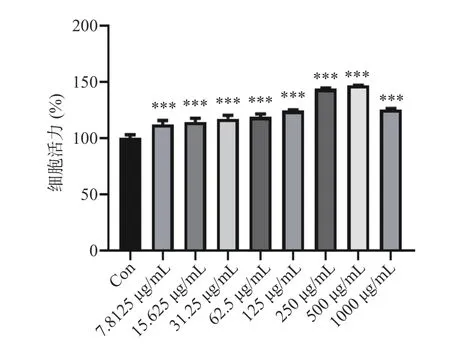
图8 GLP-K 对细胞活力的影响Fig.8 Effects of GLP-K on cells viability
2.6.2 GLP-K 对 LPS 诱导的 RAW264.7 释放 NO 的影响 NO 作为一种有毒气体存在于空气中,但它在生物生理方面充当重要的信号分子作用,参与生物体免疫调节或抗炎活动。在炎症细胞模型中,可以通过NO 释放量减少来判断炎症反应是否得到改善[32-34]。由图9 可知,与对照组相比,LPS 组NO 产生量有提升了4 倍(P<0.001),证明炎症模型诱导成功;与模型组相比,不同浓度的实验组NO 释放量降低,出现显著性差异(P<0.001),随着GLP-K 实验组浓度的升高,NO 抑制率呈正相关。在50 μg/mL 时NO 抑制率为43.76%,500 μg/mL 时NO 抑制率为69.47%。结果表明,GLP-K 可以改善炎症反应。朱彦彬等[31]采用体外细胞实验,研究了桦褐孔菌醇抑制LPS 诱导RAW264.7 细胞炎症反应,结果表明,该提取物能有效抑制LPS 诱导RAW264.7 细胞中促炎因子和过氧化物的产生,提高细胞抗炎和抗氧化能力,从而保护细胞免受损伤。
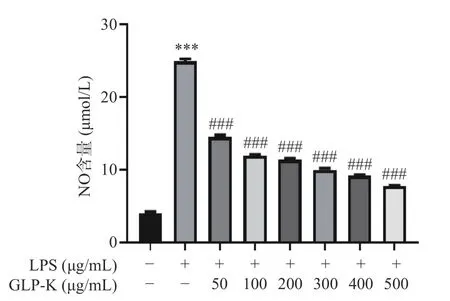
图9 不同浓度GLP-K 对 RAW264.7 细胞NO 分泌水平的影响Fig.9 Effect of different concentrations of GLP-K on the NO secretion of RAW264.7 cells
3 结论
本研究使用快速溶剂萃取法提取龙须菜多糖,首先利用单因素实验获得提取温度、提取时间和循环次数对龙须菜多糖得率影响的最佳条件,再利用响应面法对快速溶剂法龙须菜多糖提取工艺进行优化,得到最佳提取工艺参数:温度70 ℃,时间8.5 min,循环次数4 次,龙须菜多糖得率为9.58%±0.31%,与多元回归方程得到的预测值相近,表明该模型的优化参数基本可靠,具有可行性。红外光谱证实该多糖含有糖醛酸,重均分子量在4.4~747.1 kDa 之间;GLP-K在浓度1000 μg/mL 及以下时对RAW264.7 细胞增殖也无影响(P<0.001);与模型组相比,GLP-K 给药组(50、100、200、300、400、500 μg/mL)NO 的释放量显著降低43.76%~69.47%(P<0.001)。本文首次快速溶剂萃取法应用于龙须菜多糖的提取,并初步证实其抗炎活性,其抗炎机理还需进一步研究。

