参芪糖肾安胶囊含药血清对脂多糖损伤的肾小管上皮细胞活性、超微结构及NLR蛋白3炎性小体的作用机制
张瑞方, 高 峰, 杨 薇, 李 娟, 张轶欧, 姚吉太, 程 刚
(山西省中医院 肾病三科, 山西 太原, 030012)
脓毒症是ICU常见的全身炎症反应综合征,对体内的多种器官可造成影响,最终可发展为多器官功能衰竭及脓毒性休克[1]。急性肾损伤(AKI)是脓毒症患者最常见的并发症,是导致脓毒症患者死亡的主要因素[2]。研究[3]显示,脓毒症患者中AKI发生率为68.2%, 合并AKI患者的90 d死亡率高达35.5%, 严重影响患者的生命健康。脓毒症性AKI的发病机制复杂。研究[4]发现, AKI是对免疫激活物产生的免疫应答。核苷酸结合寡聚化结构域样受体(NLR)及NLR形成的炎性小体,可作为固有的满意系统感受器识别多种危险信号,通过促进细胞活化和细胞因子释放而激活炎症因子,进而造成肾损伤[5]。
研究[6]发现,在肾脏炎症反应中, NLR蛋白3(NLRP3)是重要的指标之一,其可活化下游半胱氨酸天冬氨酸蛋白酶1(caspase-1)信号,进而通过激活白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)及肿瘤坏死因子-α(TNF-α)等炎症因子造成组织损伤。参芪糖肾安具有益气养阴、健脾补肾、化瘀泻浊等作用,研究[7]证实其对早期的糖尿病肾病具有缓解症状、降低血糖、减少尿蛋白、改善微循环的作用。脂多糖(LPS)在临床上又称为内毒素,是革兰氏阴性菌生长或死亡时裂解释放出的主要成分,其可通过诱导氧化应激、炎症反应等加重AKI的发生[8]。本研究采用LPS诱导AKI体外模型,探讨参芪糖肾安含药血清对LPS损伤的肾小管上皮细胞活性、超微结构及NLRP3炎性小体的影响,现将结果报告如下。
1 材料与方法
1.1 材料与试剂
人肾小管上皮细胞(HK-2)(美国ATCC细胞库); 参芪糖肾安胶囊含药血清由黄芪、丹参、益母草、女贞子、旱莲草、茯苓等中药组成,由本院制剂室制备; CCK-8试剂盒(苏州新赛美生物科技有限公司); LPS(美国Sigma公司); ELISA试剂盒(武汉华美生物有限公司); 兔抗大鼠NLRP3抗体(1∶500)、caspase-1抗体(1∶500)、GAPDH(1∶1 000)及辣根过氧化物酶标记免疫球蛋白G(IgG)二抗(1∶2 000)(武汉艾美捷科技有限公司)。
1.2 仪器
BIORAD-550型酶标仪(北京京科瑞达科技有限公司); BBS-V800型单人超净台(济南丰盈医疗器械有限公司); SPX-250型细胞培养箱(上海跃进医疗器械有限公司); CE-100型凝胶电泳仪(上海金鹏分析仪器有限公司); FACS Calibur流式细胞仪(美国BD公司)。
1.3 细胞培养
将HK-2细胞接种于含10%胎牛血清的DMEM培养基中,加入青霉素(100 U/mL)-链霉素(100 μg/mL)双抗,而后将细胞培养于37 ℃、5%CO2的培养箱中, 2 d更换培养液1次。待细胞生长融合至80%时传代,传代比例1∶3。取对数的HK-2细胞用于实验。
1.4 制备含药血清
SPF级SD大鼠12只,雄性,体质量200~220 g, 购自北京维通利华实验动物技术有限公司, SYXK(京)2022-0052, 自由饮食进水。将大鼠随机分为空白组(n=4)和药物干预组(n=8)。按照成人临床用药剂量计算,药物干预组给予5.6 g/kg参芪糖肾安灌胃,空白组大鼠给予等量的生理盐水灌胃。每天1次,连续灌胃7 d。末次灌胃给药前大鼠均禁食8 h, 自由饮水, 30 min后取股动脉血,静置2 h后离心20 min, 离心速度3 000转/min, 收集上清液于-20 ℃冰箱保存。
1.5 实验浓度筛选
取对数生长的HK-2细胞于含LPS的培养基中培养,分为空白血清组及含药血清组(将血清用RMPI 1640培养基培养稀释,体积分数分别为1.00%、1.25%、2.50%、5.00%、10.00%),采用CCK-8法计算细胞存活率(%),通过计算含药血清体积分数确定血清实验浓度。
1.6 细胞处理与分组
调整HK-2细胞密度为3×103个/孔,而后接种于96孔板,常规培养箱培养。随机将细胞分为空白组(HK-2+75 μL 7.5%空白血清)、LPS组(HK-2+LPS+75 μL 7.5%空白血清)、低浓度组(HK-2+LPS+75 μL 2.5%含药血清+75 μL 7.5%空白血清)、中浓度组(HK-2+LPS+75 μL 5%含药血清+75 μL 5%空白血清)、高浓度组(HK-2+LPS+150 μL 10%含药血清)。
1.7 CCK-8检测细胞增殖能力
调整HK-2细胞密度为5×104个/mL, 而后接种于96孔板中,采用完全DMEM培养基培养于37 ℃、5%CO2培养箱中48 h,随后于孔板的每孔中加入100 μL的CCK-8溶液,于上述相同的培养箱培养4 h, 于450 nm波长处在酶标仪上测定各组细胞的光密度(OD)值。
1.8 Annexin V-FITC/PI双染法检测细胞凋亡能力
调整HK-2细胞密度为1×104个/mL,而后接种于6孔板中,常规培养24 h。向细胞中加入500 μL结合缓冲液重悬细胞,而后与5 μL Annexin V-FITC混合并振匀,在室温环境中避光孵育15 min,随后与10 μL PI混合并振匀,相同条件孵育15 min; 流式细胞仪检测细胞凋亡率。
1.9 ELISA检测细胞培养上清液中IL-6、IL-1β、TNF-α水平
收集各组细胞培养液于离心管中,离心机3 000 转/min离心5 min, 收集上清液于EP管中,按照ELISA试剂盒说明书检测上清液中IL-6、IL-1β、TNF-α水平。
1.10 电镜观察细胞形态
取各组HK-2细胞并用0.25%胰蛋白酶消化,离心机800 转/min离心5 min, 加入2.5%戊二醛磷酸盐缓冲液(pH=7.4)固定细胞,次日PBS清洗细胞,采用2%四氧化锇固定细胞4 h。细胞脱水后置于丙酮中,采用环氧树脂包埋细胞; 切片机将包埋细胞切成薄片,厚度为50 nm, 晾干切片后用醋酸铀酰和碱性柠檬酸铅染色,透射电镜观察细胞的超微结构。
1.11 蛋白质印迹检测细胞中NLRP3、caspase-1蛋白表达
采用0.25%胰蛋白酶消化各组细胞,离心细胞并收集上清液, DAB法检测细胞中蛋白浓度。配置等浓度蛋白溶液为2 μg/mL, 按照6∶1的比例加入相应体积溶液,煮沸溶液10 min后保存蛋白溶液于-20 ℃的冰箱。取蛋白样品30 μg, 电泳蛋白样品后转移到PVDF膜上,加入5%的脱脂奶粉到PVDF膜上,封闭PVDF膜1 h, 分别加入一抗(1∶500), 在4 ℃环境中孵育一抗过夜,而后清洗PVDF膜,加入相应的二抗(1∶1 000), 室温孵育二抗2 h。将ECL发光剂加入到细胞中曝光,用显影液显影,采用Image Lab软件分析各条带灰度值。
1.12 统计学分析
实验数据采用GraphPad Priam8.0软件进行统计学分析。计量资料采用均数±标准差表示。不同组间数据采用单因素方差(one-way ANOVA)分析,各组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞存活率比较
1.00%和1.25%的含药血清细胞存活率与LPS组相比,差异无统计学意义(P>0.05); 2.50%、5.00%、10.00%的含药血清存活率与LPS组比较,差异有统计学意义(P<0.05), 且呈剂量依赖性,因此选用含药血清浓度为2.50%、5.00%、10.00%(图1A)。LPS组细胞存活率低于空白组,差异有统计学意义(P<0.05); 与LPS组相比,低浓度组、中浓度组和高浓度组细胞存活率均增高,差异有统计学意义(P<0.05), 且随着浓度的增加,细胞的存活率更高,差异也有统计学意义(P<0.05)(图1B)。
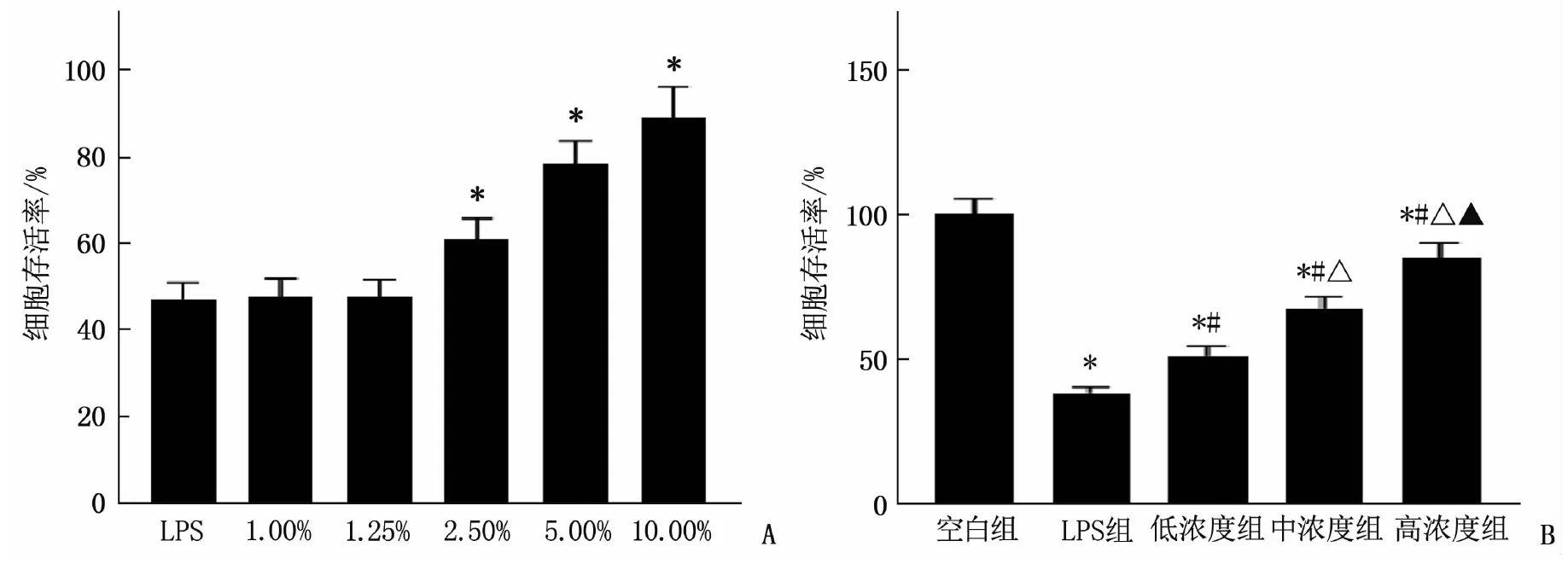
A: 不同浓度含药血清细胞存活率比较,与LPS比较, ∗P<0.05; B: 各组细胞存活率比较,与空白组比较, ∗P<0.05; 与LPS组比较, #P<0.05; 与低浓度组比较, △P<0.05; 与中浓度组比较, ▲P<0.05。
2.2 各组细胞凋亡率比较
与空白组相比, LPS组细胞凋亡率增高,差异有统计学意义(P<0.05); 与LPS组相比,低浓度组、中浓度组和高浓度组细胞凋亡率降低,且高浓度组细胞凋亡率低于低浓度组和中浓度组,差异均有统计学意义(P<0.05)。见图2。
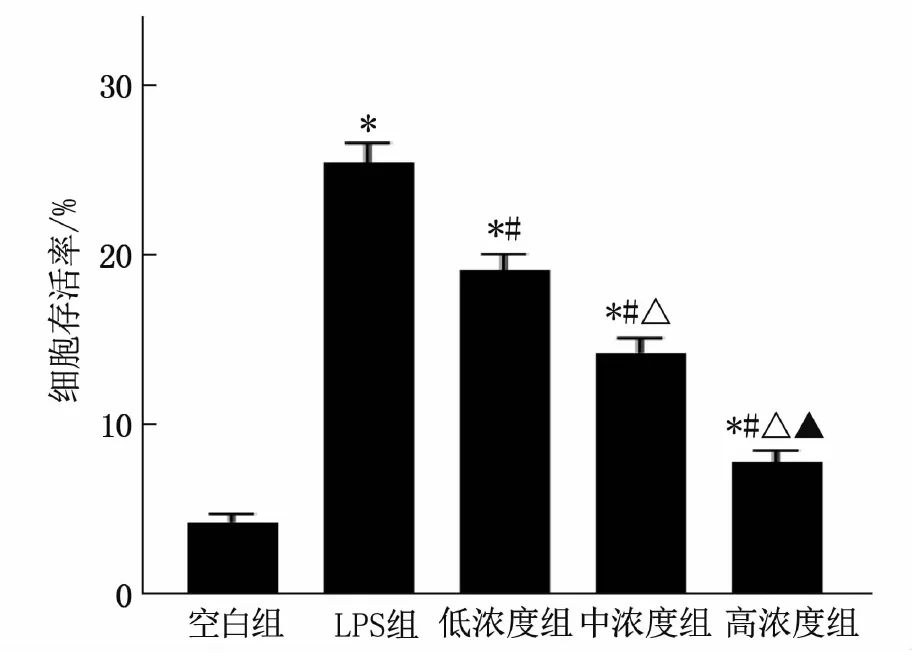
与空白组比较, ∗P<0.05; 与LPS组比较, #P<0.05; 与低浓度组比较, △P<0.05; 与中浓度组比较, ▲P<0.05。
2.3 各组细胞炎症因子水平比较
与空白组相比, LPS组细胞中IL-6、IL-1β、TNF-α水平均升高,差异有统计学意义(P<0.05); 与LPS组相比,低浓度组、中浓度组和高浓度组细胞中IL-6、IL-1β、TNF-α水平均降低,且高浓度组细胞中IL-6、IL-1β、TNF-α水平低于低浓度组和中浓度组,差异均有统计学意义(P<0.05)。见图3。

A: 各组IL-6水平比较; B: 各组IL-1β水平比较; C: 各组TNF-α水平比较。与空白组比较, ∗P<0.05; 与LPS组比较, #P<0.05; 与低浓度组比较, △P<0.05; 与中浓度组比较, ▲P<0.05。
2.4 各组细胞超微结构比较
与空白组相比, LPS组细胞大量坏死,胞体明显变大,胞膜大量破裂,且胞浆内容物大量溢出在外,细胞大量坏死; 与LPS组相比,低浓度组、中浓度组和高浓度组细胞均有明显的改善,坏死的细胞数量明显减少,仅可见少量细胞线粒体轻度肿胀和空泡样变,且呈剂量依赖性。见图4。

红色箭头为坏死细胞; 橙色箭头为空泡样变。
2.5 各组细胞中NLRP3、caspase-1蛋白表达比较
与空白组相比, LPS组细胞中NLRP3和caspase-1蛋白表达升高,差异有统计学意义(P<0.05); 与LPS组相比,低浓度组、中浓度组和高浓度组细胞中NLRP3和caspase-1蛋白表达降低,且高浓度组细胞中NLRP3和caspase-1蛋白表达低于低浓度组和中浓度组,差异有统计学意义(P<0.05)。见图5。
3 讨 论
AKI由多种因素共同所致,主要是因肾功能在短期内快速降低而导致的临床综合征[9]。AKI若不能进行及时的治疗,会转变为慢性肾功能不全,最终会发展为慢性肾衰竭。近年来, AKI的细胞和分子病因机制的研究已经取得了很大的进展,研究[10]表明炎症、免疫反应、肾小球内血流动力学、肾小管周围和肾小球微血管血流紊乱均可影响AKI的进展,且多集中于肾小管上皮细胞(RTEC)的损伤。发生脓毒症时,炎性反应、氧化应激、能量代谢紊乱等作用机制均会造成RTEC损伤[11]。参芪糖肾安颗粒具有益气养阴、健脾补肾、化瘀泻浊的功效,方中黄芪具有健脾益气的功效; 丹参具有活血通经和祛瘀的功效; 女贞子具有补肝益肾滋阴的功效,旱莲草具有滋阴益肾理血的功效,女贞子联合旱莲草具有补肝肾之阴虚、除虚热而凉血的功效。方中药物联合使用具有攻补兼施之效,益气养阴而不留邪,祛瘀化浊而不伤正,共奏健脾补气、滋肾养阴、活血祛瘀、利水渗湿的功效。本研究采用LPS诱导肾小管上皮细胞制备AKI体外模型,结果显示LPS组细胞存活率显著降低,凋亡率显著增加; 参芪糖肾安含药血清干预后HK-2细胞的存活率显著增加,凋亡率显著降低,且呈剂量依赖性。上述结果提示参芪糖肾安含药血清能抑制LPS诱导的HK-2细胞凋亡而引发的AKI。赵宗江等[12]研究证实,参芪糖肾安能减轻糖尿病肾病大鼠肾脏病理损害,延缓疾病的进程。
研究[13]发现, AKI可由肾脏缺血-再灌注损伤、微循环障碍、氧化应激、炎症反应损伤等因素共同所致,其能通过损伤肾脏血管内皮功能而改变血流动力学,通过形成大量的微血栓而引发AKI。当脓毒症发生时,机体内的内皮细胞、单核细胞和巨噬细胞等会通过内毒素和病原微生物的刺激而激活,通过释放出大量的炎症因子而加重病情[14]。研究[15]发现, AKI的早期会有大量的炎症介质释放,包括IL-6、IL-1β、TNF-α等,机体通过识别病原微生物而释放抗炎因子和炎性标记物,通过诱发代偿性抗炎反应综合征而形成抗炎和促炎的动态变化。当机体有明显的抗炎反应时,会通过降低机体对外界的抗打击能力而加剧病情[16]。本研究结果显示,LPS组细胞中IL-1β、TNF-α、IL-6水平显著增加,糖肾安含药血清干预后HK-2细胞中IL-6、IL-1β、TNF-α水平均显著降低,且超微结构结果证实,细胞中炎性因子显著减少,且呈浓度依赖性,提示糖肾安含药血清对LPS诱导的HK-2细胞炎性损伤具有保护作用。张泽英等[17]研究证实,可通过抑制由LPS诱导的炎症因子的释放改善脓毒症大鼠肾脏损伤,进而发挥保护作用。
NLRP3炎性小体在静止状态下包含ASC和pro-Caspase-1。当机体感受到外界刺激时,NLRP3会通过改变结构而聚集AS和pro-Caspase-1, 聚集的pro-Caspase-1通过自我剪切形成具有活性的Caspase-1, 进而通过对炎症抑制的激活而攻击病原体及相关组织。近年来研究[18]发现,NLRP3可介导糖尿病肾病及肾缺血再灌注损伤的发生发展,可通过降低NLRP3的活性抑制炎性反应来改善肾脏损伤。本研究结果显示, LPS组细胞中NLRP3和caspase-1蛋白明显增加,提示AKI能激活NLRP3炎性小体进而增加caspase-1的表达。参芪糖肾安胶囊含药血清干预后HK-2细胞中NLRP3和caspase-1蛋白表达明显降低,超微结构结果证实细胞坏死数量显著减少,且呈浓度依赖性,提示参芪糖肾安胶囊含药血清可通过抑制NLRP3和caspase-1降低组织损伤。
综上所述,参芪糖肾安胶囊含药血清可抑制LPS损伤的肾小管上皮细胞凋亡,增高细胞存活率,改善超微结构,抑制NLRP3炎性小体介导的炎性反应,对AKI发挥保护作用。

