稻田养蟹与池塘养蟹对养殖环境中浮游生物群落的影响
胡清彪,梅 杰,李晓东,,李 鹏
(1.沈阳农业大学a.动物科学与医学学院,b.辽宁盘锦湿地生态系统国家野外科学观测研究站,沈阳 110161;2.农业农村部中华绒螯蟹育种与繁养重点实验室,辽宁 盘锦 124200;3.盘锦光合蟹业有限公司,辽宁 盘锦 124200)
中华绒螯蟹(Eriocheir sinensisH.Milne-Edwards),俗称大闸蟹、河蟹。常在淡水水域栖息生存、在海水域繁殖进行降海洄游,是一种大型洄游性甲壳类生物,是我国较为重要的一种水产经济物种,在我国分布较广,主要位于辽河水域、瓯江水域和长江水域,东从鸭绿江西至湖北均有分布。自20 世纪70 年代末以来,人们开展了中华绒螯蟹的养殖和育苗工作。随着人工养殖技术的突破,行业得到了很大的发展,养殖方式也迅速发展,形成了多种技术,打破了中华绒螯蟹的传统地理分布。如今,人工养殖方式主要有4 种:湖泊放养、湖泊围网、池塘养殖和稻田养殖。湖泊放养和湖泊围网的成本最低,稻田养殖居中,而池塘养殖成本最高。中华绒螯蟹养殖区域开始从分散型养殖区域变得更加集中,形成了以各种湖泊和河流为基地的区域集约化、规模化养殖模式[1]。目前,养殖中华绒螯蟹的省份有20 多个,主要有江苏、安徽、湖北、辽宁、山东、河北、广东、福建、浙江、江西等[2]。1990-2021年,中华绒螯蟹的产量由最初的4 833 t[3]增长至808 274 t[4],增长167倍。
中华绒螯蟹可以通过捕食浮游生物及底栖动物,从而改变其群落的组成,导致生态系统内的营养循环和能量流动的变化。一方面,中华绒螯蟹的捕食行为直接或间接影响其群落;另一方面,中华绒螯蟹在生长代谢过程中,排出的粪便和呼出的CO2增加了水体中氮、磷和碳的含量,有利于浮游生物及底栖动物的生长[5-6]。同时,中华绒螯蟹活动的增加,降低了水体pH 值,同时其摄食行为对浮游生物及底栖动物起到一定的抑制作用[7-8]。
稻蟹综合种养采用的投饲方式,与池塘养殖基本相同。但稻田养蟹与池塘养蟹对养殖环境中浮游生物的影响尚未见报道,本试验以2种养殖模式中浮游生物及底栖动物为研究对象,研究中华绒螯蟹养殖对水环境浮游生物的影响,对中华绒螯蟹养殖条件的优化及养蟹对水域环境的影响研究具有一定的理论参考价值,对中华绒螯蟹养殖具有一定的应用价值。
1 材料与方法
1.1 试验池塘及稻田管理
试验于2021 年6 月28 日~9 月2 日在辽宁省盘锦市盘锦光合蟹业有限公司科研试验田进行。分别选择稻田及与之相邻的池塘各3 块作为平行组(E121°51'39'',N40°54'6'')。试验稻田,在种植水稻前一次性完成底肥的投施(控释性掺混肥料:N-P2O5-K2O,30-16-6)。
1.2 试验设计
试验在6 个试验田内进行,分为稻田组(R)和池塘组(P),其中3 块稻田(面积:30 m×17 m)和3 口池塘(面积:16 m×4 m)编号分别表示为R1、R2、R3,P1、P2、P3。每块试验田5 月16 日进行蓄水,6 月2 日稻田组进行插秧。6月29日稻田组与池塘组均投放健康和规格相近的中华绒螯蟹[雄蟹(11.24±2.67)g,雌蟹(10.9±2.61)g],投放密度参照实际养殖密度[9]:稻田组0.45 inds·m-2、池塘组0.75 inds·m-2。所有试验组投喂相同的蟹料,每天投喂1次,投喂量根据实验蟹体质量的3%~5%定量投喂。共进行5次取样(每次取样均采用5点取样法,将5点取得的样品充分混匀后,取1/5带回实验室对其浮游动、植物和底栖动物进行定性定量分析),其中6月28日进行初次采样(未投放中华绒螯蟹),接下来每15 d进行1次采样。
1.3 试验方法
1.3.1 浮游动、植物定性定量 取样和测定方法参考张晨[10]。参照《天津地区浮游生物彩色图谱》[11]进行定性分析,定量分析参照《水生生物学》[12]提供的方法执行,浮游植物比重近似于1,故体积可直接换算成湿重。
1.3.2 底栖动物定性定量 底栖动物定量用了自制的筒状采泥器来量化稻田和池塘中的底栖动物[13]。将采泥器放置在取样点,采集约10 cm深的泥浆。将泥浆带到实验室作进一步分析。用孔径为0.2~2.0 mm的多级筛子将泥浆筛出来。然后精确称湿重,并对样品中的不同生物进行量化。
优势度(Y)计算公式为:
式中:Y为优势度(规定当Y>0.02 时,该种为优势种);ni为种i的个体数;N为总个体数;fi为种i在各个采样点出现的频率。
Shannon-Wiener多样性指数(H')计算公式为:
式中:ni为种i的个体数;N为物种的总个体数。
1.4 数据分析
结果以平均值±标准差(SD)表示(n=3),并采用GraphPad Prism 6 做图。显著性差异分析采用SPSS 22.0 的单因素方差分析(ANOVA)计算。p<0.01为差异极显著,P<0.05为差异显著。
2 结果与分析
2.1 稻田养蟹与池塘养蟹对养殖环境中浮游植物的影响
2.1.1 群落构成和种类分布 在5次采样过程中,对稻田和池塘中浮游植物物种的组成进行分析,结果表明(表1),共鉴定出属于7个门类的29种(属)浮游植物。其中硅藻门种类最多,为10种(属),占浮游植物种类总数的34.5%;其次是绿藻门,为8种(属),占浮游植物种类总数的27.6%,构成了浮游植物群落的大部分,蓝藻门4种(属)占总数的13.8%;裸藻门3种(属)占种类总数的10.3%;甲藻门2种(属)占总数的6.9%、隐藻门1种(属)占总数的3.4%;金藻门1种(属)占总数的3.4%。浮游植物群落构成主要为绿藻门和硅藻门。在整个采样周期中,只有在6月28日观察到金藻门的存在,在其他采样时段都没有,而在整个采样周期其他门类的浮游植物出现频率都较多。
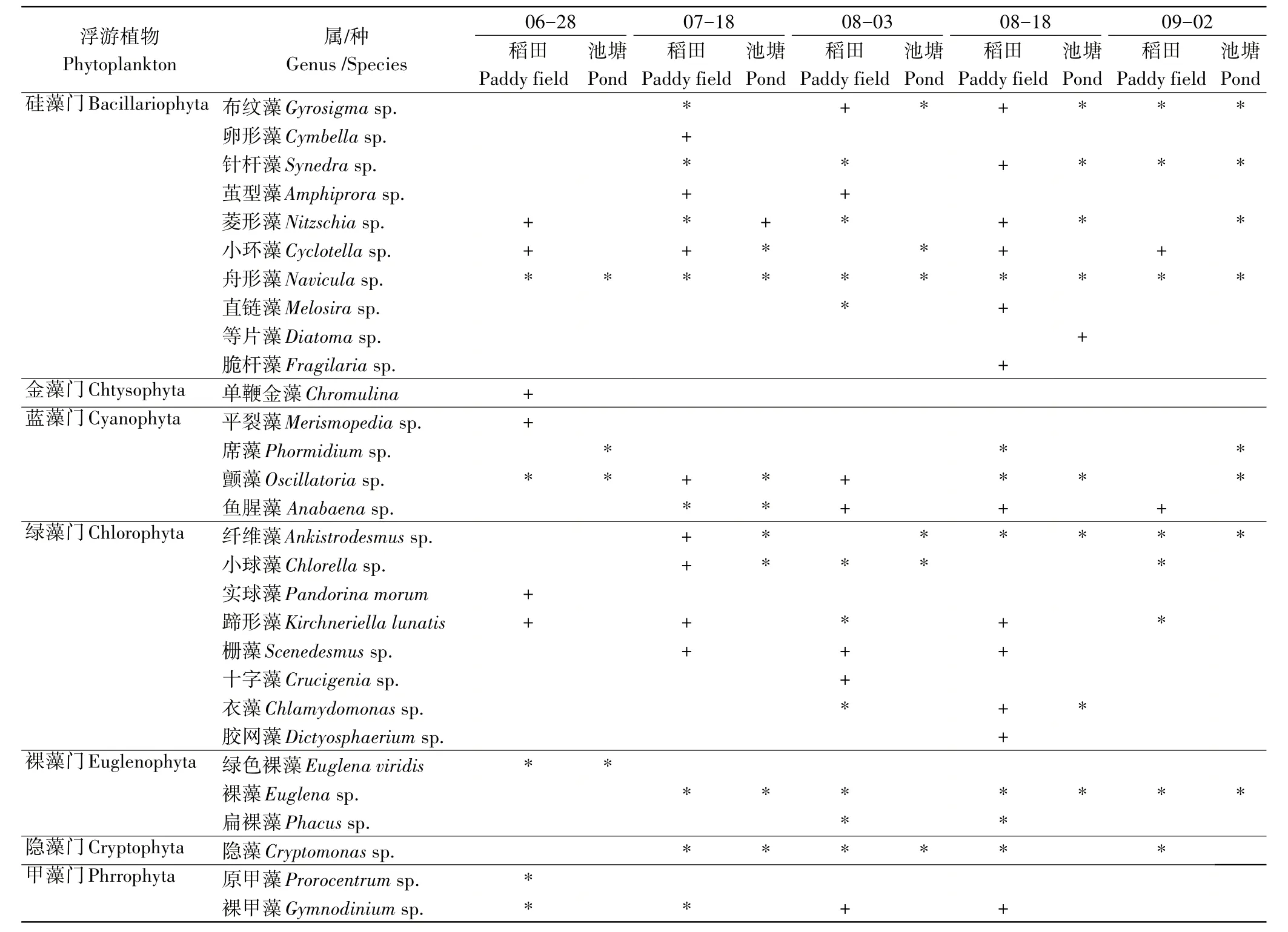
表1 两种养殖模式浮游植物的种类组成Table 1 Species composition of phytoplankton in the two culture modes
2.1.2 平均密度 浮游植物的平均密度结果表明(图1a),除6月28日和7月18日稻田模式和池塘模式的平均密度无显著差异(p>0.05),在其他3个采样周期中,稻田模式水体中浮游植物的平均密度都显著高于池塘组(p<0.01)。在整个采样周期中,稻田模式和池塘模式的浮游植物平均密度呈现相同的趋势,都呈现先增加后下降的趋势,稻田模式的平均密度在8月18日达到最大值(120.83×104cell·L-1),且稻田模式的浮游植物平均密度一直高于池塘模式的平均密度。

图1 2种养殖模式对浮游植物平均密度(a)、平均生物量(b)和Shannon-Wiener多样性指数(c) 的影响Figure 1 Effects of two culture patterns on the average density (a), the average biomass (b) and the Shannon-Wiener diversity index (c) of phytoplankton
2.1.3 平均生物量 试验监测5个采样期稻田模式和池塘模式水体中浮游植物的平均生物量(图1b)。除7月18日和8月3日稻田模式的平均生物量显著高于池塘模式(p<0.05)外,其他3个采样期的平均生物量均无显著差异(p>0.05)。在调查期内,池塘模式浮游植物的平均生物量则继续增加,而稻田模式浮游植物的平均生物量呈先上升后下降趋势,且在8月3日达到最大值(2.91±0.23)mg·L-1。在整个采样周期内,稻田模式的平均生物量始终高于池塘模式。
2.1.4 多样性指数 Shannon-Wiener多样性指数结果表明(图1c),在5个采样周期中,稻田模式Shannon-Wiener多样性指数始终高于池塘模式,但除8月3日和8月18日有显著差异外(p<0.05),其他3个采样周期差异均不显著。在整个采样期间,稻田模式的Shannon-Wiener多样性指数呈先上升后下降的趋势,在8月18日采样周期达到峰值,达到3.19,而池塘模式呈现了先上升后下降再上升的趋势,9月2日达到了最高值,为2.1。
2.2 稻田养蟹与池塘养蟹对养殖环境中浮游动物的影响
2.2.1 群落构成和种类分布 稻田和池塘中的浮游动物种类组成结果表明(表2),5次采样共获得浮游动物34种,其中原生动物8种,占浮游动物种类总数的23%;枝角类9种,占种类总数的26%;桡足类3种,占总数的8%;轮虫14种,占总数的41%。

表2 两种养殖模式浮游动物的种类组成Table 2 Species composition of zooplankton in two culture modes
2.2.2 平均密度 两种养殖模式下浮游动物的平均密度结果表明(图2a),在整个采样周期中,除7月18日和8月18日稻田模式浮游动物的平均密度显著高于池塘模式(p<0.05)外,其他采样时期均无显著差异。从浮游动物平均密度总体来看,浮游动物的平均密度呈下降趋势。
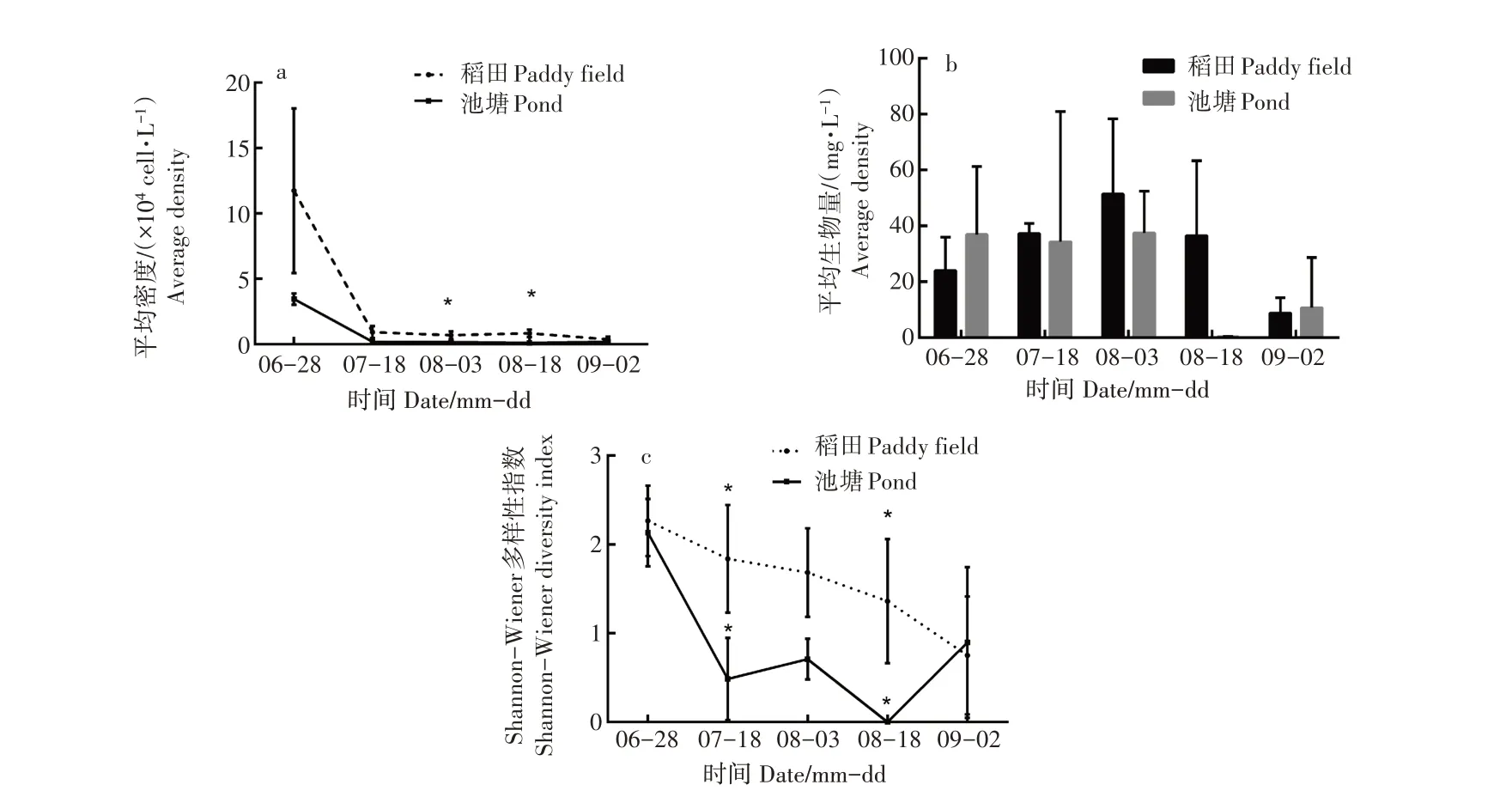
图2 2种养殖模式对浮游动物平均密度(a)、平均生物量(b)和Shannon-Wiener多样性指数(c) 的影响Figure 2 Effects of two culture patterns on the average density (a),the average biomass (b) and the Shannon-Wiener diversity index (c) of zooplankton
2.2.3 平均生物量 在整个采样周期中,稻田模式与池塘模式浮游动物的平均生物量均无显著差异(图2b)。在8月3日采样时,稻田模式与池塘模式平均生物量达到最大,分别为(51.35±26.93)mg·L-1和(37.43±15.05)mg·L-1。从整体来看,稻田模式平均生物量呈先上升后下降的趋势,而池塘模式的平均生物量呈波动趋势。
2.2.4 Shannon-Wiener多样性指数 通过Shannon-Wiener多样性指数表示稻田和池塘养殖模式浮游动物的多样性(图2c),在8月3日和8月18日采样中,稻田模式浮游动物的Shannon-Wiener多样性指数显著高于池塘模式(p<0.05),其他3次采样,稻田模式和池塘模式浮游动物的Shannon-Wiener多样性指数并无显著差异。从整体来看,稻田模式的Shannon-Wiener多样性指数呈下降趋势,而池塘模式的Shannon-Wiener多样性指数呈波动趋势,在最后阶段,池塘模式的Shannon-Wiener多样性指数超过稻田模式。
2.3 稻田养蟹与池塘养蟹对养殖环境中底栖动物的影响
2.3.1 群落构成和种类分布 经鉴定,5次采样共获得6种(属),主要是软体动物门、环节动物门。水丝蚓(Limnodrilus),尾鳃蚓(Branchiura),环棱螺(Bellamya)在整个采样周期中均可检测到,属于常见种(表3)。
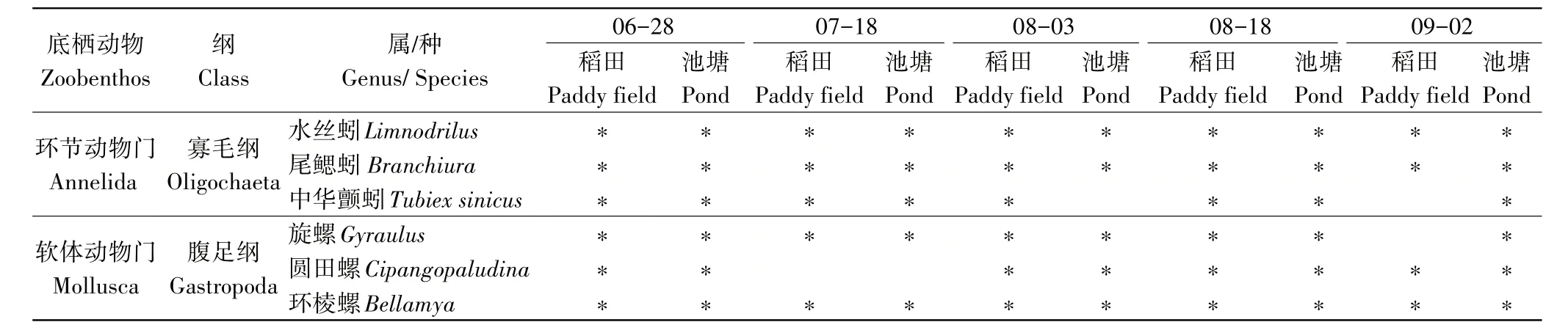
表3 两种养殖模式底栖动物的种类组成Table 3 Species composition of zoobenthos in two culture modes
2.3.2 平均密度 2种养殖模式对底栖动物平均密度的影响结果表明(图3a),在5个采样周期中,稻田模式和池塘模式的底栖动物平均密度均无显著差异(p>0.05)。从底栖动物平均密度总体来看,随中华绒螯蟹的生长,稻田模式的平均密度呈先增大后减小,再增大的趋势,而池塘模式呈先减小后增大的趋势。
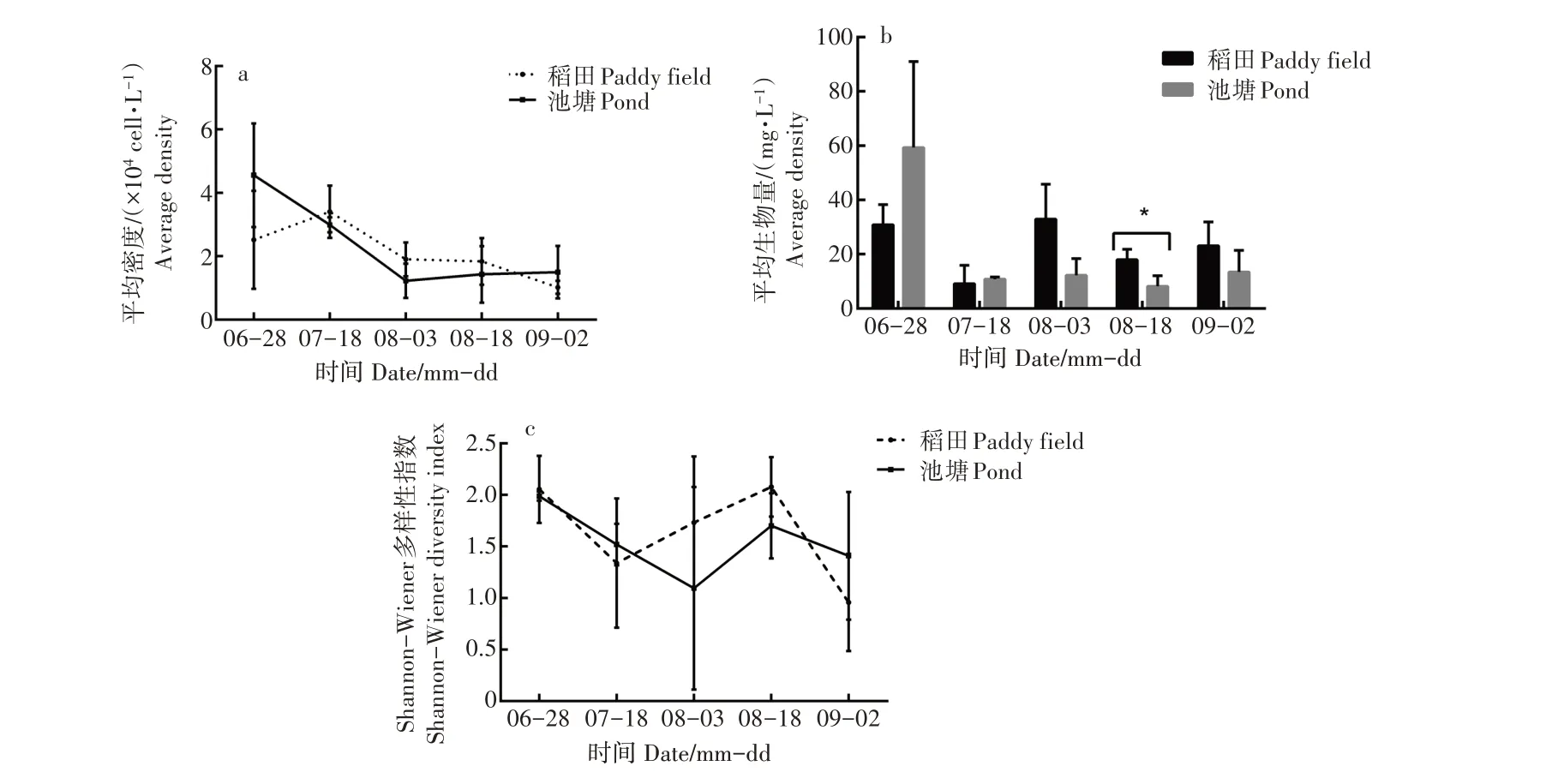
图3 两种养殖模式对底栖动物平均密度(a)、平均生物量(b)和Shannon-Wiener多样性指数(c) 的影响Figure 3 Effects of two culture patterns on the average density (a),the average biomass (b) and the Shannon-Wiener diver‐sity index (c) of zoobenthos
2.3.3 生物量 两种养殖模式对底栖动物平均生物量的影响如图3b。在整个采样周期中,除8月18日的稻田模式平均生物量显著高于池塘模式外(p<0.05),其他4次采样周期的平均生物量均无显著差异。从整体来看,前两次采样时池塘模式的底栖动物平均生物量高于稻田模式,但在8月3日采样周期后,稻田模式的底栖动物平均生物量均高于池塘模式。
2.3.4 Shannon-Wiener多样性指数 在整个采样周期中,稻田模式和池塘模式底栖动物的Shannon-Wiener多样性指数无显著差异(p>0.05)(图3c),8月18日时,稻田模式和池塘模式底栖动物的Shannon-Wiener多样性指数均有所上升,且稻田模式的Shannon-Wiener多样性指数升到最大值2.08±0.29,而池塘模式最大值在6月28日,为(1.99±0.04)。稻田模式和池塘模式底栖动物的Shannon-Wiener多样性指数呈先减少后增大趋势。
3 讨论与结论
3.1 2种养殖模式对浮游植物群落的影响
浮游植物在水生生态系统中作为初级生产者发挥着关键作用,它们对水环境的变化高度敏感。水体中浮游植物的种类、数量和模式与各种环境因素密切相关。它们可以作为水体富营养化的重要生物指标。Shannon-Wiener 多样性指数是衡量浮游植物群落结构复杂性的一个重要指标。多样性指数越高,群落结构就越复杂多样,表明水质越好。反之,多样性指数越低,意味着群落结构越简单、越不稳定[14]。监测水体中浮游植物的多样性指数以评估其生态健康状况,并在多样性指数较低时采取必要的措施来改善水质是很重要的。
本试验中,未投放中华绒螯蟹前,稻田模式和池塘模式之间的水体浮游植物的物种数量、平均密度、平均生物量和多样性指数没有显著差异。随着试验的进行,浮游植物的生物量达到了峰值,且稻田模式显著高于池塘模式。这可能是由于稻田中施加的缓释肥料正常释放硝酸盐以及中华绒螯蟹代谢物的分解,为浮游植物提供了营养源,这与DUARTE等[15]的结果一致。试验后期,稻田模式的浮游植物密度,生物量,多样性指数都呈下降趋势,其原因是水稻的生长吸收了稻田的肥料以及水稻的遮阴作用影响了浮游植物的光合作用,而池塘模式无明显变化也验证了这个推论。
3.2 2种养殖模式对浮游动物群落的影响
捕食和温度是影响浮游动物群落结构的两个最重要的因素[16]。试验结果表明,在未投放中华绒螯蟹前,浮游动物平均密度、多样性指数较高,随着试验进行,浮游动物平均密度和多样性指数下降,且稻田模式显著高于池塘模式,可能是由于中华绒螯蟹对浮游动物的摄食,干扰了浮游动物的模式生成。
在整个采样周期内,稻田模式和池塘模式浮游动物的生物量差异不显著且变化幅度不大。浮游动物生物量呈先增高后降低的趋势,在试验初期,浮游动物的密度和多样性指数下降,但浮游动物的生物量反而增加,这可能是由于大型浮游动物的存在导致的,例如剑水蚤等。试验中后期,稻田模式和池塘模式的浮游动物生物量下降,可能是由于中华绒螯蟹捕食和温度下降的原因,这与RECORD等[17]的研究结果一致。且稻田模式浮游生物生物量始终高于池塘模式,这是因为稻田模式浮游植物生物量高,浮游动物通过摄食浮游植物,导致稻田模式浮游动物生物量高于池塘模式。
3.3 2种养殖模式对底栖动物的影响
底栖动物是中华绒螯蟹主要的饵料[18]。许巧情等[19]发现,中华绒螯蟹通过摄食可以影响底栖动物群落结构。在试验初期,由于中华绒螯蟹还未投放,底栖动物不受中华绒螯蟹影响,生物量较高。随着中华绒螯蟹的生长,对底栖动物的捕食作用和中华绒螯蟹的生命活动改变了水体环境[20],使得底栖动物的生物量也随之下降。然后,底栖动物生物量呈上升趋势,这是因为有中华绒螯蟹捕食的胁迫作用,使得尾鳃蚓、水丝蚓等底栖动物有挖洞下钻进行繁殖的习性,使得底栖动物生物量随之增加,这与YU等[21]的试验结果一致。
水温是影响大型底栖生物群落结构的一个关键参数[22]。许多研究已经证明其重要性,在洞庭湖,水温是影响大型底栖动物群落结构的主要环境因素[23]。在渭河流域,大型底栖生物多样性与水温之间存在密切关系[22]。在试验中期,随着温度的上升,底栖动物生物量呈上升趋势,稻田模式在8月3日达到峰值,随后可能由于季节原因,水温降低,底栖动物的生物量呈下降趋势。对底栖动物的影响主要来自中华绒螯蟹的摄食和温度,这与前人的研究结果一致[19,24]。
在养殖水环境中,浮游植物、浮游动物和底栖动物的种类和生物量与养殖模式密切相关。2 种模式下,浮游植物生物量整体呈先上升后下降的趋势。浮游动物生物量整体呈现先上升后下降。底栖动物生物量整体呈现先下降再上升再下降趋势。稻田模式的浮游动植物和底栖动物生物量和多样性指数高于池塘模式,这表明稻田模式浮游生物群落结构相对稳定。
致谢:感谢盘锦光合蟹业有限公司无偿提供的试验稻田及试验池塘,感谢公司员工徐显峰、郑岩、孙娜等在试验期间对稻田及池塘的围网建设及蓄水、稻田插秧的安排帮助以及后期试验田管理的无偿指导帮助,在此一并致谢!

