MAGEA3基因表达对亚洲胃癌患者免疫微环境的影响
金劲激,蔡一奇,杨佳欣,程骏,王鹏飞
温州医科大学附属第一医院 胃肠外科,浙江 温州 325015
胃癌在全球癌症相关死亡原因中排名第四,也是排名第五的常见癌种[1],其发病率有明显的地域差异,近60%的胃癌发生在东亚[2],而东亚也是全球胃癌相关病死率最高的地区。此外,研究表明,亚裔美国人的胃癌发病率高于非西班牙裔白人[3-4],这表明亚裔胃癌不仅与生活方式和文化有关,还与遗传有关。但亚洲胃癌患者较其他地区的胃癌患者有更好的预后,这可能得益于胃癌的早期筛查工作和积极的治疗[5]。由于胃癌的预后不仅取决于肿瘤分期,还取决于肿瘤的异质性和表观遗传分子特征[6],而胃癌不同种族群体之间存活差异的可能原因尚未阐明,因此探索亚洲胃癌患者的发病机制将为胃癌患者的预后预测和治疗提供新的思路。
MAGEA3(melanoma-associated antigen A3)是最常见也是研究最多的肿瘤睾丸抗原(cancertestis antigen, CTA)之一。它在正常组织中不表达,但在许多肿瘤中特异性高表达[7]。我们的前期研究通过分析TCGA(the Cancer Genome Atlas)数据发现MAGEA3可以显著影响胃癌患者的免疫调控,并促进胃癌患者的淋巴结转移[8]。但TCGA是美国国立卫生研究院发起的一个针对全球的癌症基因组研究项目,患者构成以美国人群为主,故TCGA的分析结果不一定适用亚洲人群。而亚洲肿瘤研究组(the Asian Cancer Research Group, ACRG)是由亚洲地区的实验室和研究人员组成的一个合作组织,主要致力于研究亚洲地区的癌症发生、发展和治疗,通过对该数据库的数据分析可反映MAGEA3对亚洲胃癌患者的免疫调控影响。因此,本研究通过分析ACRG中的GSE52254数据集,探讨MAGEA3对亚洲胃癌患者免疫微环境及免疫调节的影响,并进一步通过收集临床胃癌患者血清进行了验证。
1 材料和方法
1.1 数据准备 从GEO数据库(GEO:https://www.ncbi.nlm.nih.gov/geo/)中下载GSE52254/ACRG数据集,其中共有300例亚洲胃癌患者基因信息及临床信息。根据MAGEA3基因表达值的中位数(1.012),将胃癌患者分为MAGEA3 高表达组(150 例)和MAGEA3低表达组(150例)。从TCGA数据库(https://genome-cancer.ucsc.edu/)中下载375例胃癌患者信息,同样根据MAGEA3表达值的中位数将患者分为MAGEA3高表达组(188例)和MAGEA3低表达组(187例)。
1.2 MAGEA3 与肿瘤免疫微环境的关系 采用ESTIMATE算法对不同组间的RNA表达数据进行基质评分和免疫评分。比较2组的基质评分,免疫评分以及ESTIMATE评分的差异,并用Spearman相关进行相关性分析。
1.3 数据库使用 B E S T 数据库(h t t p s://rookieutopia.com/app_direct/BEST/)是可对生物标志物进行多队列以及多层面的综合分析的网站,其中包含17个胃癌数据集,3 126个胃癌患者。本研究通过该网站,完成了GSEA分析,并进一步对胃癌患者的免疫微环境进行验证。
STRING数据库(https://string-db.org/)是目前数据量最丰富、应用最广泛的研究蛋白质相互作用的数据库之一。收录了超过14 000个物种、 6 000多万种蛋白、200多亿个相互作用的信息。本研究通过STRING数据库完成了蛋白互作分析。
1.4 肿瘤浸润免疫细胞分析 CIBERSORT是基于线性支持向量回归(linear support vector regression)原理对人类免疫细胞亚型的表达矩阵进行去卷积的工具。用于芯片表达矩阵和测序表达矩阵,对未知混合物和含有相近细胞类型表达矩阵的去卷积分析优于其他方法[5]。通过CIBESORT软件从GSE52254数据集中预测每个组织中22种浸润免疫细胞类型的比例,对于每个样品,所有评估的免疫细胞类型部分的总和等于1。为了结果准确,设定模拟次数为1 000次,并通过过滤对P<0.05的样本进行后续分析。
1.5 胃癌患者血清及临床信息收集 收集2022年1月至2022年4月在温州医科大学附属第一医院胃肠外科住院的86例胃癌患者的血清样本,于手术前留取。入选标准:①经病理诊断为胃恶性肿瘤,并行胃癌根治手术(开放或腹腔镜)或行探查术(开放或腹腔镜)明确病理分级的胃癌患者。②术前有完整的临床资料,包括血常规、血生化、凝血功能指标,淋巴细胞亚群(流式细胞仪检测)包括T细胞绝对数(CD4+T细胞绝对数、CD8+T细胞绝对数)、B细胞绝对数、NK细胞绝对数。③术后有完整的组织病理分期,包括肿瘤大小、位置、分级、病理类型。排除标准:①术前接受新辅助治疗患者;②拒绝我院治疗或未明确分期患者。本项研究已通过我院伦理委员会备案(KY2022-R042),所有入组患者均签署知情同意书。
1.6 MAGEA3血清ELISA检测 MAGEA3 ELISA检测试剂盒购于长春晶美生物工程有限公司,通过双抗体夹心法测定血清标本中MAGEA3水平。具体步骤根据操作说明书进行:①标准品的加样:设置标准品孔及样本孔,标准品孔内各加不同浓度的标准品 50 μL。②加样:设空白孔、样本孔,空白孔除不加样本及酶标试剂,其余步骤相同。在待测样本孔中先加样品稀释液40 μL,然后再加待测样本10 μL,轻轻晃动使均匀混合。③每孔加入酶标试剂100 μL。 ④用封板膜封板后37 ℃温育1 h。⑤将20倍浓缩洗涤液用蒸馏水稀释20倍后备用。⑥小心揭开封板 膜,弃去液体,甩干,每孔加入洗涤液静置0.5 min后弃去,共重复5次后再拍干。⑦每孔加入显色剂A 50 μL,再加入显色剂B 50 μL,震荡均匀,37 ℃避光显色15 min。⑧每孔加入终止液50 μL,终止反 应。⑨进行测定,以空白孔调零,测各孔OD值,通过标准曲线计算样品中MAGEA3含量。
1.7 统计学处理方法 应用R(v.3.6.3)软件进行数据分析。正态分布的计量资料以表示,2组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,2组间比较采用秩和检验。计数资料以频数和百分比表示,2组间比较采用χ2检验或Fisher确切概率法。应用Spearman相关检验分析两因素相关性。P<0.05为差异有统计学意义。
2 结果
2.1 MAGEA3与肿瘤免疫微环境的关系 ESTIMATE结果可见MAGEA3低表达组的免疫评分、基质评分以及ESTIMATE评分均显著高于MAGEA3高表达组(P<0.001),见图1。通过Spearman相关分析进一步发现,MAGEA3表达与肿瘤免疫微环境中的免疫评分(r= -0.244,P<0.001)、基质评分(r=-0.266,P< 0.001)以及ESTIMATE评分(r=-0.277,P<0.001)呈显著负相关性(见图2)。而GSEA分析表明在MAGEA3低表达组中主要富集的相关通路为:T细胞分化、T细胞活化、T细胞扩增、巨噬细胞活化以及免疫细胞调节的相关通路,见表1。
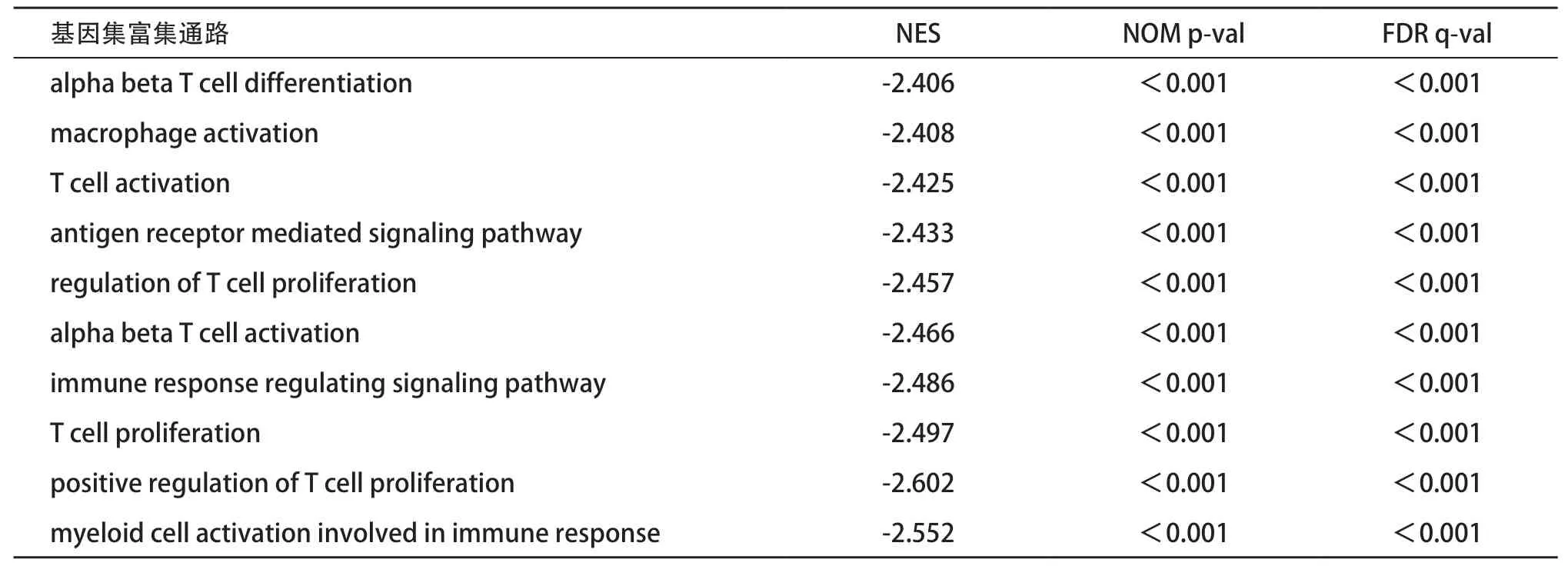
表1 基因集富集分析
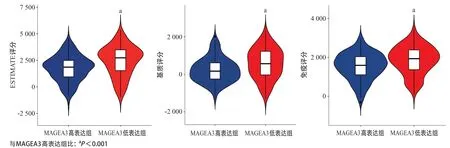
图1 MAGEA3高低表达组间ESTIMATE评分、免疫评分以及基质评分的比较
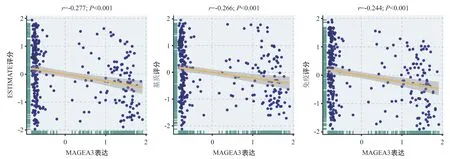
图2 MAGEA3表达与ESTIMATE评分、免疫评分以及基质评分的Spearman相关性分析
2.2 MAGEA3与肿瘤浸润淋巴细胞的关系 为了进一步验证MAGEA3表达影响胃癌免疫微环境,使用CIBERSORT算法计算分析了肿瘤浸润淋巴细胞的比例,并构建了22种免疫细胞谱。与MAGEA3高表达组相比,小提琴图提示,在MAGEA3低表达组中,幼稚B细胞、浆细胞、CD8+T细胞、γδT细胞、激活的NK细胞浸润更多,而巨噬细胞M0浸润更少(见图3A)。图3B的关联热图展示了过滤后的基因表达矩阵以及22个免疫细胞的相对百分比,图3C表明巨噬细胞M1与活化的CD4+记忆T细胞呈正相关(r=0.580),而巨噬细胞M1与主细胞的负相关最显著(r=-0.570)。
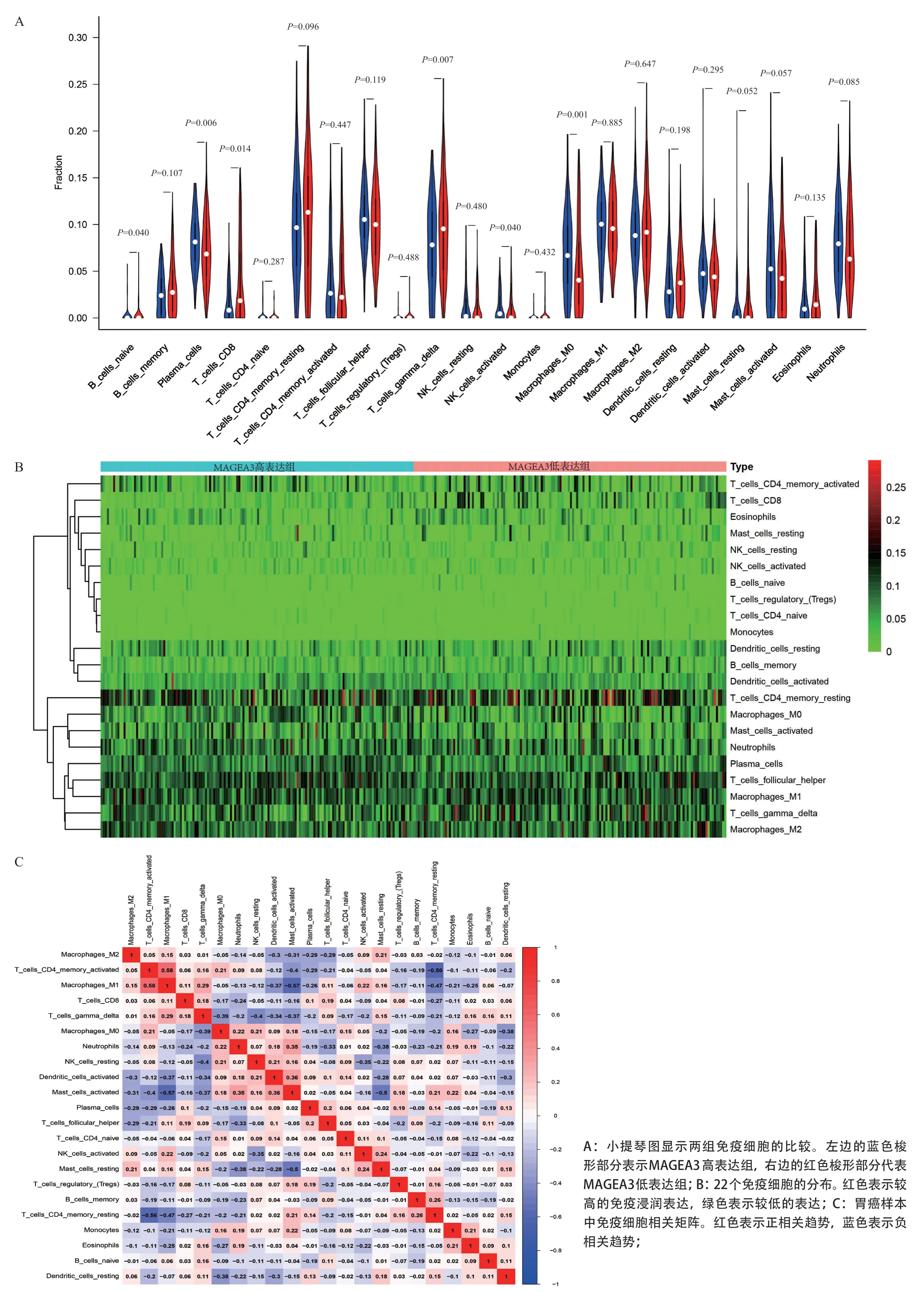
图3 使用CIBERSORT方法分析MAGEA3高低表达组之间的免疫浸润淋巴细胞
2.3 血清MAGEA3蛋白表达与免疫细胞亚群的关系 使用ACRG数据分析MAGEA3基因表达与各免疫细胞亚群的相关性,通过Spearman相关性分析可见MAGEA3表达与CD8+T细胞(r=-0.160,P=0.006)及B细胞(r=-0.140,P=0.010)呈显著负相关,与NK细胞(r=0.130,P=0.020)呈正相关。为进一步验证上述结果,我们通过ELISA法检测了本研究中心胃癌患者血清中的MAGEA3蛋白表达量,并在术前通过流式细胞分析技术计数了患者的各淋巴细胞亚群的数量,通过Spearman分析发现MAGEA3表达量与CD8+T细胞数量呈显著负相关,这结果与ACRG数据结果一致(r=-0.310,P=0.004)。见图4。
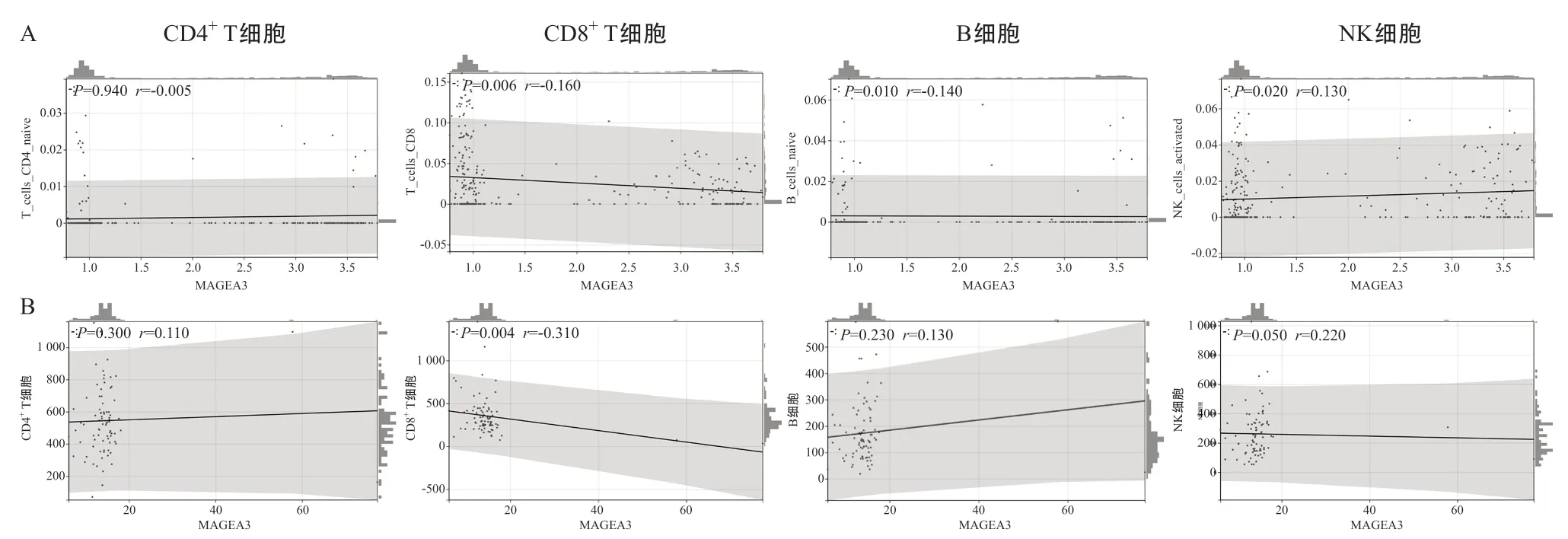
图4 ACRG(A)以及临床胃癌血清(B)中各淋巴细胞数与MAGEA3表达的Spearman相关性分析
2.4 血清MAGEA3蛋白表达与临床病理资料相关性分析 患者基线资料表见表2,根据血清MAGEA3 ELISA检测中位数14.160,将86例胃癌患者分为高MAGEA3表达组及低表达组。通过对两组之间临床病理资料的分析表明,MAGEA3高表达组的淋巴转移数更多(P=0.020),而在性别、年龄、病理类型、分期等方面,两组间差异无统计学意义(P>0.05),见表3。
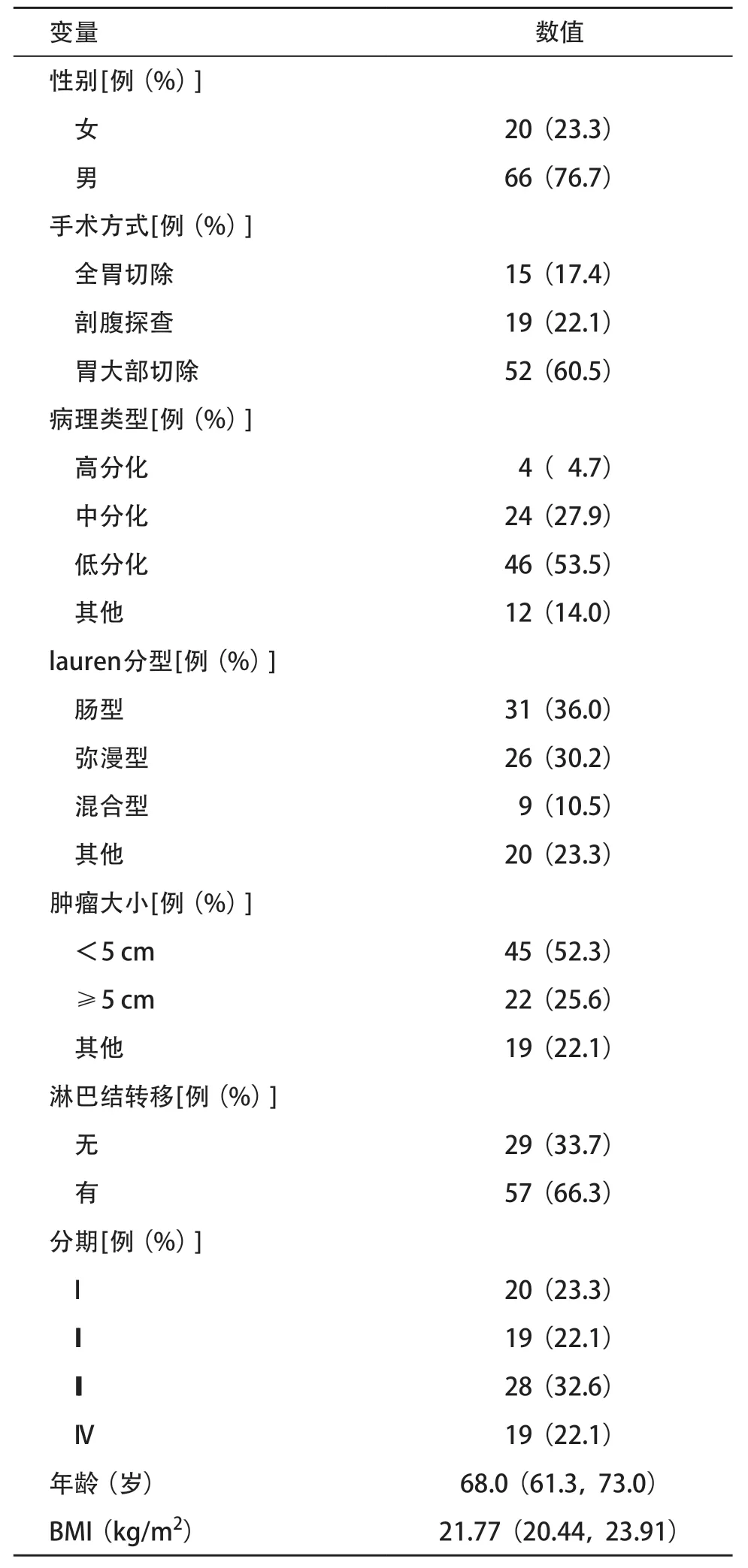
表2 胃癌患者基线资料(n=86)
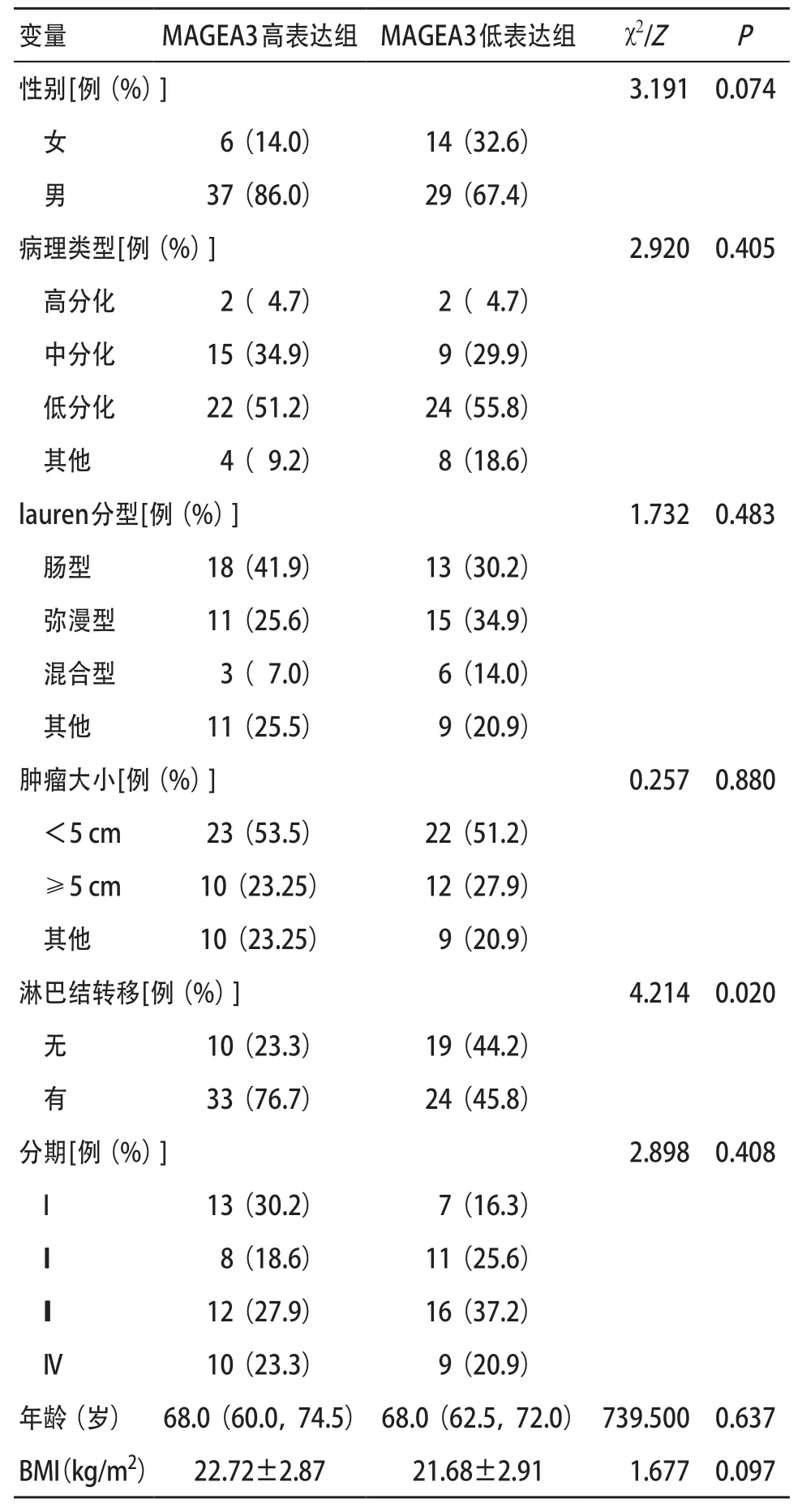
表3 MAGEA3高低表达组与临床病理资料相关分析(每组n=43)
2.5 MAGEA3表达与CD8+T细胞相关基因的关系 我们从既往文献及研究中获取CD8+T细胞相关基因共27个[9],发现在MAGEA3高低表达组中有17个基因存在显著性表达差异(见图5A),而在获取的TCGA数据库中,同样发现有17个差异表达基因(见图5B)。对两组表达差异的基因,取维恩图后获取共同表达差异基因14个(见图5C),分别为:ADRM1、CD37、CD3D、CD3E、CD8A、CSE1L、GZMA、GZMH、GZMK、IL2RB、LCK、NKG7、PIK3IP1、ZAP70。通过STRING数据库构建蛋白互作相互网络(见图5D)可发现MAGEA3与CD8A存在直接相互作用。并进一步将MAGEA3与14个差异表达基因进行功能及通路富集分析(见图5E、图5F),发现这些基因与免疫功能及相关通路存在密切相关性。
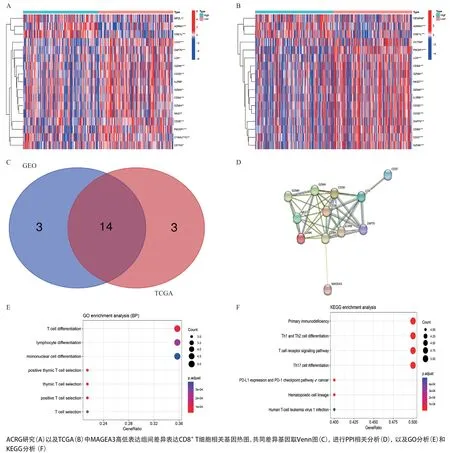
图5 CD8+ T细胞相关基因与MAGEA3相关性
3 讨论
在临床工作中,我们发现胃癌患者存在非常显著的个体差异性,生存时间可为数月至数十年[10]。即使相同的TNM分期和接受相同治疗的患者,生存结局也大相径庭[11]。而在亚洲和西方国家之间,胃癌发病率和总体生存时间也存在着显著的种族差异。因此,在胃癌发病机制的研究中也应关注到研究样本的种族差异。本研究特意选取了亚洲人群的胃癌数据进行进一步分析,使研究结果更适用于我们中国人群。
在过去的十年中,免疫治疗,特别是免疫检查点抑制剂的使用,成为一种有效的癌症治疗策略[12-13]。 TAKEI等[14]证明,抗PD-1、抗PD-L1和抗CTLA-4可改善晚期胃癌的总生存时间,提示免疫治疗方法具有长期和持久缓解胃癌的前景,但现有的胃癌免疫治疗仍存在整体有效率低,个体差异大,获益人群受限等缺点,这促使了研究者们不断地进行免疫相关基因的筛选以及靶向药物的研发。越来越多的研究发现,肿瘤微环境,包括细胞外基质、基质细胞和免疫浸润细胞,在多种肿瘤的进展、转移和治疗反应中起重要作用[15-16]。BAGAEV等[17]研究认为肿瘤微环境可以预测并影响免疫治疗反应。我们通过ESTIMATE评分计算亚洲人群肿瘤中的免疫评分和基质评分,发现在胃癌中MAGEA3的表达与两者评分呈显著负相关,提示MAGEA3的表达可能抑制了肿瘤微环境的免疫状态,而通过后续的GSEA分析证实了MAGEA3的低表达患者中存在多条免疫相关通路的激活。其中,免疫细胞是免疫微环境的重要组成部分,我们使用CIBERSORT算法评估了胃癌样品中22种免疫细胞的浸润比例,发现MAGEA3低表达组中,幼稚B细胞,浆细胞,CD8+T细胞,γδT细胞,激活的NK细胞浸润更多。同时,本研究在临床样本中,通过ELISA实验以及流式细胞术检测进一步验证上述结果。通过血清ELISA分析胃癌患者MAGEA3蛋白与外周血淋巴细胞亚群相关性,同样观察到MAGEA3与CD8+T细胞呈负相关,而CD8+T细胞是持续性免疫活动的关键因素[18]。JIN等[19]检索了EMBASE、PubMed和Web of Science数据库,发现具有高水平的CD8+T细胞的肿瘤患者在接受免疫治疗后,可以有更好的无进展生存期和总生存期。因此,低表达MAGEA3的胃癌患者因较高的CD8+T细胞比例,可能对免疫治疗的应答更佳,这也需要后续大规模临床研究分析证实。而蛋白互作分析提示MAGEA3与CD8A可能存在直接相互作用,这需进一步实验进行验证。
本研究提示了MAGEA3的高表达影响胃癌的免疫微环境,从而可能影响肿瘤的进展和治疗效果,与我们前期的研究[8]具有一致性,即,不管在亚洲人群还是西方人群,MAGEA3对于胃癌免疫微环境的影响都是存在的。结合既往研究分析[7,20],其可能的原因如下:首先,MAGEA3可能影响肿瘤细胞的免疫原性,高水平表达的MAGEA3会导致抗原提示细胞与T细胞相互作用的抗原呈递分子的表达下降,产生抗原逃逸。其次,MAGEA3可能对免疫细胞的数量和功能产生负面影响。最后,MAGEA3与肿瘤微环境中免疫相关信号通路的调节也有关联。
综上所述,本研究通过对ACRG胃癌数据的挖掘分析联合临床胃癌患者血清样本的检测,提示MAGEA3表达影响胃癌免疫微环境的变化,特别是影响了CD8+T细胞的浸润。虽然临床样本数有限,且尚未进行进一步机制研究,但结合既往研究结果,MAGEA3可能作为潜在的免疫调节基因参与胃癌的发生发展,并通过影响免疫微环境及免疫反应调控胃癌的进展。

