缺铁性贫血患者sTfR、SF、SI、UIBC、TRF检测的临床意义研究
蔡永梅
(济源市人民医院 检验科,河南 济源 459000 )
机体血红蛋白(Hb)浓度低于正常值即为贫血,根据世界卫生组织(WHO)(男Hb<130 g/L,女Hb<120 g/L)及我国指南(男Hb<120 g/L,女Hb<110 g/L)的标准确诊贫血[1]。缺铁性贫血是临床上常见的良性贫血,指由于机体铁摄入不足、铁吸收障碍、铁需求增多、铁丢失过多等引起铁元素供求失衡,Hb 合成障碍而导致,其主要临床症状为心悸、气短、头晕、眼花、食欲减退等[2]。缺铁性贫血不仅能损伤机体的免疫、神经、肌肉等,还可对器官功能、智力发育产生不可逆的影响[3],从而对患者的心理和身体发育、生活和工作产生严重影响。但不同类型贫血的血液病学检查结果具有相似性,易发生误诊,故准确的血液病学检查对贫血的鉴别诊断尤其重要。相关研究指出,机体铁代谢紊乱常引起缺铁性贫血和慢性病贫血,而铁代谢指标为常用的检测方式之一,其作为检测标准,能满足血液疾病患者的检查需求[4]。近年来,可溶性转铁蛋白受体(sTfR)、血清铁蛋白(SF)、血清铁(SI)、不饱和铁结合力(UIBC)和转铁蛋白(TRF)等常用铁代谢指标已广泛应用于贫血的诊断中,本研究主要研究铁代谢指标在缺铁性贫血患者中的临床意义,现报道如下。
1 资料与方法
1.1 一般资料
选择2021 年1 月至2023 年2 月济源市人民医院收治的30 例单纯缺铁性贫血患者作为缺铁性贫血组,30 例单纯慢性病贫血患者作为慢性病贫血组,同期选择30 例健康体检人群为健康对照组。缺铁性贫血组中男11 例,女19 例;年龄29~47 岁,平均(38.23±7.18)岁;体重指数(BMI)18~22 kg/m2,平均(20.19±1.35)kg/m2。慢性病贫血组中男12 例,女18 例;年龄28~50 岁,平均(39.22±8.41)岁;BMI 18~22 kg/m2,平 均(20.26±1.21)kg/m2。健康对照组中男10 例,女20 例;年龄27~50 岁,平均(38.72±8.56)岁;BMI 18~22 kg/m2,平均(20.49±1.32)kg/m2。三组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究已获得医院伦理委员会的审批。
1.2 入选标准
纳入标准:①贫血患者符合《血液病诊断及疗效标准》(第3 版)[5]中缺铁性贫血和慢性病贫血的诊断标准,SF<14 μg/L,铁饱和度<16%,血小板计数≥300×109/L;②无慢性出血,近3 个月内未服用过铁剂;③认知度及依从性良好;④近期无消化道、呼吸道等感染;⑤患者均签署知情同意书。排除标准:①合并严重凝血功能障碍或其他血液疾病;②合并严重脏器功能衰竭;③合并免疫系统疾病;④合并感染、急性出血等;⑤由不明原因出血导致的贫血;⑥近期服用过影响血红蛋白或血小板的相关药物;⑦合并胃肠道炎性疾病;⑧合并恶性肿瘤;⑨3 个月内有手术、创伤史;⑩存在精神异常,依从性差。
1.3 方法
试剂盒:优利科(上海)生命科学有限公司的Hb 试剂盒(酶联免疫吸附法),南京万木春生物科技有限公司生产的sTfR 试剂盒(酶联免疫吸附法),迪信泰检测科技(北京)有限公司生产的SF 试剂盒(酶联免疫吸附法),北京博沃尔斯生物科技有限公司生产的SI 试剂盒(酶联免疫吸附法),上海羽哚生物科技有限公司生产的UIBC 试剂盒(Ferene 法),滁州仕诺达生物科技有限公司生产的TRF 试剂盒(酶联免疫吸附法)及相应试剂配套的定标品和质控品。
仪器:山东威高集团医用高分子制品股份有限公司生产的WG-XXB-FLJ-I 血液成分分离机,贝克曼库尔特(爱尔兰)股份有限公司生产的DxH 500 全自动血细胞分析仪,深圳天辰医疗科技有限公司生产的CL-2000 全自动化学发光免疫分析仪,迪瑞医疗科技股份有限公司生产的CS-1200 全自动生化分析仪。
检测方法:采集所有研究对象的清晨空腹静脉血3 mL,采用WG-XXB-FLJ-I 血液成分分离机,以1 500 r/min,半径10 cm,离心15 min 后取上清液标本,置-20℃冰箱保存待检。采用DxH 500 全自动血细胞分析仪检测Hb 水平,采用CL-2000 全自动化学发光免疫分析仪检测sTfR、SF 水平,采用CS-1200 全自动生化分析仪检测SI、UIBC、TRF 水平。所有检测工作均在血样采集后的2 h 内进行。
贫血程度[6]。轻度:120 g/L≥Hb>90 g/L,中度:90 g/L≥Hb>60 g/L,重度:60 g/L≥Hb>30 g/L。
1.4 观察指标
①对比三组患者的sTfR、SF、SI、UIBC、TRF 水平,研究sTfR、SF、SI、UIBC、TRF 鉴别缺铁性贫血、慢性病贫血与健康人群的价值。②分析sTfR、SF、SI、UIBC、TRF 在不同程度缺铁性贫血患者中的表达水平,并采用Pearson 相关性分析不同贫血程度与sTfR、SF、SI、UIBC、TRF 的相关性,受试者工作特征(ROC)曲线评估sTfR、SF、SI、UIBC、TRF 对缺铁性贫血的诊断效能。
1.5 统计学方法
通过研究获得的数据均采用SPSS 26.0 进行统计分析。患者的sTfR、SF、SI、UIBC、TRF 水平等计量资料以均数±标准差(±s)表示,三组间比较采用单因素方差分析,两两比较采用t检验。采用Pearson 分析不同贫血程度与sTfR、SF、SI、UIBC、TRF 的相关性;采用ROC 曲线评估sTfR、SF、SI、UIBC、TRF 对缺铁性贫血的诊断效能。P<0.05 为差异有统计学意义。
2 结果
2.1 铁代谢指标
sTfR 方面:缺铁性贫血组明显高于慢性病贫血组,而慢性病贫血组明显高于健康对照组,差异有统计学意义(P<0.05)。SF 方面:缺铁性贫血组明显低于健康对照组,而健康对照组明显低于慢性病贫血组,差异有统计学意义(P<0.05)。SI方面:缺铁性贫血组明显低于慢性病贫血组,而慢性病贫血组明显低于健康对照组,差异有统计学意义(P<0.05)。UIBC 方面:缺铁性贫血组明显高于健康对照组,而健康对照组明显高于慢性病贫血组,差异有统计学意义(P<0.05)。TRF 方面:缺铁性贫血组明显高于健康对照组,而健康对照组明显高于慢性病贫血组,差异有统计学意义(P<0.05)。见表1。
表1 三组铁代谢指标比较(n=30,± s)
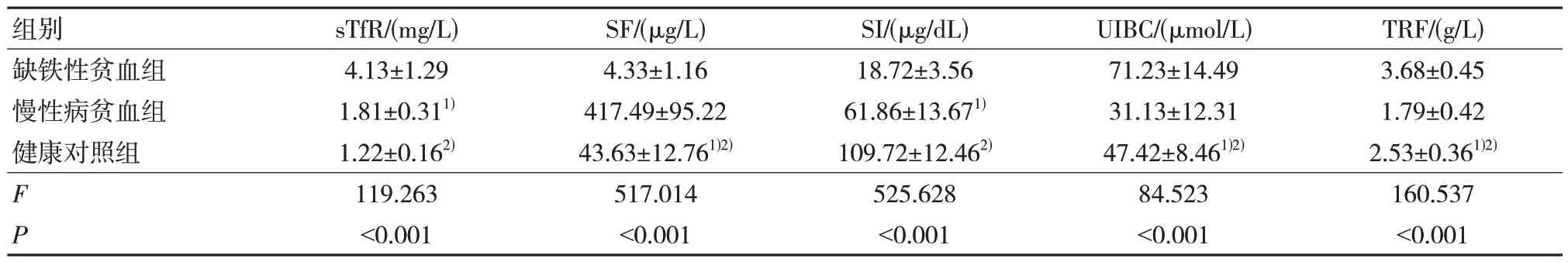
表1 三组铁代谢指标比较(n=30,± s)
注:1)与缺铁性贫血组比较,P<0.05;2)与慢性病贫血组比较,P<0.05。
2.2 不同程度缺铁性贫血的铁代谢指标
经临床确诊,缺铁性贫血组中轻度患者10 例,中度患者14 例,重度患者6 例。sTfR、UIBC、TRF 方面:轻度患者明显低于中度患者,而中度患者明显低于重度患者,差异有统计学意义(P<0.05);SF、SI 方面;轻度患者明显高于中度患者,而中度患者明显高于重度患者,差异有统计学意义(P<0.05)。见表2。
表2 不同程度缺铁性贫血的铁代谢指标比较(± s)

表2 不同程度缺铁性贫血的铁代谢指标比较(± s)
注:1)与轻度比较,P<0.05;2)与中度比较,P<0.05。
2.3 缺铁性贫血患者的Hb 与sTfR、SF、SI、UIBC、TRF 的相关性
Pearson 相关结果显示,缺铁性贫血患者的Hb与SF、SI 呈正相关关系,与sTfR、UIBC、TRF 呈负相关关系(P<0.05)。见表3。

表3 缺铁性贫血患者的Hb 与sTfR、SF、SI、UIBC、TRF 的相关性
2.4 sTfR、SF、SI、UIBC、TRF 对缺铁性贫血的诊断效能
采用sTfR、SF、SI、UIBC、TRF 指标,以缺铁性贫血组为阳性例数,与慢性病贫血组和健康对照组进行对比,绘制ROC 曲线。结果显示,sTfR 的曲线下面积(AUC)为0.857(0.771~0.943),SF 的AUC 为0.779(0.683~0.876),SI 的AUC 为0.745(0.643~0.847),UIBC 的AUC 为0.708(0.580~0.836),TRF 的 AUC 为 0.761(0.662~0.861),联合检测的AUC 为0.968(0.771~0.943),差异有统计学意义(P<0.05),表示通过sTfR、SF、SI、UIBC、TRF 联合检测可有效提高缺铁性贫血患者的诊断效能。见图1、表4。
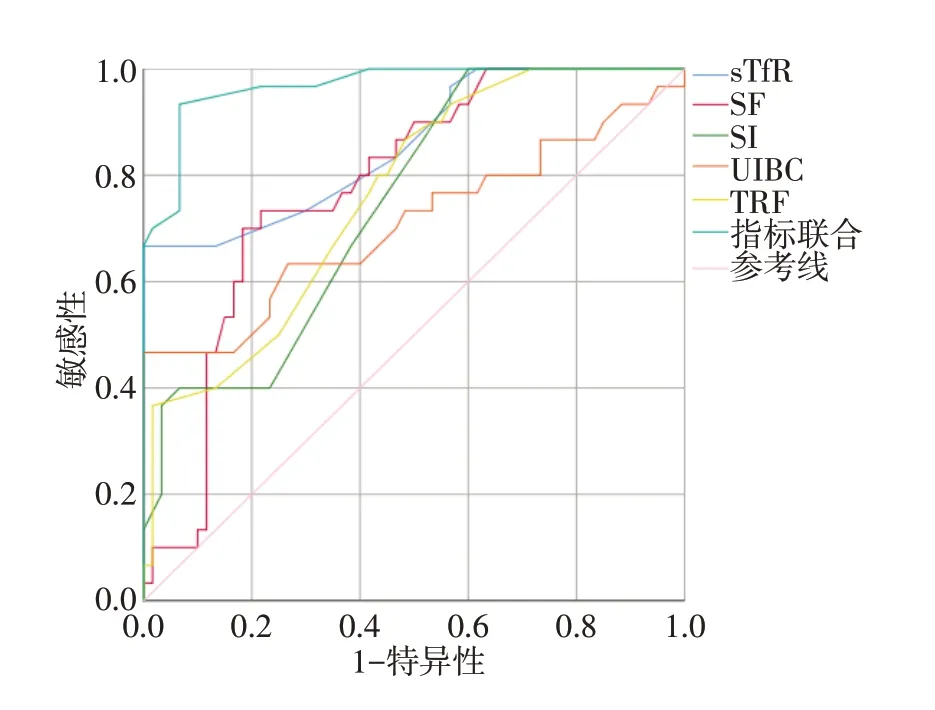
图1 sTfR、SF、SI、UIBC、TRF 指标对缺铁性贫血的诊断效能
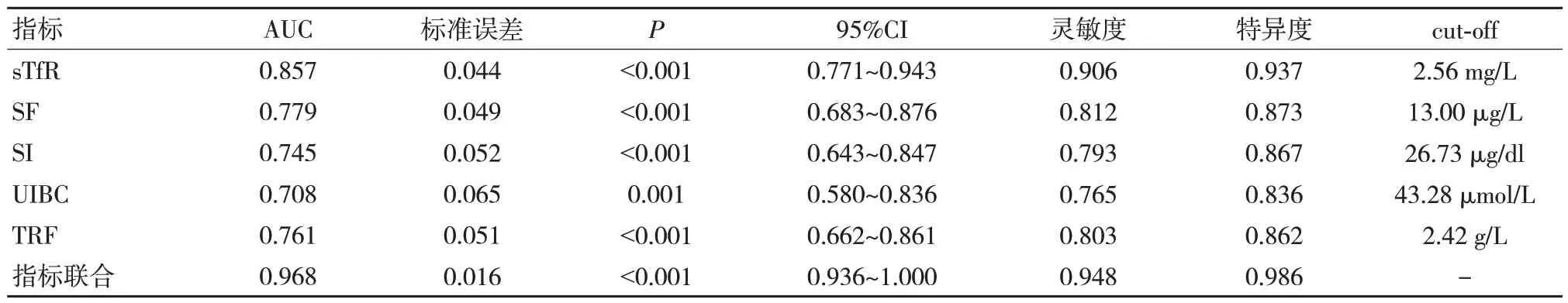
表4 sTfR、SF、SI、UIBC、TRF 对缺铁性贫血的诊断效能
3 讨论
铁元素是维持人体代谢的重要元素,也是Hb的重要组成部分,与机体多个器官、系统的生理功能相关。受铁摄入不足、生理或病理性丢失等影响,人体对铁供需失衡,引起红细胞再生功能障碍,从而产生缺铁性贫血[7]。铁代谢指标是判断缺铁性贫血患者诊治过程较为直接的方式,然而铁代谢紊乱引起的常见疾病中包括缺铁性贫血和慢性病贫血。本研究主要研究sTfR、SF、SI、UIBC 和TRF 等常用铁代谢指标在缺铁性贫血患者中的应用价值。
本研究发现,缺铁性贫血组、慢性病贫血组与健康对照组的sTfR、SF、SI、UIBC 和TRF 水平差异均有统计学意义(P<0.05)。提示可通过检测sTfR、SF、SI、UIBC 和TRF 来鉴别缺铁性贫血、慢性病贫血与健康人群,这与侯立安等[8]的研究结果是一致的,表明sTfR、SF、SI、UIBC 和TRF等常用铁代谢指标在缺铁性贫血、慢性病贫血和健康人群中均有不同程度的改变。本研究还发现,不同程度缺铁性贫血患者的sTfR、SF、SI、UIBC和TRF 水平差异有统计学意义(P<0.05);同时缺铁性贫血患者的Hb 与SF、SI 呈正相关,与sTfR、UIBC、TRF 呈负相关(P<0.05)。提示随着Hb 水平的升高,缺铁性贫血患者的sTfR、SF、SI、UIBC 和TRF 水平也随之变化。临床可根据sTfR、SF、SI、UIBC 和TRF 水平判断缺铁性贫血患者的病情。
sTfR 是转铁蛋白受体(TfR)的截短形式,当机体铁需求增加时,TfR 受体在细胞表面过度表达,导致大量sTfR 进入血液循环,而铁的补充可使sTfR 水平恢复正常水平,故sTfR 水平的升高反映了机体对铁的需求[9-10]。且sTfR 表达无性别差异,不受炎症、肝病等因素影响。结合ROC 曲线中sTfR 的AUC 为0.857,且灵敏度和特异度均较高,提示通过检测sTfR 能更好地用于缺铁性贫血的鉴别诊断,这与徐帆等[11]的研究结果是一致的。正常情况下,SF 可直接反映机体的储存铁。当机体铁含量减少时,可释放SF 供机体所需;而铁含量增加时,SF 可摄入铁,有效避免游离铁的细胞毒作用[12]。但SF 也是一种急性时相反应蛋白,受炎症、肿瘤、营养状态等因素影响较大,从而影响其缺铁的灵敏度和特异度[13]。本研究中,SF 的cut-off 为13.00 μg/L 时,灵敏度与特异度分别为0.812、0.873,其可作为辅助诊断指标。另有相关研究指出,缺铁性贫血时SF 一般<20 μg/L,若SF 在20~100 μg/L 则无法诊断,当SF>100 μg/L则可排除缺铁性贫血[8]。正常情况下,SI 仅与1/3 TRF 结合,而未与铁结合的2/3 TRF 即为UIBC。其中SI 受生理、病理等因素影响较大;UIBC 易受近期铁摄入、感染、昼夜变化等影响;TRF 常用于贫血的诊断和鉴别诊断,其代谢活跃可促进铁吸收及利用,但易受机体营养状况的影响,稳定性差[14-15]。因此,这些指标均不能单独用于早期缺铁性贫血的诊断。结合ROC 曲线显示,SI、UIBC 和TRF 的灵敏度与特异度均低于SF,其可用于辅助诊断缺铁性贫血。
综上所述,sTfR、SF、SI、UIBC、TRF 在缺铁性贫血、慢性病贫血和健康人群中的表达水平均有明显差异,同时各指标受生理或病理因素影响,不能单独用于缺铁性贫血的诊断。因此,应综合多项指标检测,以便为缺铁性贫血患者的早期筛查和诊断提供参考依据。

