不同微生物菌剂对羊角椒生长发育及病害的影响
朱丽, 姬振蒙, 殷敏, 任荣荣, 顾闽峰, 晏军, 费月跃
(江苏沿海地区农业科学研究所新洋试验站, 江苏 盐城 224049)
辣椒 (CapsicumannuumL.) 属一年生或有限多年生草本茄科植物, 是我国主要蔬菜之一, 其栽培面积较大[1]。在实际生产过程中, 园艺学将辣椒分为: 甜椒、牛角椒、羊角椒、线椒、炮椒、朝天椒、螺丝椒、干椒几大类[2]。调查发现, 江苏盐城东部的沿海地区居民以羊角椒种植较多, 普遍喜爱辣味适度、果质鲜亮的鲜食辣椒。随着种植面积不断扩大, 羊角椒已经成为了当地的主要特色产业, 盐东镇已经成立羊角椒现代农业产业示范园,并获得国家地理标志称号, 羊角椒逐步发展成为当地农业结构调整、农业种植模式创新、农民增收的主要作物[3]。但是随着种植年限的增加, 水肥管理不合理, 使得植株病菌残留, 连作障碍发生严重, 羊角椒的产量和品质逐渐下降, 其经济效益大幅削减[4-5]。
目前, 已有多项研究报道, 微生物菌剂对提高作物品质, 增强植株抗病害能力和改善土壤状况均有较好效果, 如吕亮雨等[6]研究发现, 施用木霉菌微生物菌剂能使枸杞的生长状况得到一定改善;朱诗君等[7]试验也表明, 在添加生物有机肥的基础上, 辅以菌剂追施, 可提高土壤肥力, 对草莓生长、产量和果实品质有显著的积极作用。丁钱华[8]也报道称, 将不同的微生物菌剂进行复合施用, 能够达到协同的效果, 很大程度优化小麦病害防治效果。
目前, 微生物菌剂的种类纷杂, 不同微生物菌剂所表达的效果也有所区别, 但调查发现, 市面上以芽孢杆菌类微生物菌剂居多。研究表明, 芽孢杆菌中的多粘类芽孢杆菌有益功能较多, 能起到增强植物的固氮作用、促进植物生长、抑制植物病原菌引起的疾病等多种效应, 该菌种为一种革兰氏阳性芽孢细菌, 属于植物促生长细菌的一个多样化群体, 对植物生长具有有利功效[9]。另外还发现,腐霉菌属也能成为较好的生物制剂, 如寡雄腐霉菌对促进植株生长起到很大作用, 该菌种一般定殖在多种植物根系周围, 菌丝寄生于病原真菌体内, 干扰其新陈代谢, 并争夺养分与生存空间, 造成病菌死亡[10], 以此改善植株生长环境。近年来, 微生物菌剂广泛用于提高作物品质和增强抗病性, 而对羊角椒作物的生理调控未曾有过报道, 尤其多粘类芽孢杆菌和寡雄腐霉菌未曾对比试验过, 因此, 该研究设置多粘类芽孢杆菌和寡雄腐霉菌2 种微生物菌剂在不同浓度下对羊角椒生长抗病的影响, 以期筛选出防病壮苗效果最佳的配施方案, 为羊角椒生长发育提供参考。
1 材料与方法
1.1 试验地概况
试验于江苏省农业科学院沿海现代农业科技创新与示范基地的设施大棚内进行。羊角椒定植于设施大棚的栽培槽内, 槽为15 m×1.2 m, 定植2 行,株距25 cm, 行距50 cm, 每小区面积18 m2, 3 次重复。基 质 栽 培, 基 质 的 pH 值6.8, 电 导 率(EC) 0.8 mS·cm-1, 有机质含量55%, 氮、磷、钾含量1.5%。
1.2 材料
供试羊角椒材料为原野长香, 由昌邑上珠农业发展有限公司提供。供试微生物菌剂有多粘类芽孢杆菌, 由山西省临猗中晋化工有限公司提供, 有效成分含量: 50 亿CFU·g-1, 剂型: 可湿性粉剂;寡雄腐霉菌, 由捷克生物制剂股份有限公司提供,有效成分含量: 100 万孢子·g-1, 剂型: 可湿性粉剂。
1.3 试验方法
试验方法如表1 所示, 不同微生物菌剂进行不同浓度配施, 分别于现蕾期 (定植后29 d)、果实膨大期 (定植后48 d) 和果实始收期 (定植后78 d) 对羊角椒植株进行灌根。肥水同常规管理。
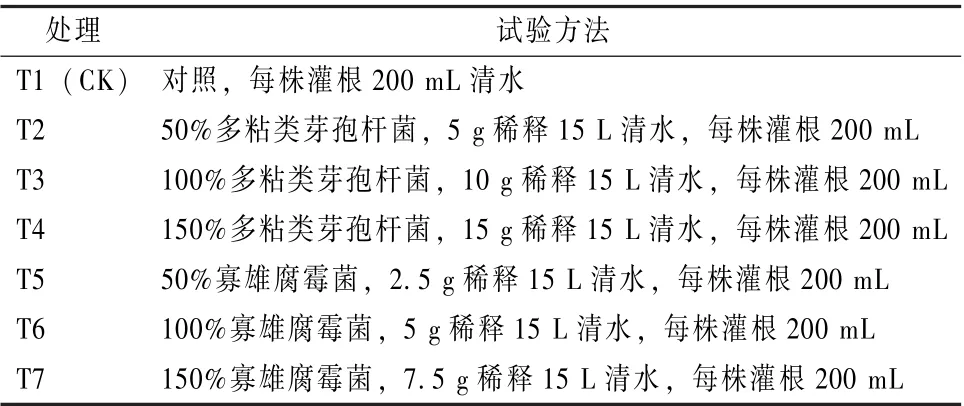
表1 不同微生物菌剂对羊角椒的处理方法
1.4 项目测定
1.4.1 羊角椒植株性状的测定
每次灌根后7 d 进行植株性状调查。每个小区随机标记10 株羊角椒植株, 分别在现蕾期、果实膨大期、果实始收期测定株高、叶长、叶宽、茎粗、叶绿素相对含量 (SPAD) 值和株幅; 于羊角椒成熟期调查植株始花节位和有效分枝数; 并在羊角椒生长周期内对植株发病情况进行统计。
1.4.2 羊角椒果实性状的测定
在果实始收期开始调查果实性状。每个小区随机选取10 颗大小基本一致的羊角椒果实, 测定果纵径、果横径、果肉厚、鲜柱中心柱长和单果重。
1.4.3 产量统计
每个小区随机选取10 株羊角椒。从果实始收期每隔14 d 采收一次果实成熟度一致的羊角椒,统计各次单株结果数和产量, 最终汇总, 并根据定植密度和面积计算产量。
1.5 数据分析
用Excel 2016 软件整理数据和作图, 使用SPSS 21.0 软件对相关数据进行单因素方差分析和相关性分析。
隶属函数值计算方式如下:
Ri为第i个测定指标的隶属函数值,Xi为第i个指标测定值,Xmin和Xmax分别为第i个测定指标的最小值和最大值。当某一性状指标与羊角椒生长指标正相关时用公式 (1) 计算, 反之用公式 (2)计算[11]。
2 结果与分析
2.1 不同处理对羊角椒植株性状的影响
2.1.1 微生物菌剂对羊角椒不同时期的株高和株幅的影响
如图1 所示, 微生物菌剂处理后的羊角椒株高和株幅在不同时期表现出不同差异。现蕾期、果实膨大期和果实始收期3 个时期中, T5、T6 和T7 的株高表现较佳, 三者较T1 (CK) 均有不同的增长趋势。现蕾期时, T5、T6 和T7 的株高高于T1(CK), 并存在显著差异; 果实膨大期时, T7 的株高显著高于T1 (CK), 也显著高于T2、T3、T4 和T5; 而果实始收期时, T5、T6 和T7 的株高与T1(CK) 均达到显著差异水平, 呈上升趋势。
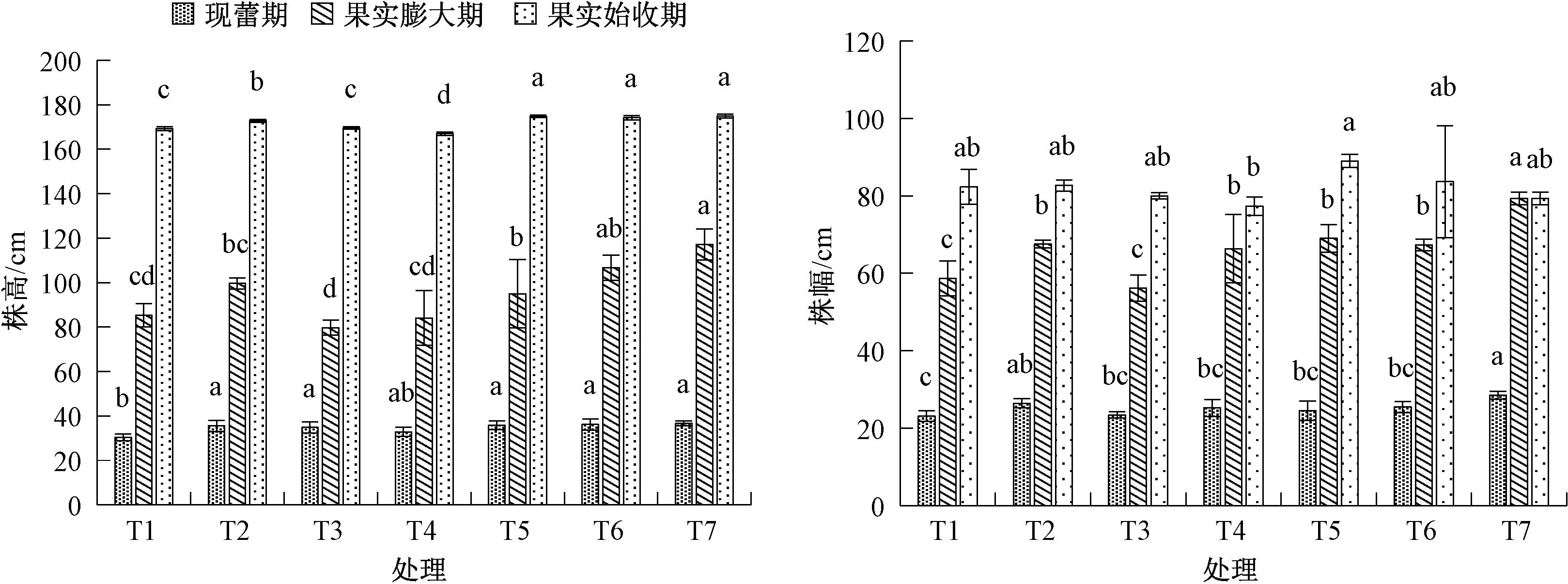
图1 微生物菌剂对羊角椒不同时期的株高和株幅的影响
而在调查植株株幅时发现, 现蕾期, T7 的株幅显著高于T1 (CK), 也显著高于除T2 外的其他处理; 果实膨大期时, T7 的株幅高于其他处理,差异显著; 而果实始收期时, T6、T7 与各处理间的株幅差异不显著。
2.1.2 微生物菌剂对羊角椒不同时期的叶长、叶宽和茎粗的影响
如图2 所示, 微生物菌剂对羊角椒的叶片大小也有着不同的影响。现蕾期时, T7 的叶长、叶宽较其他处理显著增大; 果实膨大期时, T2、T6、T7 的叶长显著高于T1 (CK), 且T6、T7 的叶宽显著高于其他处理; 果实始收期时, T6、T7 的叶长和叶宽与其他处理相比有显著差异变化, 均较T1 (CK) 显著增长。
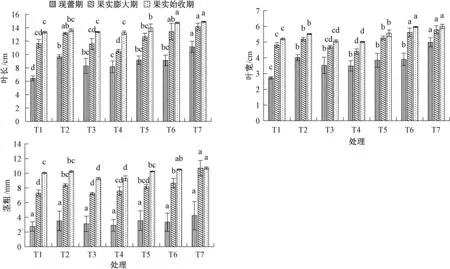
图2 微生物菌剂对羊角椒不同时期的叶长、叶宽和茎粗的影响
由图2 得知, 羊角椒植株的茎粗随着不同微生物菌剂处理后也发生了不同的变化。现蕾期时, 各处理之间均差异不显著; 果实膨大期时, T6、T7的茎粗显著高于T1 (CK), 并且T7 的茎粗也显著高于其他处理, 差异变化明显; 果实始收期时,T7 的茎粗也较其他处理增加, 除T6 外均达到显著差异水平。
2.1.3 微生物菌剂对羊角椒不同时期的SPAD 值的影响
通过植株叶片的SPAD 值的含量检测可以推断出叶绿素含量的变化趋势。通过调查发现 (图3),现蕾期时, T5 和 T7 的 SPAD 值显著高于 T1(CK), 且T7 的SPAD 值最大, 与其他处理均存在显著差异; 果实膨大期时, T6 和T7 的SPAD 值显著高于其他处理; 果实始收期时, T5、T6 和T7 的SPAD 值均显著高于T2、T3 和T4, 并且较T1(CK) 显著增加。
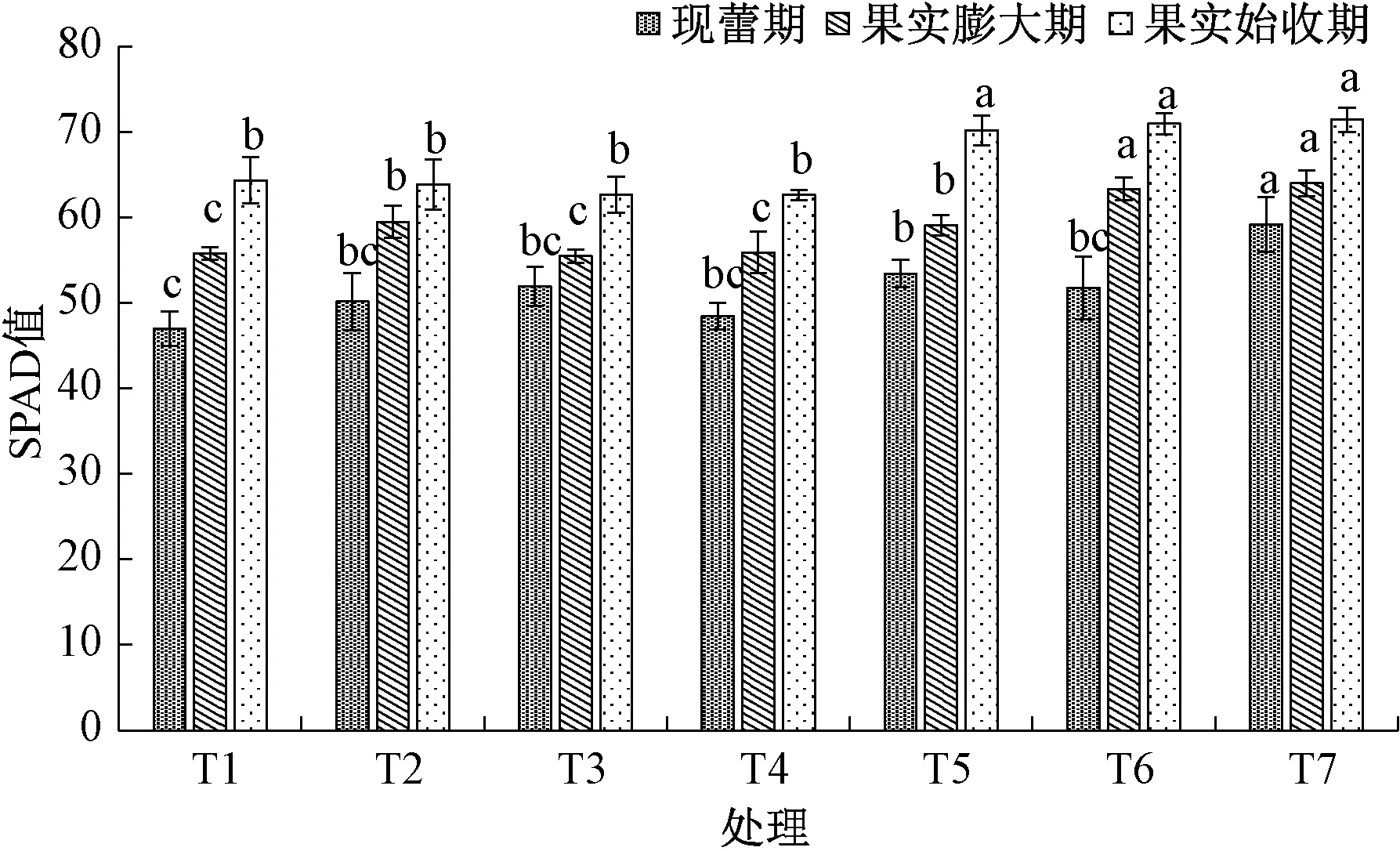
图3 微生物菌剂对羊角椒不同时期的SPAD 值的影响
2.1.4 微生物菌剂对羊角椒始花节位、有效分枝数和发病情况的影响
辣椒是茄科重要经济作物, 具有合轴分枝结构。始花节位是辣椒的重要熟性性状, 与辣椒采收期和早期产量显著相关。调查发现 (图4), 不同微生物菌剂处理后的植株始花节位存在不同变化,除T6 以外的其他处理的始花节位均显著低于T1(CK), 始花节位低的辣椒往往开花坐果早, 在秋茬种植中规避后期低温环境, 减少设施栽培能耗,提高产量。有效分枝数也能代表着生果实的能力,结果 (图4) 表明, T6 的有效分枝数稍佳, 但与其他处理无显著差异变化。
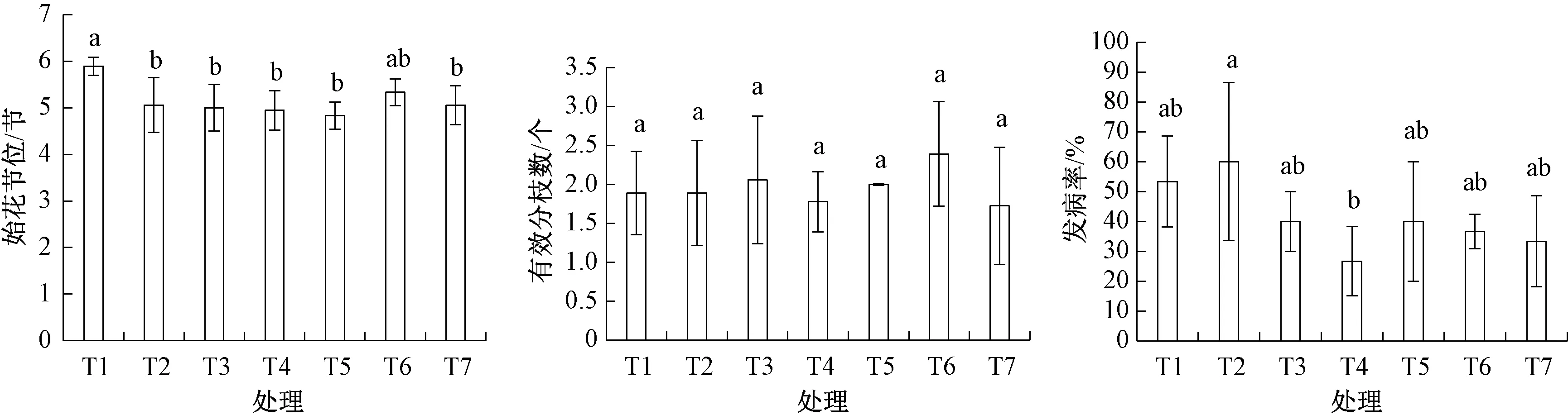
图4 微生物菌剂对羊角椒始花节位、有效分枝数和发病情况的影响
同时, 本研究还针对羊角椒的发病情况进行了调查 (图4), 结果发现, 主要以炭疽病和白斑病害居多, 2 者均为病菌感染, 炭疽病发生后叶面呈枯斑状, 白斑病则导致叶面出现白色斑点。不同处理后的植株发病率存在一定差异, T2 的发病率最高, T4 的发病率最低, 而T5、T6、T7 的发病率相较T1 (CK) 有所降低, 但差异不显著。
2.2 不同处理对羊角椒果实性状的影响
由表2 得知, 微生物菌剂对羊角椒果实性状也产生了不同的影响。在果实纵径方面, T5 和T6 较T1 (CK) 增加, 其中T5 的果实纵径较T1 (CK)提高了11.45%。在果实横径方面, T6 和T7 表现较佳, 其中T6 的果实横径较T1 (CK) 提高了17.22%。在单果重方面, T6 表现最佳, T6 的单果重较T1 (CK) 提高了42.03%, 均与T1 (CK) 达到显著差异水平。同时还调查了羊角椒的果肉厚和鲜椒中心柱长度, 结果表明, T7 的果肉厚度显著高于其他处理, 并且 T7 较 T1 (CK) 提高了33.16%; 而鲜椒中心柱长度以T5 最佳, 较T1(CK) 显著提高9.02%。
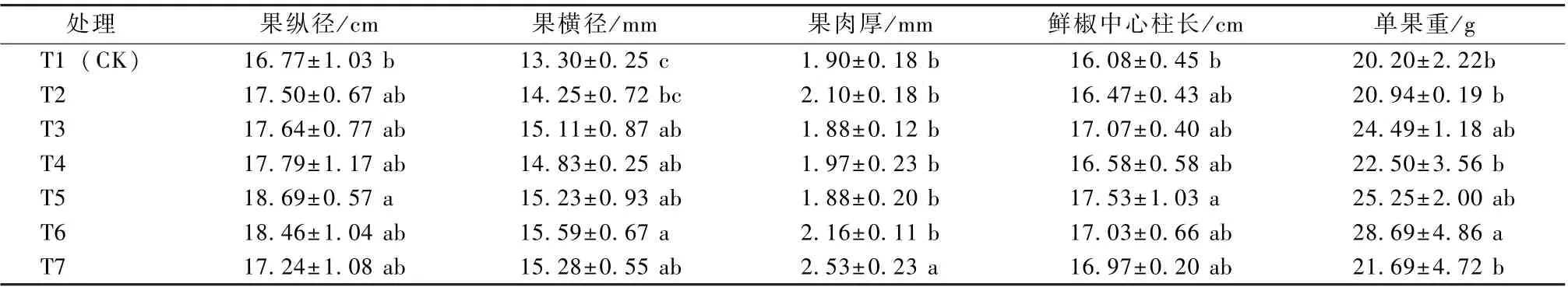
表2 微生物菌剂对羊角椒果实性状的影响
2.3 不同处理对羊角椒产量性状的影响
由表3 可知, 羊角椒产量性状通过不同微生物菌剂处理后也发生了变化。由调查的单株产量的结果分析得出, T6 和T7 的单株产量较T1 (CK) 分别增加47.37%和5.26%, 且T6 的单株产量还显著高于其他处理。在单株果数中, T6 也表现最佳,较T1 (CK) 提高8.98%, 但无显著差异, 但T6与T3、T4 和T5 比较有显著增加。通过产量折合计算, T6 的羊角椒产量最高, 较T1 (CK) 显著提高37.93%, T6 的产值也为最高, 每667 m2较T1 (CK) 增加了1 131.52 元, 产量和产值均位列第一。
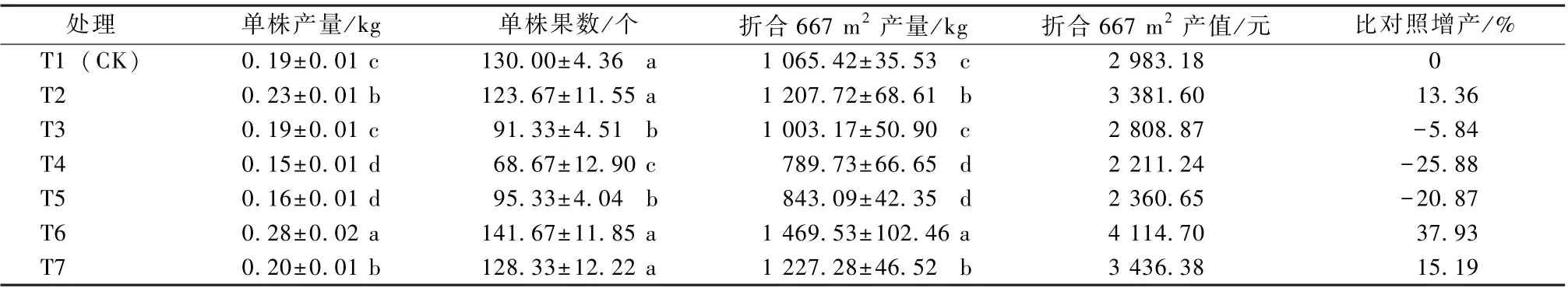
表3 微生物菌剂对羊角椒产量性状的影响
2.4 相关性分析
由表4 可以看出, 不同微生物菌剂处理的羊角椒, 其生长指标间的相关性存在着一定的差异。灌施不同微生物菌剂后, 羊角椒的株高与叶长、茎粗、SPAD 值呈现显著正相关, 与叶宽呈极显著正相关, 仅与始花节位呈负相关, 但无显著相关性。叶长与叶宽、SPAD 值呈极显著正相关, 与茎粗、果肉厚呈显著正相关, 除此之外与其他指标相关性不大。另外叶宽与茎粗、SPAD 值呈极显著正相关, 与果肉厚呈显著正相关。茎粗仅与SPAD 值、单株果数呈显著正相关, 与其他指标相关性不显著。有效分枝数与单果重呈极显著正相关, 果纵径和果横径二者皆与鲜椒中心柱长和单果重呈显著正相关。分析折合后667 m2产量指标中发现, 667 m2产量与单株产量、单株果数呈极显著正相关, 与其他生长性状无显著相关性。单株产量与单株果数也呈极显著正相关。
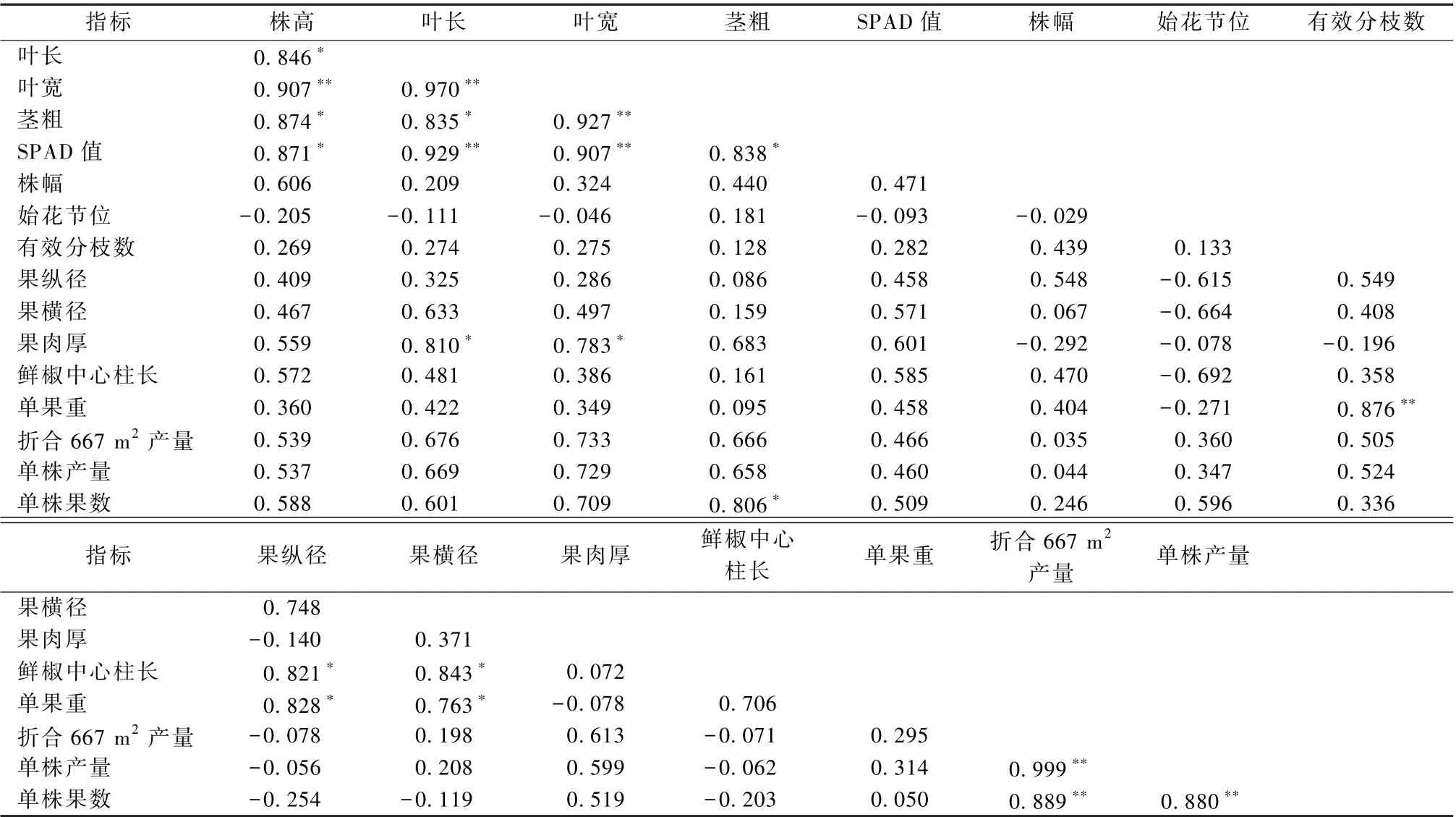
表4 微生物菌剂处理下羊角椒生长指标间的相关性分析
2.5 隶属函数分析
基质土壤中添加微生物菌剂, 单个指标未能全面反映不同处理对羊角椒生长发育的影响。为综合评价不同处理对羊角椒的影响差异, 利用模糊数学的隶属度理论, 计算出不同处理下各指标隶属值(表5), 经综合比较, 总隶属函数值越大表明影响越好。由表5 得知, 各处理的隶属函数值与T1(CK) 的差异各异, T2、T3、T4 和T5 的隶属函数总加权值较T1 (CK) 均降低, 尤其T2 数值最小,T2 较T1 (CK) 减少0.89。而T6 和T7 表现较佳,2 者的隶属函数总加权值均高于T1 (CK), T6 的数值较T1 (CK) 增加0.64, T7 的数值较T1(CK) 增加0.55。促进改善羊角椒生长发育的处理效果表现从高到低的顺序为T6、T7、T1 (CK)、T5、T4、T3、T2。由此可知, T6 和T7 处理后的羊角椒生长发育指标均表现良好, 但以T6 最佳。
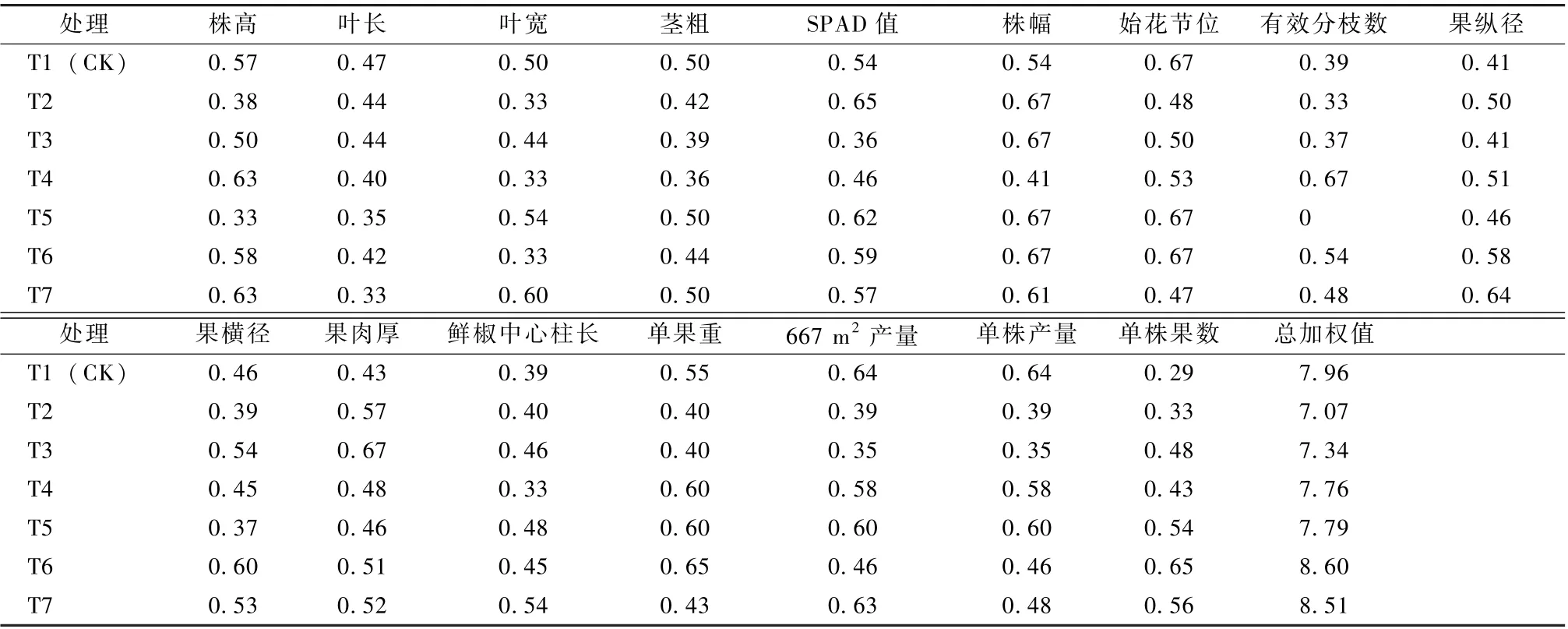
表5 微生物菌剂处理下羊角椒生长指标间的隶属函数分析
3 讨论
微生物菌剂内含有大量有益微生物菌群, 通过菌群活化土壤活性酶、分解有机质及多种微量元素, 对改良土壤、增加产量、提高品质具有有效作用。目前, 市场中微生物菌剂种类繁多, 功能表达不一, 施用于作物上, 其长势、产量和品质也受到了不同影响[12]。
本研究发现, 施用适量的寡雄腐霉菌微生物菌剂后能明显改善羊角椒植株的生长形态, 在不同生长周期表现出不同的增长趋势。羊角椒现蕾期、果实膨大期和果实始收期3 个时期中, 3 种不同浓度的寡雄腐霉菌 (T5、T6、T7) 处理后的羊角椒株高、株幅、叶长、叶宽和茎粗均有不同程度的增加, T7 在现蕾期和果实膨大期的株高和株幅均居最佳, 尤其叶长、叶宽和茎粗在3 个时期中均为最高, 植株形态优良, 长势宜人。寡雄腐霉菌作为一种有益微生物菌, 是自然界中存在的一种攻击性很强的寄生真菌, 能定殖在农作物根围[13], 分泌多种植物激素和多种胞外酶[14], 植物激素改善植物生理代谢, 进一步促进生长发育, 其胞外酶分解土壤有机质, 促进植物吸收[15], 研究结果与这一理论相互对应。同时, 还对不同时期的羊角椒叶片的SPAD 值进行了检测, 相关资料表明, SPAD 值与叶片的叶绿素含量具有良好的一致性[16], 通过SPAD 值可推断相应的光合作用效应。通过SPAD值结果分析可知, 在不同生长时期内, T5、T6 和T7 相比T1 (CK) 均有不同程度提高, T7 叶片的SPAD 值在3 个阶段均居最高, 光合作用也应有所加强, T7 植株长势良好, 这与前人研究结果相呼应[17]。始花节位是辣椒的重要熟性性状, 与辣椒采收期和早期产量显著相关[18], 有效分枝数也是判断产量的指标之一。研究结果表明, T6 和T7 的始花节位均较T1 (CK) 一定程度减少, 而T6 的有效分枝数却相比T1 (CK) 有所增加, 始花节位少则开花结果早, 采收期能有效提前, 避免早期病害雨水的干扰, 促进早期产量的增加, 而有效分枝数多则着生果实的能力强, 也是提高产量的主要标志。同时还调查了羊角椒整个生长周期的发病情况, T6、T7 的发病率也较CK 有所降低, 二者的防病效果均表现较佳, 这一结果与前人研究结果相似[19]。
本研究还对羊角椒的果实性状和产量指标开展了进一步的调查和分析。结果发现, 在果实性状方面, T5、T6、T7 的羊角椒果横径、果纵径、鲜椒中心柱长和单果重较T1 (CK) 均有不同程度的增加, T5 的羊角椒果纵径和鲜椒中心柱长在所有处理中表现最佳, 较T1 (CK) 显著提高, 推断T5对羊角椒果实的影响为果实细长。T6 的羊角椒果横径和单果重居于最高, 其果实粗壮效果最明显,经济效益高。而T7 的羊角椒果肉厚度则表现出较大幅度的增加, 与T1 (CK) 差异明显, 有利于运输贮藏, 商品性高。在测定的产量方面, T6 的单株产量和折合667 m2产量均显著高于T1 (CK)以及其他处理, 其667 m2产值也大幅升高, 位居第一, 这与前人研究报道一致[20]。
通过对各项指标进行相关性分析和隶属函数分析得出, 株高与叶长、叶宽、茎粗以及SPAD 值呈显著正相关, 由此可以通过微生物菌剂来调节土壤孔隙、提高酶活性, 分解有机物, 促进根部营养吸收, 茎部粗壮, 叶绿素含量提高, 以此增强光合作用, 提高羊角椒的株高长势。同时, 还发现667 m2产量与单株果数呈极显著正相关, 推断施加微生物菌剂对单果重的影响较小, 作用主要表现在刺激果实着生点的数量性状方面。经隶属函数对各处理进行综合评价后发现, T6 对促进羊角椒植株长势和增加产量的效果更为突出, 优于T1(CK) 和T7, 因此, 可以判断适量的寡雄腐霉菌可有效改善羊角椒的生长发育。
综上所述, 施用不同浓度的微生物菌剂对羊角椒生长发育有不同程度的影响, 但综合分析可得,T6 (100%寡雄腐霉菌) 和T7 (150%寡雄腐霉菌)的防病壮苗、提高产量的作用效果均表现突出, 其中以T6 的促进改善效果最佳。本次试验还有不足之处, 微生物菌剂为活性生物, 对微生物菌剂的最适生存条件未进行调整和探讨, 可在后续试验中进行补充添加。

