临床分离气单胞菌喹诺酮类的耐药机制研究*
赵高余,程敬伟,周妍妍
(首都医科大学附属北京友谊医院临床检验中心,北京 100050)
气单胞菌(Aeromonasspp.)属于弧菌科革兰阴性杆菌,广泛分布于环境中,对人类和水栖动物、鱼类均可致病,包含至少39个种,其中嗜水气单胞菌、达卡气单胞、豚鼠气单胞菌和维氏气单胞菌致病性较强,易引起人类肠道感染,近年来已经成为引起腹泻的主要病原菌之一。如果治疗不当,可以导致败血症[1]。
目前治疗气单胞菌属引起的腹泻首选喹诺酮类药物。主要包括第一代喹诺酮类药物萘啶酸(nalidixic, NAL)和第二代喹诺酮药物如环丙沙星(ciprofloxacin, CIP),但有学者报道临床分离株对上述药物出现了不同程度的耐药[2]。耐药机制主要由染色体上喹诺酮类耐药决定区(quinolone-resistance deter mining regions,QRDR)介导[3]和由质粒上喹诺酮耐药基因介导(plasmid-mediated quinolone resistance,PMQR)介导[4-8]。本研究旨在通过对临床腹泻患者的分离株进行相关研究,探讨分离自腹泻患者的气单胞菌属细菌的药物敏感性特点和氟喹诺酮类药物的耐药机制,以期为临床合理选用抗生素治疗气单胞菌提供实验室依据和参考。
1 材料与方法
1.1菌株来源 收集2017年4月至10月北京友谊医院住院患者和肠道门诊腹泻患者分离的气单胞菌111株。经多基因串联系统进化分析分型方法(multilocus phylogenetic analysis, MLPA)[9]将气单胞菌鉴定为维氏气单胞菌(A.veronii)36株、豚鼠气单胞菌(A.caviae)47株、嗜水气单胞菌(A.hydrophila)5株、A.aquariorum16株、肠棕气单胞菌(A.enteropelogenes)2株、中间气单胞菌(A.media)2株、圣雷利气单胞菌(A.sanarellii)2株以及双壳类气单胞菌(A.bivalvium)1株[10]。
1.2仪器与试剂 Sensititre革兰阴性菌药敏板(美国Thermo Scientific公司),哥伦比亚血平板琼脂(美国Oxoid公司),细菌基因组DNA提取试剂盒及PCR试剂(北京天根生化科技公司)。DNA Engine Dyad PCR基因扩增仪、GELDoc2000凝胶成像系统(美国Bio-Rad公司),PCR引物合成及PCR产物测序由上海生工生物技术公司完成。
1.3药敏试验 按照药敏试剂说明书操作, 先用无菌脱脂棉签挑选气单胞菌菌落于生理盐水中研磨均匀并调至0.5麦氏浊度,再将50 μL菌悬液接种于11 mL CAMHT肉汤中,取100 μL肉汤悬液加至药敏板中,CIP浓度梯度为0.032 μg/mL、0.064 μg/mL、0.128 μg/mL、0.25 μg/mL、0.5 μg/mL、1 μg/mL、2 μg/mL和4 μg/mL,NAL浓度梯度为1 μg/mL、2 μg/mL、4 μg/mL、8 μg/mL、16 μg/mL和32 μg/mL。药敏结果判断标准参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)M45文件,以CIP MIC<1 mg/mL时敏感,MIC=2 mg/mL时中介,MIC≥4 mg/mL时耐药,NAL MIC>32 mg/mL时耐药。根据气单胞菌对NAL和CIP的耐药情况,将111株菌分为耐NAL-CIP、CIP敏感NAL耐药和NAL-CIP敏感3个类别。
1.4DNA提取及PCR反应 按照细菌基因组DNA提取试剂盒说明书提取气单胞菌基因组DNA,紫外分光光度计测定A260 nm、A280 nm和A310 nm,根据公式dsDNA=50×(A260 nm-A310 nm)×稀释倍数(ng/μL)计算核酸浓度,以A260 nm/A280 nm>1.8,核酸浓度大于50 ng/μL为合格。核酸标本置于-20 ℃保存。气单胞菌的耐药基因[gyrA,gyrB,parC,parE,qnrA,qnrB,qnrVC,QnrS,aac(6′)-Ib-cr,qepA]的扩增引物序列和参考文献见表1,其中gyrA,gyrB,parE,qepA基因的引物由NCBI primer designing tool软件设计。PCR反应体系:EmeraldAmp MAX PCR Master Mix 25 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板1 μL,ddH2O 22 μL。扩增条件:94 ℃预变性4 min;94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸40 s,30个循环;72 ℃ 5 min。经10 g/L琼脂糖凝胶成像系统成像后,阳性扩增产物送至上海生工生物工程公司经ABI 3730XL测序仪对gyrA,gyrB,parC,parE,QnrS,aac(6′)-Ib-cr基因进行Sanger法正、反测序,删除测序产物前后各50个bp,使用Chromas1.0.0.1软件对产物进行拼接,使用CLC Sequence Viewer 6软件对转化成的氨基酸片段进行比对。其中Gap open cost 设为10.0,gap extension cost设为1.0。
2 结果
2.1气单胞菌菌株耐药表型分析 111株菌中,CIP耐药率为6.3%(7/111),敏感率为93.7%(104/111);NAL耐药率为55.0%(61/111),敏感率为45.0%(50/111)。111株菌中,7株对NAL-CIP耐药,54株对CIP敏感、对NAL耐药,50株对CIP和NAL都敏感。
2.2QRDR突变位点与耐药表型分析 部分基因的测序图谱见图1,基因突变结果见表2,部分氨基酸比对见图2。50株NAL-CIP敏感株均未发生QRDR突变。54株NAL耐药CIP敏感的菌株中,gyrA基因第83位丝氨酸(Ser)均发生突变,其中A.hydrophila(5株),A.aquariorum(11株)和A.sanarellii(1株)突变为异亮氨酸(Ile);A.caviae有95%(25/26)突变为Ile,1株突变为精氨酸(Arg);15株A.veronii突变为Ile或缬氨酸(Val)。在耐NAL-CIP的7株气单胞菌(包括4株A.hydrophila和3株A.caviae)中,除了gyrA基因第83位点突变为Ile外,parC基因第87位还由Ser突变为Ile。而在CIP敏感株中,只有0.058%(6/104)同时存在gyrA基因Ser83Ile/Val突变和parC基因Ser87Ile/Tyr突变。

图2 gyrA氨基酸部分比对图
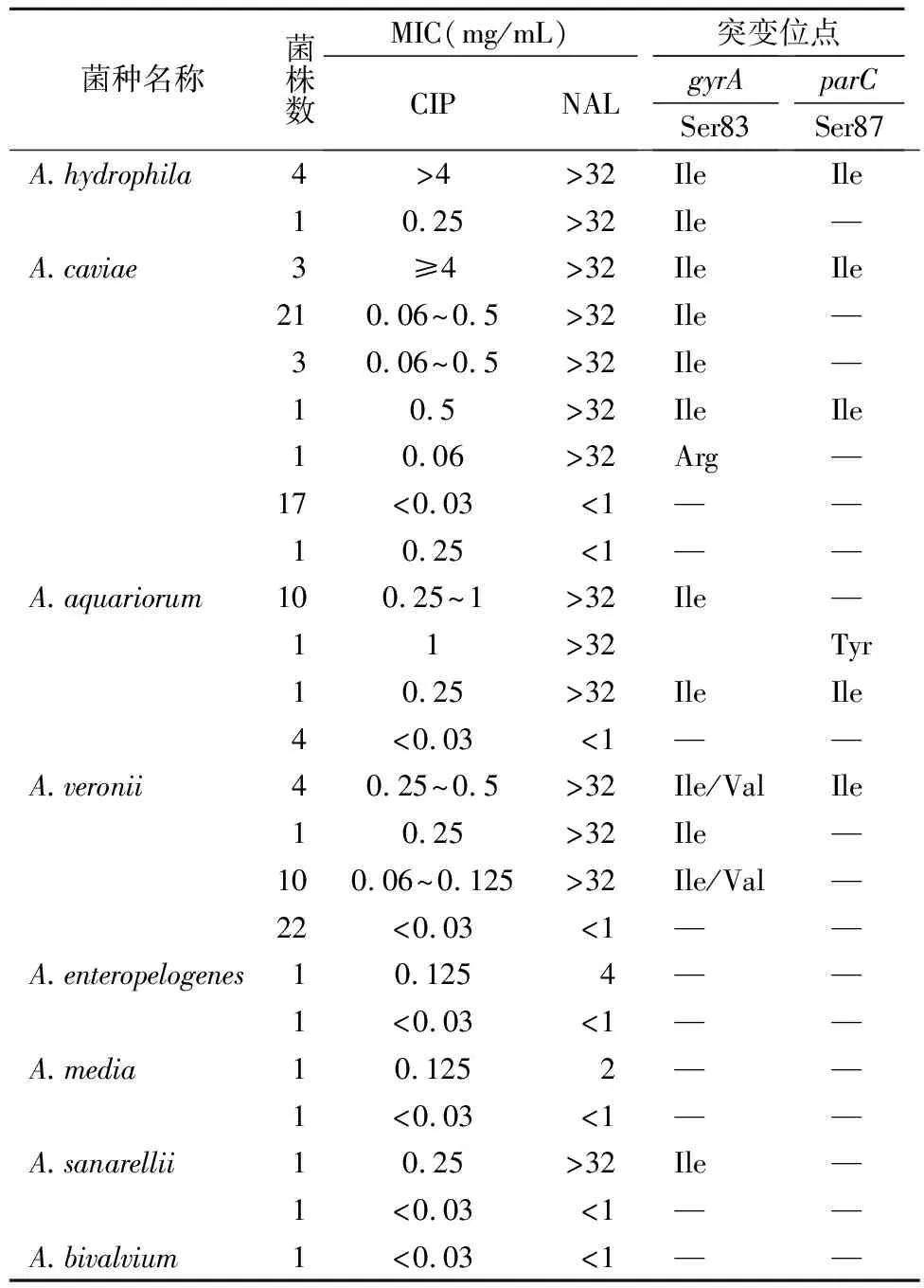
表2 气单胞菌QRDR突变位点和耐药表型的对比分析
2.3PMQR的检出情况 共检出8株菌携带QnrS基因,其中4株菌耐药表型为NAL-CIP。耐NAL-CIP中,QnrS阳性菌株占4/7。7株菌携带aac(6′)-Ib-cr基因,其中6株菌耐药表型为NAL-CIP。耐NAL-CIP中,aac(6′)-Ib-cr阳性菌株占6/7。对CIP敏感NAL耐药的54株菌中,菌株BJ065 检出QnrS基因,菌株BJ088检出aac(6′)-Ib-cr基因。2株菌的喹诺酮耐药水平与同类别其他菌株相同,未见升高。对CIP-NAL敏感的50株菌中,3株检出QnrS基因,3株菌喹诺酮耐药性均较其他CIP-NAL敏感菌强,且耐药性提升了4~8倍。见表3。
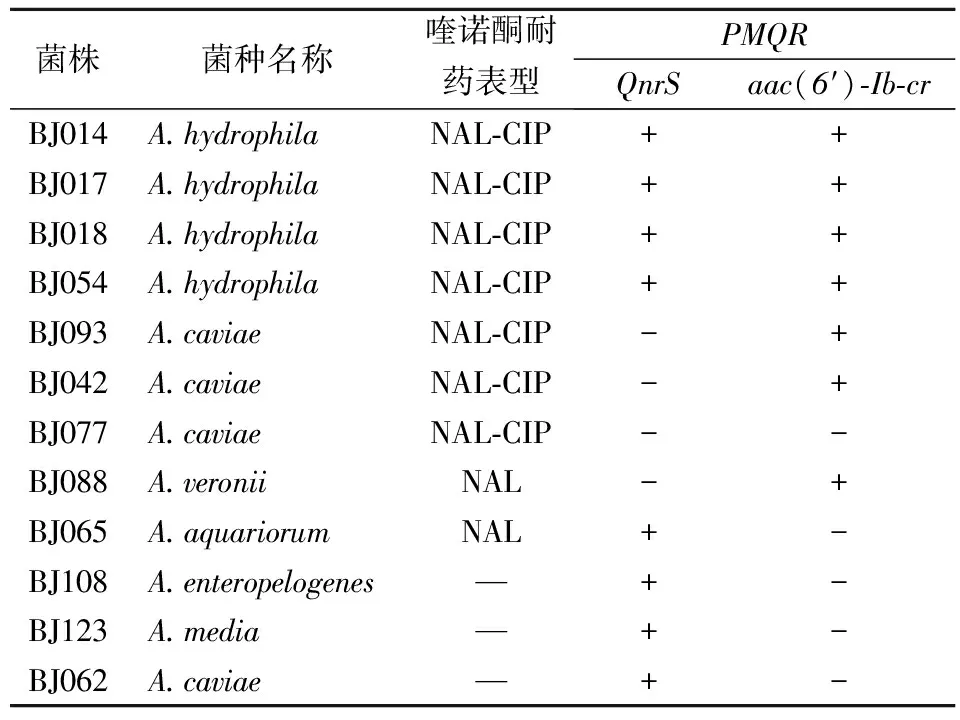
表3 气单胞菌PMQR检出情况和菌株耐药表型对比分析
3 讨论
气单胞菌喹诺酮耐药在世界范围内广泛存在,对现代感染医学是个潜在的威胁,有必要对其加强监测分析[16]。国内外对不同环境中分离的气单胞菌研究发现,气单胞菌产生喹诺酮耐药的机制主要为喹诺酮作用靶位改变以及不同PMQR基因的流行,QRDR与PMQR对喹诺酮耐药具有相加性或协同性[17-20]。
QRDR突变主要位于gyrA亚基和parC亚基末端,这些突变改变了喹诺酮药物的结合部位,从而降低了喹诺酮药物敏感性[21]。Shakir等[22]发现gyrA亚基上的Ser83Ile/Val和Leu92Met,且证实联合parC亚基上Ser80Ile/Phe定点突变对气单胞菌高水平耐药起到关键作用。本研究中gyrA发生Ser83Ile/Arg/Val突变导致了菌株对NAL耐药,与以往研究[22]不同,本次试验中所有菌株gyrA的第92位都是Met,提示gyrA的Ser83Ile/Arg/Val对NAL耐药起到关键作用。耐NAL-CIP菌株最常见的突变残基是gyrA/parC亚基上的Ser和Asp/Glu[23],而本次研究中,耐NAL-CIP菌株突变残基均为gyrA/parC亚基上的Ser。对NAL和CIP敏感的50株菌中,3株菌检出QnrS,其耐药性提升了4~8倍,表明QnrS单独作用可以轻微提高菌株的喹诺酮耐药性。对NAL-CIP耐药的7株菌中,6株菌检出至少一种PMQR。基于以上结果,推测在气单胞菌中,gyrA的第83位Ser突变可使菌株对NAL耐药,对CIP敏感性下降,进一步结合parC的第87位由Ser突变位为Ile,其累积突变联合PMQR可诱导菌株对CIP产生耐药。
QnrS和acc(6)-Ib-cr在世界各地均有分布,不同地区不同来源检出率不尽相同。从我国数据看,QnrS在动物源的菌株中检出率高,从临床标本中检出率略低,如在猪源沙门氏菌株中检出率高达89.7%[24],在兔源的大肠埃希菌株中QnrS检出高达50%以上[25],而在绍兴市某医院患者分离大肠埃希菌中检出率为1.6%[26],北京肠道门诊分离沙门菌中检出率为23.7%[27]。本研究中气单胞菌QnrS携带率为7.2%,acc(6)-Ib-cr携带率为6.3%,与其他研究基本一致。
本研究结果显示PMQR单独作用和gyrA亚基的Ser83突变可使气单胞菌对喹诺酮低水平耐药,气单胞菌实现喹诺酮高水平耐药主要依赖gyrA亚基的Ser83Ile/Arg/Val和parC亚基的Ser87Ile定点突变联合PMQR共同作用。本次研究受样本数量及种群分布的影响,研究结果有一定的局限性。后续研究笔者会进一步扩充临床样本进行深入研究,希望能得到关于气单胞菌属的重要种水平细菌的药物敏感性和喹诺酮类药物耐药机制更为详实的数据,为临床诊治气单胞菌相关性腹泻提供实验依据。

