抗磷脂综合征中非标准抗磷脂抗体的诊断价值和风险预测
白伊娜,孟菁菁,赵久良,李梦涛,曾小峰,胡朝军
作者单位:100730 北京,中国医学科学院 北京协和医学院,北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,疑难重症及罕见病国家重点实验室,国家皮肤与免疫疾病临床医学研究中心(白伊娜、赵久良、李梦涛、曾小峰、胡朝军);450000 郑州,郑州大学第五附属医院检验科(孟菁菁)
抗磷脂综合征(antiphospholipid syndrome,APS)是一种罕见的、复杂的自身免疫性疾病,主要以动/静脉或微血管血栓形成和/或病态妊娠为主要临床表现。部分患者表现为抗磷脂抗体(antiphospholipid antibodies,aPLs)持续阳性所导致的非血栓性临床表现,如血小板减少症、溶血性贫血、网状青斑、心脏瓣膜病或神经系统病变(偏头痛、癫痫、舞蹈症)等[1-2]。aPLs作为APS的特征性标志物已被纳入其分类诊断标准(2006年悉尼标准),实验室诊断指标为狼疮抗凝物(lupus anticoagulant,LAC),抗心磷脂抗体(anticardiolipin antibodies,aCL)IgG/M和/或抗β2糖蛋白I抗体(anti-beta 2 glycoprotein I,aβ2GPI)IgG/M,至少两次且间隔至少12周的中高滴度阳性[3]。随着对APS的不断深入研究,目前的标准aPLs在诊断APS方面存在一定的局限性,如LAC检测的影响因素较多;aCL敏感性高但特异性相对较低且易导致假阳性;aβ2GPI具有较高特异性,但敏感性较低[4];同时也无法解释血清阴性APS(seronegative APS,SNAPS),即临床表现高度提示APS,但标准aPLs持续阴性[5]。aPLs是一组异质性自身抗体,能够与细胞(血小板、内皮细胞、单核细胞、成纤维细胞和滋养层细胞)所表达的磷脂和质膜蛋白结合,导致血栓前状态[6-7]。尽管aPLs在APS发病机制中的作用已被广泛接受,但aPLs持续存在与孤立的临床不良事件之间的不一致性仍然是研究重点。非标准aPLs检测不仅有助于提高诊断APS的能力,发现易漏诊、误诊的血清学阴性或非标准表现的APS患者,还有助于了解疾病的机制、评估相关临床表现,以及后续治疗管理、疾病的预后和评估[8-10]。
目前对于非标准aPLs是否具有额外的诊断价值,以及非标准aPLs与临床表型相关性的研究尚不完全明确。因此,本研究旨在分析抗磷脂酰丝氨酸/凝血酶原抗体(anti-phosphatidylserine/prothrombin,aPS/PT)、抗磷脂酰肌醇抗体(antiphosphatidylinositol,aPI)、抗磷脂酸抗体(antiphosphatidic acid,aPA)和抗磷脂酰乙醇胺抗体(antiphosphatidylethanolamine,aPE)在APS患者、系统性红斑狼疮(systemic lupus erythematosus,SLE)患者和健康人群中的分布,探讨非标准aPLs检测的诊断价值以及其与临床表现的相关性,如血栓性事件、病态妊娠、APS相关肾病和神经系统症状等。
1 材料与方法
1.1 研究对象
本研究是一项单中心、前瞻性队列研究。共纳入2018年1月至2021年12月在北京协和医院就诊的146例APS患者,其中98例诊断为原发性APS(primary APS,PAPS组),41例继发于SLE诊断为继发性APS(secondary APS,SAPS组),7例诊断为血清阴性APS(SNAPS组);并选择同期SLE患者(SLE组)138例,健康对照者(HC组)55例。APS和SLE的诊断依据2006年悉尼修订的分类标准和2019年EULAR/ACR标准。除aPLs血清学检测结果外,APS组和SLE组还包括部分临床表现,如血栓形成(动脉或静脉)、病态妊娠、血小板减少、溶血性贫血等。HC组仅有aPLs血清学检测结果。本研究经北京协和医院伦理委员会批准,符合《赫尔辛基宣言》的伦理准则。所有受试者均签署书面知情同意。
1.2 研究方法
采集待检者静脉血2 mL,以4 000 r/min离心10 min后收集血清,保存于-70 ℃备用。抗心磷脂抗体(aCL)和抗β2糖蛋白Ⅰ抗体(aβ2GPI)的IgG、IgM和IgA采用深圳市亚辉龙生物科技股份有限公司iModules全自动免疫分析仪检测。aPI的IgG和IgM,aPA 的IgG和IgM以及aPE的IgG、IgM和IgA采用德国AESKU诊断股份有限公司提供的AESKULISAELISA检测试剂盒检测。aPLs水平以[log(实验值+2)U/mL]表示。
1.3 统计分析
采用SPSS 20.0软件进行统计分析。非正态分布计量资料以中位数(P25,P75)形式表示,分类变量的比较采用卡方检验(理论频数T<5时,采用Fisher精确检验)。采用校正年龄和性别的Logistic回归分析抗磷脂抗体检测结果与临床表现的关系。APS诊断的敏感性、特异性和准确性比较采用四格表McNemar分析。在用四格表法评估诊断指标时,PAPS组、SAPS组和SNAPS组均被视为试验组。统计显著性水平设置为双尾α值0.05。
2 结果
2.1 受试者基本特征
SAPS组和SLE组中女性比例略高于PAPS组(χ2分别为9.558和32.20,P分别为0.002和0)。PAPS组、SAPS组、SNAPS组与SLE组年龄无差异(P分别为0.409、1、1),但均低于HC组(P分别为0.007、0.004、0.000、0.028)。SAPS组和SLE组中ANA阳性率和Coombs实验阳性率显著高于PAPS组,差异具有统计学意义(P=0.000)。在相关临床表现中,PAPS组和SAPS组动脉血栓事件最常见(75.51%和65.85%),SLE组未发现血栓事件;SNAPS组病态妊娠事件的比例最高(85.71%);SAPS组中微血管病、血小板减少症和溶血性贫血的比例显著高于PAPS组(P分别为0、0.005和0)和SLE组(P均为0.000)。在相关实验室检测指标中,SAPS组的LAC和aCL的阳性率显著高于PAPS组(P分别为0.009和0.001),而aβ2GPI在两组之间无差异(P=0.844)(表1)。
2.2 非标准aPLs在不同人群中的分布
APS各组间相互比较结果显示,SAPS组IgG型aPS/PT(37.80 U/mL)、IgG型aPE(6.64 U/mL)和IgA型aPE(7.23 U/mL)水平均高于PAPS组(5.10、2.89、5.07 U/mL),差异有统计学意义(P分别为0.000、0.016、0.023);SAPS组IgG型aPS/PT(37.80 U/mL)、IgG型aPI(13.66 U/mL)和IgG型aPA(4.48 U/mL)水平均高于SNAPS组(5.10、2.09、0.95 U/mL),差异有统计学意义(P分别为0.002、0.025、0.009)。与SLE组比较结果显示,PAPS组IgM型aPS/PT(26.61 U/mL)、IgM型aPI(5.93 U/mL)、IgM型aPA(3.21 U/mL)和IgM型aPE(20.08 U/mL)高于SLE组(5.10、1.94、1.30、8.79 U/mL),IgA型aPE(5.07 U/mL)低于SLE组(7.53 U/mL),差异均有统计学意义(P=0);SAPS组IgG型aPS/PT(37.80 U/mL)、IgG型aPI(13.66 U/mL)、IgG型aPA(4.48 U/mL),IgG型aPE(6.64 U/mL)、IgM型aPS/PT(48.67 U/mL)和IgM型aPI(5.55 U/mL)高于SLE组(5.10、3.86、1.75、3.65、5.10、1.94 U/mL),差异有统计学意义(P分别为0、0、0、0.004、0.022、0)。与HC组比较结果显示,PAPS组aPI(IgG 5.68 U/mL,IgM 5.93 U/mL)、aPA(IgG 2.44 U/mL,IgM 3.21 U/mL)、aPE(IgG 2.89 U/mL,IgM 20.08 U/mL)和aPS/PT(IgG 5.10 U/mL)水平高于HC组(1.13、0.79、1.22、0.51、1.73、8.60、5.10 U/mL),差异有统计学意义(P分别为0、0、0、0、0、0.006、0.002);SAPS组aPS/PT(IgG 37.80 U/mL,IgM 48.67 U/mL)、aPI(IgG 13.66 U/mL,IgM 5.55 U/mL)、aPA(IgG 4.48 U/mL,IgM 2.14 U/mL)和aPE(IgG 6.64 U/mL,IgA 7.23 U/mL)水平高于HC组(5.10、21.12、1.13、0.79、1.22、0.51、1.73、3.62 U/mL),差异有统计学意义(P分别为0、0.022、0、0、0、0、0、0)。SNAPS与SLE组和HC组比较差异均无统计学意义(P>0.05)(图1)。

图1 非标准aPLs在不同人群中的分布Fig 1 Distribution of non-criteria aPLs among different patient groupsaPLs:抗磷脂抗体;APS:抗磷脂综合征;PAPS:原发性APS;SAPS:继发性APS;SNAPS:血清阴性APS;SLE:系统性红斑狼疮;HC:健康对照者;aPLs水平以[log(实验值+2)U/mL]表示;*P<0.05,**P<0.01
2.3 非标准aPLs在不同组的阳性率
PAPS组,至少一种aPLs阳性患者占79.59%,三种及三种以上aPLs阳性的患者占40.82%,六种及六种以上aPLs阳性患者占11.22%;SPAS组,至少一种aPLs阳性患者占92.68%,三种及三种以上aPLs阳性患者占51.22%,六种及六种以上aPLs阳性患者占14.63%;SNAPS组,57.14%患者至少一种aPLs呈阳性。SLE组,60.14%的患者存在至少一种aPLs,18.84%的患者存在三种及三种以上的aPLs,仅4.35%的患者存在六种及六种以上aPLs;HC组,至少有一种aPLs阳性患者比例较高(65.45%),三种及三种以上aPLs阳性患者比例仅为1.82%。至少包含一种aPLs阳性的患者中,PAPS组和SAPS组比例明显高于SLE组(P=0.002和P=0)和HC组(P=0和P=0),差异具有统计学意义。在三种及三种以上的aPLs阳性患者中,PAPS组和SAPS组比例明显高于SLE组和HC组,差异具有统计学意义(均P=0)(图2)。SNAP组与各组比较,差异均无明显统计学意义(P>0.05)。57.14%的 SNAPS患者非标准aPLs阳性,且aPS/PT IgM、aPI IgG/M和aPE IgG/M/A是部分SNAPS患者中唯一可检测到的标志物,以aPE IgM较为常见(2,28.57%)(图3)。韦恩图分析显示,在APS患者中四种非标准aPLs相比较,aPS/PT IgG/M(56.20%)和aPE IgG/M/A(58.90%)是最常见的非标准aPLs(P<0.05);aPI IgG/M是43.80%;aPA IgG/M阳性率最低,仅为29.50%,并且多伴随其他非标准aPLs同时出现(图4)。
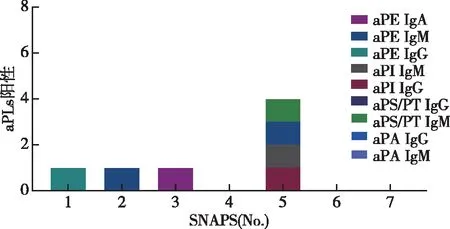
图3 SNAPS组非标准aPLs分布Fig 3 Distribution of non-criteria aPLs in the SNAPS group
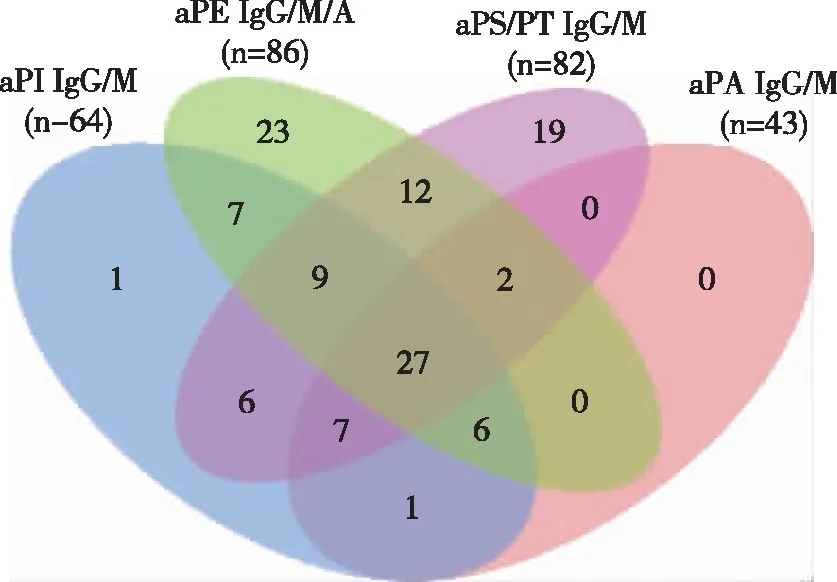
图4 APS患者非标准aPLs分布(n=146)Fig 4 Distribution of non-criteria aPLs in the APS (n=146)韦恩图重叠区域中数字代表具有特定阳性非标准aPLs患者数量,非重叠区域中数字代表单个非标准aPLs阳性患者数量,括号中数字代表该组aPLs阳性患者总数。
2.4 非标准aPLs与APS临床表现的相关性
不同aPLs与临床表现之间的相关性如森林图所示,IgM型aPS/PT是动脉事件的危险因素(OR2.30,P=0.038);IgA型aPE是静脉事件的危险因素(OR3.47,P=0.032);IgG型和IgM型 aPS/PT是血栓形成的危险因素(OR分别为2.44和2.41,P分别为0.046和0.04)。在大血管狭窄/闭塞事件中,IgM型aPI和IgM型aPA是其危险因素(OR分布为7.32和8.75,P分别为0.038,0.027);在中风事件中,IgM型aPS/PT(OR3.95,P=0.018)和IgG型aPI(OR2.63,P=0.025)是其危险因素;APS相关肾脏疾病,IgG型aPI(OR4.20,P=0.035)和IgG型aPA(OR4.87,P=0.02)是其危险因素。在相关妊娠事件中,IgG型aPS/PT与10~28周流产呈负相关(OR0.37,P=0.044)。IgM型aPS/PT、IgG型aPI和IgG型aPA是子痫前期早产的危险因素(OR分别为4.04、2.82、4.45,P分别为0.023、0.046、0.009)。IgG型和IgM型aPS/PT、IgG型和IgM型aPA是血小板减少的危险因素(OR值分别为2.46、3.01、2.77、2.65,P分别为0.016、0.004、0.018、0.047);IgM型aPI和IgM型aPA是溶血性贫血的危险因素(OR值分别为5.06和4.40,P分别为0.006、0.024);IgG型aPS/PT是非中风神经系统症状的危险因素(OR4.34,P=0.029)(图5)。
2.5 非标准aPLs在APS诊断中的预测价值分析
评估非标准aPLs阳性(>18 U/mL)在APS诊断中的敏感性、特异性、准确性等,结果显示单个抗体阳性中,aPE IgM的敏感性最高(50.00%);aPI IgG/IgM、aPA IgG/IgM和aPE IgG的特异性最高,均为100%。aPS/PT IgG阳性诊断APS的OR值最高(27.28,95%CI:3.66-203.11)。IgG型和IgM型非标准aPLs的联合检测中,aPS/PT与aPE诊断APS的敏感性较高(56.20%和55.50%),但特异性仅为(60.00%和76.40%),且两者在敏感性、特异性和准确性上无差异(P分别为1、0.064、0.456)。aPA诊断APS的准确性较低(48.76%)。IgA型aPE联合IgG和IgM检测对其敏感性、特异性、准确性均无提升(P分别为0.063、1、0.219)(表2)。

表2 非标准aPLs在APS诊断中的预测价值(n=146)Table 2 Predictive value of non-criteria aPLs in APS diagnosis(n=146)
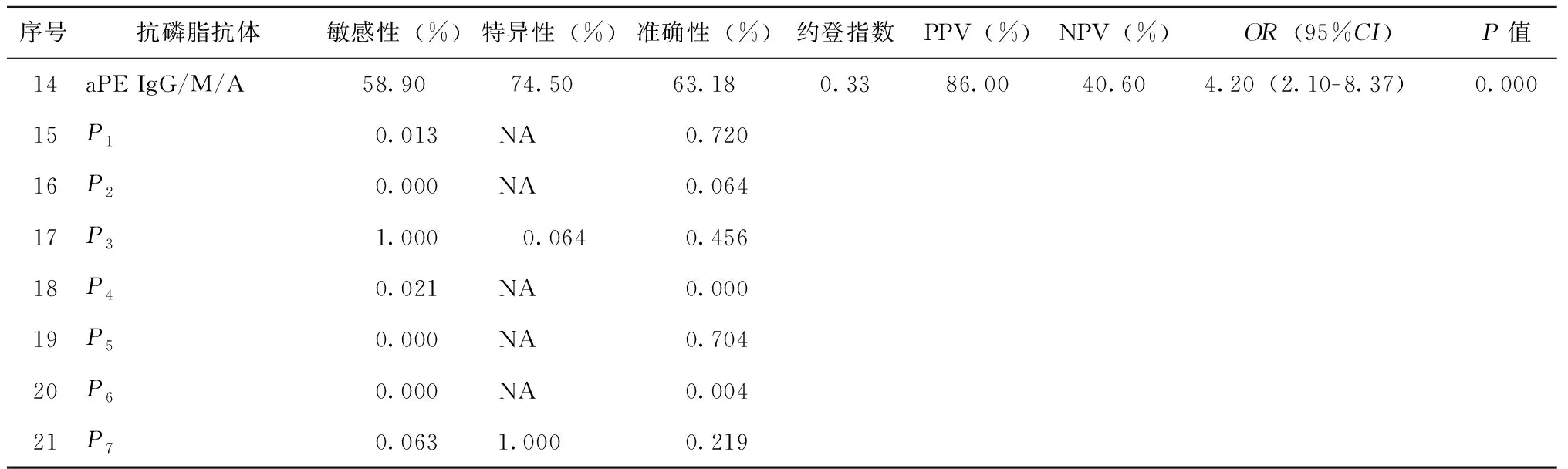
续表2
3 讨论
APS是一种累积全身多器官多系统的自身免疫性疾病,其发病率仅为0.05%[11],且女性多见[12]。临床上常见的APS主要为:(1)产科APS(obstetric APS,OAPS),主要以妊娠发病为特征[13];(2)血管或血栓性APS,主要以静脉和/或动脉血栓形成为特征[14];(3)灾难性APS(catastrophic APS,CAPS),主要以全身性微血管病变为特征。尽管CAPS在APS中的发病率不到1%[15],但其死亡率高达30%[16]。同时APS既可以是一种孤立的疾病(PAPS),也可以继发于SLE或其他自身免疫性疾病(SAPS)[17]。APS临床表现复杂且缺乏特异性,部分APS患者仅表现为血小板减少、肾病、皮肤表现(网状青斑等)和中枢神经系统症状(如认知异常和癫痫)等一些非标准临床表现[18];部分APS患者的血清学检测结果为阴性。因此,临床工作中单纯检测标准aPLs(LAC,aCL和aβ2GPI)已经不能满足APS的诊断和研究工作的需要,增加非标准aPLs的检测不仅能够提高诊断APS的能力,促进疾病的早期治疗干预,改善患者的临床结局,还能够为疾病的机制研究提供更多的血清学线索。
本研究主要评价aPS/PT、aPI、aPAaPE检测在APS的诊断价值,并分析非标准aPLs与临床症状的相关性。通过分析不同组患者非标准aPLs的分布,发现不同的抗体类型导致aPLs检测水平在不同组间存在差异,同时IgG型非标准aPLs在PAPS和SAPS组显著高于HC组,提示非标准aPLs在APS的诊断中有重要价值。本研究未观察到非标准aPLs在 SNAPS组与SLE组或HC组之间存在差异,可能是由于SNAPS组样本量较少(仅7例)所导致,但是有4例SNAPS患者非标准aPLs为阳性,因此对于SNAPS患者非标准aPLs的检测仍然具有一定的诊断价值。本研究SLE组与APS组的年龄无差异,性别的差异可能是由于SLE好发于女性所致[19]。据报道大约1%~5%的健康人群aPLs为阳性[20],10%~40%的SLE患者aPLs呈阳性[21],而这些人群中约50%~70%会进展为APS[12],可见本研究结果也反映了aPLs在人群中的分布特点。
尽管非标准aPLs在APS组与SLE组检测水平差异不明显,但是在APS组中至少一种非标准aPLs阳性和三种及三种以上非标准aPLs阳性的比例均高于SLE组和HC组,同时非标准aPLs在多数SNAP患者(57.14%)中呈阳性,这与之前的报道[5,22]类似。因此,通过对非标准aPLs的检测不仅有助于提高APS的诊断能力,还有助于识别原本可能被遗漏的血栓形成或病态妊娠的APS患者。在本研究中,IgG/M型aPS/PT和IgG/M型aPE在APS中阳性率最高(56.20%和55.50%)。LAC的测定及其辅助确认测定在技术上要求较高[23],且易受抗凝治疗的影响,而aPS/PT可以避免这种干扰,因此aPS/PT检测或可替代LAC的检测。尽管aPLs主要与带负电荷的磷脂和辅因子反应,而PE是一种中性磷脂,但是由于PE是细胞膜的主要脂质成分之一,占总磷脂的20~50%,这可能就是aPE在本研究APS队列中阳性率较高的原因[24]。据研究报道APS患者中aPI IgM和IgG阳性率分别为25.4%和31.3%[25],这与本研究结果类似。由于APS是一种罕见的自身免疫性疾病,因此相对于其他非标准aPLs来说,aPI是一个更平衡的生物标志物,其约登指数为0.44(敏感性和特异性分别为43.80%和100%)。虽然aPA是一种抗负电荷的磷脂抗体,但是其阳性率远远低于其他抗磷脂抗体,并且aPA抗体常伴随其他非标准aPLs同时出现。这可能是由于PA是一种瞬时产生的代谢中间产物,主要由膜磷脂(包括PC和PE)分解产生[26],是生物膜的次要成分(其含量约占磷脂的1%)[27]。
单纯的抗磷脂抗体阳性并不能导致疾病的发生,当额外的触发因素促进血栓事件的形成时,部分患者会出现临床表现(二次命中假说)[28]。aPLs可能导致各种类型的血栓形成和产科并发症(如流产、先兆子痫或胎盘功能不全等),以及一些瓣膜疾病和血液系统疾病等。aPLs诱发这些病变的机制非常复杂,涉及多种细胞(如内皮细胞、血小板、单核细胞等)、补体等[29]。APS所表现的血栓事件中,以静脉血栓最为常见;动脉血栓通常以脑血管意外为主,多以中风或短暂性脑缺血的形式出现,其次是心肌梗死[30]。本研究发现非标准aPLs与血栓事件有显著的关联,这与其他研究结果[31-32]类似。aPS/PT是血栓形成的危险因素;IgM型aPS/PT是动脉事件和中风发生的危险因素。Sciascia等[33]也证实aPS/PT抗体的存在增加了动脉血栓形成的风险。目前,aPS/PT已被纳入全面抗磷脂综合征评分(global antiphospholipid syndrome score,GAPSS)[34]。尽管在本研究中联合IgA型aPE的检测没有提高aPE(IgG/IgM)在APS中的诊断价值,但在静脉事件中,仅观察到IgA型aPE是其危险因素,这与之前的报道结果[29]相同。
认知功能障碍是APS患者较为常见的症状[35],在本研究中IgG型aPS/PT是非中风神经系统(认知障碍、癫痫、舞蹈症等)事件的危险因素。大约63%~67%的APS患者会出现APS相关肾病,表现为肾脏小血管的非炎症性闭塞[36]。本研究表明aPI IgG和aPA IgG是APS相关肾脏疾病的危险因素,临床上CAPS的肾脏受累是其特征性表现之一[37],这就为是否能够通过aPLs预测CAPS的临床结局提供了一种设想。
据报道,APS患者流产的发生率约为34%~76%[38]。在相关妊娠事件中,本研究仅观察到aPS/PT IgG与10~28周流产呈负相关;aPS/PT IgM、aPI IgG和aPA IgG是子痫前期早产的危险因素,这可能是由于aPLs导致的早期流产的机制和晚期妊娠丢失或胎盘梗死的机制不同[39]。有研究表明aPS和aPI在三次及以上自然流产的患者中阳性率分别为19%和20%,两次自然流产的患者阳性率分别为25%和17%[40],并且aPA与胎儿丢失密切相关[24]。因此推测在临床工作中能够通过aPLs预测不良妊娠事件的发生,从而及时干预和改善患者的临床结局。
部分风湿性疾病患者是以血液系统表现为其首发症状,同时一些新型抗风湿生物制剂也可能导致血细胞减少。APS患者最常见的血液系统表现为血小板减少,约占16%~53%,这种异质性可能源于对血小板减少的定义以及针对不同的研究对象(原发、继发或联合人群)有关[41]。当APS继发于SLE时,血小板减少更常见(血小板减少已经纳入SLE分类标准)。有研究表明SAPS的血小板减少发生率大约是PAPS的两倍[42],本研究SAPS组血小板减少的阳性率也远远大于PAPS组。本研究还发现IgG/M型aPS/PT和IgG/M型aPA是血小板减少的危险因素,这可能是由于aPLs可以促进血小板的活化和消耗所致[30,41]。据报道溶血性贫血在SAPS中阳性率最高[43],这与本研究结果相同。aPLs导致溶血性贫血的机制可能依赖于红细胞表面不同的抗原性[44],同时红细胞寿命缩短也取决于免疫球蛋白亚类的类型,即IgG1和IgG3比IgG2和IgG4结合补体的能力更强。红细胞膜上免疫球蛋白一旦达到临界量,aPLs就可能激活补体,从而导致红细胞破坏[43]。本研究仅发现IgM型aPI和IgM型aPA这两个非标准aPLs是溶血性贫血的危险因素,这可能是由于IgM也是一种强大的补体激活剂,且其补体激活能力高于IgG1和IgG2亚型。
综上所述,尽管非标准aPLs可以提高其在APS中的诊断价值,并对疾病的临床表现具有一定的预测价值,但由于本研究是一项单中心、前瞻性队列研究,样本量有限,未考虑不同人群、地区等影响,同时由于不同的检测方法、抗原来源、包被方式、试剂等在抗体检测中的差异,可能会出现相互矛盾的结果[45]。本研究通过分析aPS/PT IgG/M、aPI IgG/M、aPA IgG/M和aPE IgG/M/A在APS、SLE和HC组的水平,发现非标准aPLs对APS具有一定的辅助诊断价值,尤其适用于诊断部分临床表现不明显或者标准aPLs反复阴性的患者。在APS相关临床事件中,IgG型和IgM型aPS/PT是血栓事件的危险因素;IgM型aPS/PT和IgG型aPI是中风事件的危险因素;IgG型aPI和IgG型aPA与APS肾病的危险因素;IgG型aPS/PT与10~28周流产负相关;IgM型aPS/PT、IgG型aPI和IgG型aPA是子痫前期早产的危险因素。在血液系统疾病方面aPS/PT和aPA是血小板减少的危险因素;IgM型aPI和IgM型aPA是溶血性贫血的危险因素。因此,非标准aPLs的检测将有助评估APS的发展,预测不良事件的发生,从而及时干预和改善患者的临床结局。总之,本研究为评价非标准aPLs在APS的诊断价值及其与临床表型的相关性研究提供了重要依据。

