阿巴西普治疗干燥综合征合并难治性视神经脊髓炎谱系病一例报告
孟德芳,来娜琳,周蓓蓓,魏华
视神经脊髓炎谱系病(neuromyelitis opticaspectrum disorder,NMOSD)是一种罕见的自身免疫性疾病,主要影响神经和脊髓,水通道蛋白4(aquaporin-4,AQP4)抗体在其发病过程中起着至关重要的作用,其介导的星形胶质细胞炎症易在视神经、脊髓及延髓极后区发生,该疾病往往预后不良,严重者可导致永久性失明或瘫痪等严重残疾[1]。干燥综合征(Sjögren’s syndrome,SS)与NMOSD有密切的关系,SS伴发脱髓鞘性中枢神经系统疾病通常与存在NMOSD有关,约11%~19%的NMOSD 患者存在抗SSA抗体[2-3]。本文报告一例SS合并NMOSD患者的诊疗经过,探讨T细胞靶向治疗难治性复发性NMOSD的临床应用前景。
1 病例摘要
患者女性,54岁,2014年主因“口干眼干2年”就诊本院门诊,查自身抗体示抗核抗体(+),抗SSA抗体(+),血常规示白细胞2.5×109/L,唇腺活检示(左下唇)涎腺间质内可见少量淋巴细胞散在浸润,角膜荧光染色阳性,诊断为SS,予以羟氯喹(hydroxychloroquine,HCQ)0.2 mg bid 口服,患者3年前自行停药。2020年5月,患者主因“右眼视力下降半月”入住本院眼科,查眼眶MRI示右侧视神经长T2信号,考虑炎症;颈椎、胸椎和腰椎MRI正常。住院期间予以甲泼尼龙(methylprednisolone,MP)1000 mg qd×3 d,后减量至MP 40 mg qd×7 d,同时予以血浆置换三次,美罗华500 mg静脉注射一次,环孢素(cyclosporinA,CsA)100 mg bid口服。患者出院后一直门诊规律调整用药。因考虑患者视力一直未缓解,2020年7月,门诊停用CsA,换用环磷酰胺(cyclophosphamide,CTX)400 mg 静脉输注一次,患者使用CTX后出现发热,血常规示白细胞0.56×109/L,遂停用CTX。2021年12月,患者因“尿便障碍半月余”再次入院,患者同时出现下肢活动受限和肢体感觉异常。入院查体:神志清,查体配合。右眼视力10 cm指数,左眼视力70 cm指数。伸舌居中,双侧乳头平面以下浅感觉减退,四肢肌张力正常,右下肢肌力4-级,左下肢肌力正常,双上肢腱反射正常,双下肢腱反射(++)。实验室检查:血常规示血红蛋白97 g/L,余正常;肝功能正常;血沉12 mm/h;C-反应蛋白10.73 mg/L;脑脊液常规和脑脊液生化无异常;AQP4抗体1∶100;CD19+18.06%、CD20 18.06%。颈椎MRI示C2-C7水平颈髓多发小片状等T1长T2信号,STIR高信号,较前2021-03-09新发,考虑炎症(图1A)。胸椎MRI示胸髓T1-T10水平胸髓略增粗,多发小片状的等T1长T2信号影,STIR高信号,边界不清,较前2021-3-9新发,考虑炎症(图1B)。眼眶MRI示双侧视神经等T1长T2信号,右侧明显,考虑炎症,较2021-03-10略进展(图1C)。治疗上再次予以MP 1000 mg×3 d;CTX 200 mg qod静脉滴注累计1 g;血浆置换3次。住院期间患者出现发热,血培养示大肠埃希菌,考虑败血症,根据药敏结果予以美罗培南目标性抗感染。考虑患者视力仍未见明显缓解,并且在使用CTX后出现继发感染,在感染控制后调整治疗方案,加用阿巴西普250 mg 皮下注射。出院后予以MP 32 mg qd 口服;阿巴西普 250 mg 皮下注射qw。期间激素逐渐减量,余方案未做调整,经治疗后患者视力逐渐好转,2022年5月复诊,查体:右眼视力指数/1 m,左眼视力指数/5 m,双下肢肌力肌张力正常,肢体感觉正常。复查颈椎MRI示颈椎退行性变,胸椎MRI示胸椎退行性变,炎症基本吸收;眼眶MRI示炎症较前稍吸收(图1D~F)。
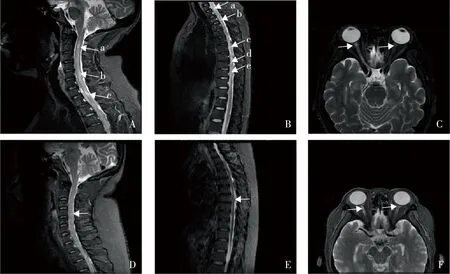
图1 阿巴西普治疗前后颈髓、胸髓和视神经经影像学改变
2 讨论
NMOSD一直被认为是一种抗体介导的自身免疫性疾病,但是仅存在AQP4特异性抗体不足以引发中枢神经系统炎症病变,并且部分患者即便病情缓解,仍显示出持续高滴度的抗AQP4抗体。相关基础研究发现将AQP4-特异性T细胞转移到Lewis大鼠体内会诱发脊髓和大脑发生视神经脊髓炎样病变[4]。有研究发现NMOSD患者脑脊液IL-6和IL-17水平升高,并且外周血Th17细胞和IL-17-分泌性T细胞比例高于多发性硬化(multiple sclerosis,MS)患者[5-6],另外也有研究提出NMOSD可能是Th17驱动的自身免疫性疾病[7]。可见NMOSD是一种T-B细胞介导的疾病,为临床治疗方案的选择开拓了新思路。由于本患者对常规免疫抑制剂反应差,且出现药物不耐受,因此尝试使用阿巴西普治疗NMOSD,临床观察发现患者结局良好,病情缓解,并且一年内未复发。本病案报告有其局限性,因为患者病情复发在传统治疗后加用阿巴西普,后期观察到的临床疗效也不能完全排除前期激素冲击和血浆置换的基础作用,但是考虑到患者既往病程中对激素和免疫抑制剂疗效欠佳的特点,以及患者后期单用阿巴西普联合激素的临床反应,依然在一定程度上可以肯定阿巴西普的临床疗效,这一结论仍需要更多的临床数据支持。
SS作为一种以B细胞功能紊乱为主的自身免疫性疾病,T细胞(CD4+ T细胞、CD8+ TRM细胞和固有T细胞)也在其中发挥了重要作用[8]。而阿巴西普可以靶向滤泡辅助性T细胞和调节性T细胞,从而破坏其增殖和功能[9],为阿巴西普应用于SS的治疗提供了理论依据。目前阿巴西普在SS的临床应用也有了初步探索,但是临床应用研究结果不一。一项随机双盲III期临床试验研究,纳入187例(阿巴西普治疗组92例;安慰剂组95例)成人活动性原发性干燥综合征(primary Sjögren’s syndrome,pSS)患者,主要终点是第169天SS患者疾病活动指数(EULAR Sjögren’s syndrome disease activity index,ESSDAI)相对于基线的平均变化,关键的次要终点是第169天EULAR SS患者自我报告指数(EULAR Sjögren’s syndrome patient reported index,ESSPRI)和刺激全唾液流 (stimulated whole salivary flow,SWSF)相对于基线的平均变化,研究结果显示与安慰剂组相比,阿巴西普治疗中重度pSS患者未产生显著的临床疗效[10]。另外一项为期48周的III期临床试验纳入了80例SS患者评估阿巴西普的临床疗效,研究结果显示阿巴西普可以改善SS患者干眼症、ESSDAI评分和ESSPRI评分,降低血清类风湿因子(rheumatoid factor,RF)和免疫球蛋白G(immunoglobulin G,IgG)水平[11]。同时,有研究显示阿巴西普可以改善类风湿关节炎伴发SS患者的临床症状,包括腺体功能和腺体外受累情况、ESSDAI评分和ESSPRI评分[12]。既往临床研究主要观察阿巴西普对于SS常见的临床表现和实验室指标,本报告补充了阿巴西普在治疗伴发重症神经病变SS中的临床应用案例。
目前,阿巴西普用于神经病变的临床应用报道较少,由于NMOSD高发人群在亚裔,欧美国家相关研究较少,在治疗视神经脊髓炎中尚无相关报道,但在多发性硬化疾病(multiple sclerosis disease,RRMS)中已经有相关临床应用报道。阿巴西普治疗RRMS的一项I期试验,纳入20例复发缓解型MS患者,其中16例患者接受单次阿巴西普治疗,4例患者接受四剂阿巴西普治疗,结果显示阿巴西普耐受性良好,2月后进行免疫功能测定,结果提示髓鞘碱性蛋白(myelin basic protein,MBP)分泌减少,γ-干扰素(interferon-γ,IFN-γ)产生减少[13]。一项II期临床试验研究纳入123例RRMS患者,主要终点是新发钆(Gd+)病灶的平均数量,每4周复查一次磁共振成像,结果提示阿巴西普耐受性良好,但在减少新发Gd+MRI病灶数量和改善RRMS疾病活动相关临床参数方面相较于口服药物治疗组无明显统计学差异[14]。另外,既往有报道阿巴西普可以改善免疫缺陷病(commonvariable immunodeficiency,CVID)的中枢神经系统病变,上调CD4+CD25+ FOXP3+T细胞的表达[15]。阿巴西普在神经系统相关病变中的临床应用初步探索,为拓展阿巴西普治疗免疫相关的神经病变提供了借鉴。
阿巴西普在SS的应用仍处于初步探讨阶段,目前国内外尚缺乏阿巴西普治疗SS合并NMOSD的临床报道和大型研究,本病例为阿巴西普治疗难治性复发性NMOSD提供了很好的借鉴意义,但阿巴西普能否预防复发,达到长期临床缓解,还需要进一步研究和探讨。

