孕前体重指数与妊娠期并发症及新生儿出生体重的相关性分析
李伯平(天津市河西区挂甲寺街社区卫生服务中心,天津 300210)
近年来随着高龄产妇和经产妇增多,孕期营养问题也日益突出[1]。体重指数(BMI)是评估孕期营养健康状况最直接的指标,不同的孕期BMI对母婴结局都有深远的影响。BMI过低容易导致胎儿生长发育受限,超重和肥胖则易引起妊娠期糖尿病、高血压疾病、巨大儿、剖宫产等不良结局风险增加[2]。本研究通过回顾性分析不同的孕前BMI对母婴不良妊娠结局的影响,现报道如下。
1 资料与方法
1.1 资料来源 于2019年1月1日-2023年3月31日在我院建册并进行规范孕产期保健管理的满28周分娩的单胎活产孕产妇1543例,年龄16-44周岁,平均(32.12±4.37)岁。排除既往冠心病史、肝病史、肾病史及家族遗传病史等。收集产妇年龄、孕前BMI、GDM、妊娠期高血压疾病情况、分娩孕周、新生儿出生体重及健康状况等数据,所有产妇的临床资料完整,真实可靠。本研究经医院伦理委员会审批通过。
1.2 分组及诊断标准 依据孕前体重和身高计算孕前BMI,BMI=体重(kg)/身高2(m2)。按BMI不同分四组:消瘦组:BMI<18.5kg/m2,131例;标准组:18.5kg/m2≤BMI<25.0kg/m2,1079例;超重组:25.0kg/m2≤BMI<28.0kg/m2,176例;肥胖组:BMI≥28.0kg/m2,157例。以标准体重组为对照组。孕期进行个体化体重管理:消瘦的孕妇孕期正常增重范围12.5-18.0kg,标准体重的孕妇孕期正常增重范围11.5-16.0kg,超重的孕妇孕期正常增重范围7.0-11.5kg,肥胖的孕妇孕期正常增重范围5.0-9.0kg。根据国际糖尿病与妊娠研究组(IADPSG)2010年推荐:对所有尚未被诊断为孕前糖尿病的孕妇在孕24-28周进行75gOGTT试验:空腹及服糖后1h、2h的血糖值任一次达到或超过5.1mmol/L、10.0mmol/L、8.5 mmol/L均诊断为妊娠期糖尿病。
1.3 统计学方法 采用Excel 2007建立数据库,采用SPSS27.0统计软件进行数据分析,正态分布的计量资料以均数±标准差(±s)表示,采用方差分析;计数资料以例数构成比[n(%)]表示,采用卡方(χ2)检验。设置95%置信区间,P<0.05表示差异有统计学意义。
2 结果
2.1 不同孕前BMI孕产期基本情况 研究中1543例孕产妇,平均年龄(32.12±4.37)岁。其中315例为年龄≥35岁的高龄孕产妇,占比为20.41%,经产妇479例,占31.04%。超重和肥胖孕妇比例11.41%和10.17%。妊娠期糖尿病、妊娠期高血压疾病的发生率分别为23.98%、4.15%。妊娠期最低血红蛋白65-135g/l,均值(112.66±8.19)g/l,妊娠期贫血的总体发生率为33.70%。孕期合并子宫肌瘤和甲状腺疾病的发生率分别为7.52%、7.32%。分娩孕周<37周的早产儿72例,占4.67%。巨大儿发生率为6.29%,剖宫产率为46.21%。见表1。
2.2 不同孕前BMI孕妇妊娠期并发症的相关性 不同孕前BMI组别孕妇的年龄分布不均,超重组和肥胖组高龄孕产妇占比较高,分别占高龄产妇的30.68%、22.93%,差异有统计学意义(P<0.05)。GDM、妊娠期高血压疾病的发病率随着孕前BMI的增大而增加,肥胖组GDM和妊娠期高血压疾病的发生率更是高达51.59%和19.75%,差异有统计学意义(P<0.05)。妊娠期贫血的发生率消瘦组(45.04%)>标准组(35.40%)>超重组(24.43%)>肥胖组(22.93%),以消瘦组(45.04%)最高,组间差异有统计学意义(P<0.05)。见表2。
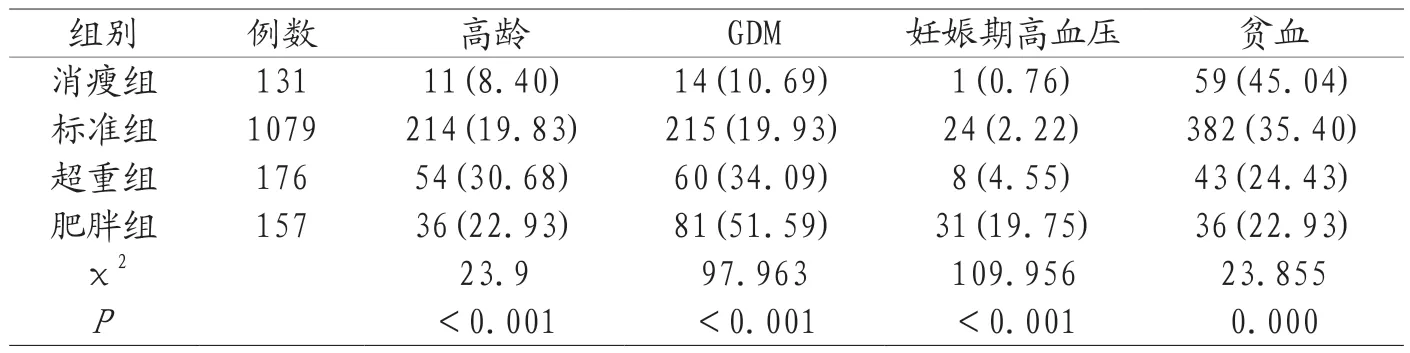
表2 不同孕前BMI与妊娠期并发症的相关性分析[n(%)]
2.3 孕期多因素与低体重儿、巨大儿的相关性 本研究中新生
儿出生体重最低1100g,最高4880g,平均(3316.99±464.59)g。孕妇年龄、GDM、妊娠期高血压、妊娠期贫血、分娩孕周对低体重儿和巨大儿发生率具有统计学意义(P<0.05),而产次、甲状腺疾病病史、子宫肌瘤等对新生儿出生体重的影响无统计学意义(P>0.05),超过半数的早产儿为低体重儿。见表3。

表3 孕期各因素与分娩体重(低体重儿、巨大儿)之间的相关性[n(%)]
2.4 不同孕前BMI孕妇分娩结局的比较新生儿出生体重随着孕前BMI的增大而增加,不同孕前BMI对新生儿出生体重影响具有统计学意义(P<0.05)。本研究中,低体重儿共54例,发生率为3.50%,各组别中低体重儿的发生率:肥胖组(5.73%)>消瘦组(4.58%)>标准组(3.24%)>超重组(2.27%)。巨大儿97例,超重和肥胖的孕妇分娩巨大儿的比例(13.07%、12.10%)明显高于标准组(5.00%)和消瘦组(0.76%)。各组间低体重儿、巨大儿发生率差异有统计学意义(P<0.05)。孕前BMI与剖宫产率成正相关,差异具有统计学意义(P<0.05)。B M I 与早产之间无统计学意义(P>0.05)。见表4。
表4 不同孕前BMI孕妇分娩结局的比较[±s,n(%)]
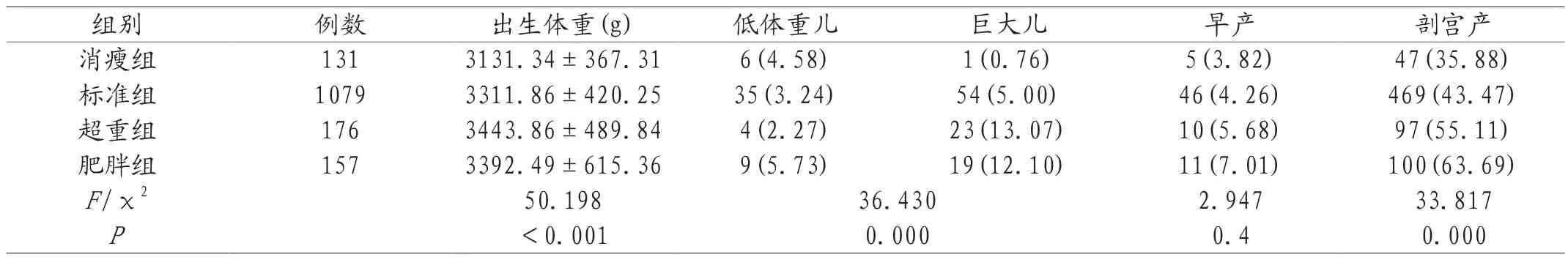
表4 不同孕前BMI孕妇分娩结局的比较[±s,n(%)]
组别例数出生体重(g)低体重儿巨大儿早产剖宫产消瘦组1313131.34±367.316(4.58)1(0.76)5(3.82)47(35.88)标准组10793311.86±420.2535(3.24)54(5.00)46(4.26)469(43.47)超重组1763443.86±489.844(2.27)23(13.07)10(5.68)97(55.11)肥胖组1573392.49±615.369(5.73)19(12.10)11(7.01)100(63.69)F/χ250.19836.4302.94733.817 P<0.0010.0000.40.000
3 讨论
3.1 不同孕前BMI与妊娠期并发症的相关性 随着二胎三胎的放开和都市女性的晚婚晚育,导致高龄产妇、经产妇增加,加上现代化交通工具的便捷和饮食结构的改变,脂质代谢异常等情况增多,导致超重和肥胖孕妇比例增加。超重和肥胖是妊娠期高血压和GDM共同的高危因素。超重和肥胖同时普遍存在着脂肪代谢障碍及胰岛素抵抗类因子增多现象,从而导致周围组织对胰岛素敏感性降低,增加GDM的发生风险[3-4]。随着GDM患者孕前体重指数的增长,妊娠期高血压疾病发生率也在增加[2]。高血糖易引起微血管内皮受损,管壁增厚、变窄、阻力加大,涉及氧化应激、炎症和血管功能改变等[8],增加妊娠期高血压疾病和子痫前期的发生风险。有试验表明,孕前体重及孕期BMI增加过多会导致妊娠期高血压和GDM的发生[5-7]。超重及肥胖孕妇容易发生内分泌代谢紊乱,导致体内炎症因子过氧化物酶释放增加,引起血管收缩、血小板聚集而诱发高血压。本研究显示,超重组和肥胖组GDM的发病率明显升高,肥胖组GDM的发生率更是高达51.59%,妊娠期高血压疾病的发生率达19.75%。消瘦组孕妇妊娠期发生GDM和妊娠期高血压概率明显低于其他三组。
世界卫生组织(World Health Organization,WHO)指出,全球育龄妇女和妊娠期妇女的贫血率分别为29.4%和38.2%。我国妊娠期贫血发生率在10%-40%[9]。本研究中贫血发生率为33.7%。孕期需要大量的铁维持胎儿的生长发育,但由于孕妇在孕期胃肠蠕动减弱,胃酸分泌减少,无法从食物中摄取足够量的铁和叶酸,因此容易发生妊娠期贫血。缺铁性贫血是妊娠期贫血的主要类型。孕期血容量较非孕期增加40%-45%,血浆容量占70%、红细胞容量占30%,增加比例的不同使血红蛋白浓度相对下降,从而出现血液稀释现象,导致发生生理性贫血;孕前BMI偏低可增加妊娠期贫血发生率,也有临床实践证明孕前超重相比孕前BMI标准的孕妇更容易发生贫血[10]。而本研究显示超重和肥胖是妊娠期贫血的保护性因素,消瘦组更易发生妊娠期贫血,发生率为45.04%。可见孕前控制体重指数在合理范围内并注意孕期营养管理对降低妊娠期糖尿病、妊娠期高血压疾病、贫血等并发症的发生率意义重大。
3.2 不同孕前BMI对妊娠结局的影响 一般认为消瘦容易造成胎儿生长受限、低体重儿的发生。本研究显示新生儿平均出生体重以消瘦组最低,但低体重儿发生率却以肥胖组更高,可能与肥胖孕妇妊娠期并发症导致胎儿生长发育受限和血压控制不满意等医疗指征而适时终止妊娠有关,这也可能是本研究中肥胖孕妇的早产儿发生率是最高的原因。可见适宜的孕前体重指数和轻度超重是低体重儿的保护性因素。
超重组及肥胖组孕妇生产巨大儿的概率较消瘦组或正常组孕妇明显升高[11],本研究中随着孕前BMI的增加,巨大儿、剖宫产率逐渐增加。超重组和肥胖组孕妇分娩巨大儿的比例高达13.07%和12.10%。超重、肥胖容易发生GDM,使胎儿长期处于宫内高血糖状态,脂肪在胎儿体内沉积,导致巨大儿发生。巨大儿作为适当放宽剖宫产的主要指征之一,致使剖宫产发生率也必然上升。有研究[12]显示,孕前超重及肥胖的孕妇在阴道试产过程中转剖宫产的概率显著增加。可能的原因是盆腔脂肪堆积占据盆腔空间,胎头难以入盆、下降;腹壁脂肪过厚第二产程难以用力;肥胖孕妇易发生巨大胎儿,子宫体积增大,子宫肌纤维过度伸张导致子宫收缩乏力;巨大儿可导致相对头盆不称等,这些不良因素均不利于正常分娩,增加阴道助产手术和剖宫产率。
总之,妊娠是一个复杂的生理过程,妊娠结局受多种因素的影响。BMI作为可控因素,应在孕期对孕妇做好咨询宣教工作,合理控制其孕前BMI,加强孕妇营养评价和个体化体重管理,使其孕期保持合理的体重增长,降低孕产期糖尿病和妊娠期高血压等并发症的发生率,最大限度地避免不良妊娠结局的发生,保障母婴健康安全。

