角叉菜胶构建大鼠慢性非细菌性前列腺炎模型的影响因素
苏旭珍,张 强,项瑞君,张春雷,张 斌,常德辉
前列腺炎是临床常见病、多发病之一,其中慢性前列腺炎在前列腺炎中的占比高达90%[1],以慢性非细菌性前列腺炎(chronic non-bacterial prostatitis,CNP)占比为主。临床主要表现为阴囊潮湿、会阴部疼痛不适、阴茎疼痛及性交射精痛,同时伴尿频、尿急、尿痛、尿不尽等症状[2,3]。CNP病因复杂,发病机制尚未研究清楚[4],所以建立稳定、理想的动物CNP模型对研究其发病机制有重要意义。现有动物CNP模型研究中,角叉菜胶注射于大鼠局部构建CNP模型在化学法构建CNP模型中较为常用。但是国内外文献关于构建模型的鼠种、角叉菜胶注射部位以及注射浓度均无统一标准,导致构建的模型缺乏统一标准。本研究重点观察鼠种、角叉菜胶注射部位及注射浓度对角叉菜胶构建大鼠CNP的影响,以形成稳定、重复性好的CNP大鼠模型构建方法,为后期研究CNP发病机制、构建稳定可靠的动物模型提供实验参考。
1 材料与方法
1.1 实验动物 选用解放军联勤保障部队第940医院实验动物中心提供的无特定病原体级(specific pathogen free, SPF)雄性大鼠60只(SD 30只,Wistar 30只),体重220~280 g, 10周龄,许可证号:SCXY(军)2012-0020。动物饲养于解放军联勤保障部队第940医院实验动物房,给予啮齿类动物标准颗粒饲料(实验动物中心提供)及自来水自由饮用,12 h循环明暗光照,恒定温度(24±2 ℃)、湿度(40%~70%)。实验方案由解放军联勤保障部队第940医院动物伦理委员会批准(审批编号:2021KYLL141)。
1.2 实验仪器与试剂 角叉菜胶(Sigma,美国,生产批号:C1013-25G);0.9%氯化钠注射液(四川科伦药业股份有限公司,生产批号:C22051805);10%水合氯醛(兰州大学第一医院,生产批号:H04000035);青霉素G钠盐(北京博奥森生物技术有限公司,生产批号:D21004);10%甲醛固定液(南昌雨露实验器材有限公司,生产批号:190515);苏木精-伊红(HE)组套染色液(南昌雨露实验器材有限公司,生产批号:190601);一次性注射器(山东威高集团医用高分子制品股份有限公司,生产批号:20220221);病理图像采集系统(OLYMPUS 公司,日本,型号:BX53-DP26)。
1.3 方法
1.3.1 分组与模型制备 (1)角叉菜胶生理盐水溶液制备:称取0.1 g、0.3 g角叉菜胶两份,分别定容成10 ml的角叉菜胶生理盐水溶液,配置成1%、3%的角叉菜胶生理盐水溶液留置备用。制备全程在洁净工作台制备并储存于无菌离心管中。(2)分组:将30只SD雄性大鼠随机分成5组,每组6只,A组为正常对照组,B组为1%角叉菜胶溶液注于前列腺组,C组为3%角叉菜胶溶液注于前列腺组,D组为1%角叉菜胶溶液注于精囊组,E组为3%角叉菜胶溶液注于精囊组;将30只Wistar雄性大鼠随机分成5组,每组6只,其中F组为正常对照组,G组为1%角叉菜胶溶液注于前列腺组,H组为3%角叉菜胶溶液注于前列腺组,I组为1%角叉菜胶溶液注于精囊组,J组为3%角叉菜胶溶液注于精囊组。(3)模型制备:综合参考以往的造模方式[5,6],大鼠分笼适应性饲养7 d后取出用10%水合氯醛腹腔注射(剂量:0.3 ml/100 g)麻醉,血管钳夹持大鼠腹部皮肤无反应后将大鼠移至无菌台,剔除腹毛,用聚维酮碘消毒大鼠腹部皮肤,纱布保护手术区域,下腹部沿腹中线剪开3 cm长的纵行切口,逐层打开腹腔充分暴露前列腺左右腹侧叶及双侧精囊,轻轻固定注射部位,前列腺左右腹侧叶各注射2针(每针0.05 ml,共计0.20 ml/只)或精囊左右侧各注射1针(每针0.10 ml,共计0.20 ml/只),每次注射结束后无菌纱布按压注射点,防止角叉菜胶溶液外渗,造成后期腹腔严重粘连。注射完毕后将脏器归位,观察无明显出血后逐层关闭腹腔,聚维酮碘再次消毒清理血渍,防止大鼠互相撕咬。肌肉注射青霉素G钠盐(剂量25万U/kg),1次/d,连续3 d。每天观察大鼠状态及进食量,21 d后称重,同法麻醉解剖取前列腺后处死大鼠。
1.3.2 检测指标与方法 摘除大鼠前列腺完整组织后称取湿重,计算前列腺指数。公式为:前列腺指数=前列腺组织总湿重/大鼠体重(单位:mg/g)。将前列腺完整组织置于组织固定液做组织HE染色,通过光学显微镜观察截图,病理组织HE染色炎症细胞计数,参照王先进等[7]评判标准。
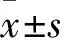
2 结 果
2.1 解剖学观察 正常对照组大鼠前列腺组织比较饱满,色泽红润,弹性较好,与周围组织未见粘连。实验组大鼠前列腺组织暗淡无光,弹性欠佳,与周围组织粘连明显,其中SD雄性大鼠较Wistar雄性大鼠炎症反应更加明显,部分SD大鼠出现了腹膜炎、腹水,甚至出现死亡情况。就解剖整体肉眼观评价,SD大鼠对注射角叉菜胶炎症反应更加敏感。
2.2 前列腺指数测定 各实验组大鼠的前列腺指数(mg/g)分别为:B组2.27±0.05、C组2.43±0.07、D组2.32±0.04、E组2.45±0.04、G组2.30±0.02、H组2.49±0.04、I组2.37±0.04、J组2.50±0.04;与正常组大鼠(A组2.03±0.06、F组2.07±0.04)比较,实验组大鼠前列腺指数均显著增大,具有明显差异(P<0.05)。
2.3 组织病理学 病理切片显微镜下观察显示,正常组大鼠前列腺可见大小一致的前列腺腺泡腔,腺泡腔壁均匀一致,腔内皱壁丰富且形态规则;前列腺间质无明显肿胀,分界较清晰,无或者伴少量炎症细胞浸润。实验组大鼠部分前列腺组织或整个腺体组织前列腺腺泡腔散乱,无固定形态,腔内皱壁欠规则或消失。前列腺间质明显肿胀且分界不明显,大量炎症细胞浸润,血管明显扩张,前列腺病理改变明显。各组大鼠前列腺病理HE染色炎症细胞计数(单位:个/HP,表1)。

表1 各组大鼠前列腺病理HE染色炎症细胞计数
3 讨 论
现有动物CNP模型的研究中,角叉菜胶注射于大鼠局部构建CNP模型在化学法构建CNP模型中较为常用。化学试剂角叉菜胶是一种诱导非特异性炎症的经典试剂,角叉菜胶局部注射构建CNP大鼠模型是制备CNP模型的常用方法,通过查阅文献[5,6,8-20]了解雄性大鼠鼠种、注射部位、注射浓度及剂量却不尽相同(表2),但没有相关研究表明各种方法的优劣之处。在雄性大鼠鼠种的选择上,既往报道可以用SD、Wistar、lewis大鼠等构建CNP模型,其中SD、Wistar雄性大鼠较为常用,本实验选择SD、Wistar雄性大鼠构建CNP模型做比较;在注射部位选择时,既往报道有选取双侧精囊、前列腺左右腹侧叶、前列腺背侧叶,笔者前期实验操作发现前列腺背侧叶解剖暴露比较困难,并且有报道显示背侧叶和腹侧叶对造模影响不太显著;既往研究显示注射浓度最常用的有1%、3%,也有选择5%的情况。
本研究结果显示:(1)SD大鼠前列腺病理HE染色混合炎症细胞计数变化明显,并且在Wistar正常大鼠前列腺组织中检测到炎症细胞,考虑与鼠种有关,这样很难区分是否是由于局部注射角叉菜胶造成的,并且在后续的实验中观察到实验组与正常组变化较SD大鼠不太显著,所以就化学试剂局部注射构建CNP模型鼠种选择时建议选择SD雄性大鼠。(2)选择双侧精囊、前列腺左右腹侧叶局部注射对比,发现在双侧精囊注射化学试剂构建CNP模型时,大鼠死亡率比较高,并且有个别大鼠出现腹部急性期炎症变化,但是前列腺局部炎症浸润范围较广。选择前列腺左右腹侧叶注射,发现大鼠死亡率明显下降,并且建模成功率较高,但是只有注射进针部位周围出现了慢性炎症浸润,可以选择多点注射扩大炎症范围来弥补这一不足。(3)本研究前期实验发现,在配置5%生理盐水角叉菜胶溶液时溶解比较困难,并且由于过于黏稠,注射时有一定困难。对比发现3%生理盐水角叉菜胶溶液较1%的建模效果更明显。前期实验研究发现,前列腺左右腹侧叶注射时如果单个注射点注射量过大,退针后由于局部张力过大漏液,后期会出现腹腔严重粘连,对解剖取材造成一定困难。建议选择适宜的量多点注射,并且在退针后可用清洁纱布局部轻轻沾取漏液,避免后期腹腔炎症。另外,在前期的实验观察中建议选择适宜鼠龄的SD雄性大鼠,鼠龄较小,前列腺体积小,可能会影响造模效果。操作抓取大鼠时不可对大鼠尾巴造成损伤,即使长时间抓捏,也会造成大鼠后期断尾情况,所以建议抓取大鼠时注意保护大鼠尾巴。建议实验操作后预防性注射抗生素,以降低实验大鼠死亡率。
本研究初步明确了大鼠鼠种、角叉菜胶注射部位、注射浓度对建立模型的影响,通过组合最优因素,为形成稳定、良好的动物CNP模型提供了参考。后期我们将继续关注相关研究进展,从宏观和微观等角度,器官及细胞等水平探索CNP大鼠模型与临床的联系,为后期研究致病机制及相关治疗靶点提供新的思路和方法。

