卡瑞利珠单抗治疗原发性肝癌手术后患者的疗效及不良反应分析
顾莹,周静,宋佳烨
原发性肝癌为我国发病率较高的恶性肿瘤,多发于40~50 岁人群中[1]。临床上常采用射频消融术治疗原发性肝癌,通过释放高频率的射频电流来完成病灶区肿瘤细胞的杀灭操作[2]。目前,射频消融术术后多采用化疗杀灭体内的肿瘤细胞,以提高临床疗效[3]。GEMOX 方案(吉西他滨+奥沙利铂)为原发性肝癌术后常用的化疗方案,然而长时间使用会降低病灶肿瘤细胞的控制力,产生毒性反应[4]。近年来,以程序性死亡受体(programmed cell death protein 1, PD-1)为靶点的免疫抑制剂药物逐渐被临床肿瘤工作者认可[5]。卡瑞利珠单抗为一种PD-1阻断剂,可通过阻断PD-1 通路来增强机体抗肿瘤免疫力[6]。卡瑞利珠单抗联合GEMOX 方案化疗是否能改善原发性肝癌手术后患者临床疗效仍需进一步验证。鉴于此,本研究选取南通大学附属肿瘤医院收治的78 例原发性肝癌术后患者进行分析,以期为提高患者临床疗效提供参考依据。
1 对象与方法
1.1 研究对象 选取2017-2021 年南通大学附属肿瘤医院收治的78 例原发性肝癌患者作为研究对象,以数字表法随机将其分成观察组和对照组,每组各39 例。2 组患者一般资料存在可比性,差异无统计学意义(P>0.05)。见表1。纳入标准:(1)均符合原发性肝癌的诊断标准[7];(2)临床肿瘤分期(tumor, node, metastasis staging system, TNM)为Ⅱ期或Ⅲ期;(3)年龄≥18 岁;(4)均接受射频消融术治疗;(5)均签署知情同意书。排除标准:(1)对本研究治疗药物过敏者;(2)预计生存时间<3 个月者;(3)肝肾功能衰竭者;(4)存在手术禁忌证者;(5)合并其他肝脏组织病变者。本研究已通过院内医学伦理委员会批准。

表1 观察组与对照组患者一般资料比较(例)
1.2 研究方法 入院后,2 组患者均接受保肝、营养支持、补充水电解质、止吐等基础治疗及射频消融术治疗。对照组患者术后接受GEMOX 方案化疗。第1 天、第8 天均静脉滴注奥沙利铂(国药准字H20020648,成都长青制药有限公司)85 mg/m2、吉西他滨(国药准字H20113397,哈药集团生物工程有限公司)1 000 mg/m2,1 个周期为21 d。观察组患者在对照组的基础上接受卡瑞利珠单抗治疗。第1 天将200 mg 卡瑞利珠单抗(国药准字S20190027,苏州盛迪生物医药有限公司)加入0.9%氯化钠注射液(国药准字H20123141,宜昌三峡制药有限公司,100 ml)中,静脉滴注,1 个周期为21 d。2 组患者均持续治疗3 个周期。单抗治疗完成后持续按原方案化疗至患者不可耐受或疾病进展时终止。
1.3 观察指标 (1)临床疗效:治疗3 个周期后评估疗效,病灶大小未缩小,且病灶增大>25%记为疾病进展(progression disease, PD);无新病灶出现,且持续时间>1 个月,病灶增加≤25%或病灶缩小≤50%记为疾病稳定(stable disease, SD);病灶缩小>50%,且持续时间>1 个月记为部分缓解(partial remission, PR);病灶完全消失,且持续时间>1 个月记为完全缓解(complete remission,CR)。疾病控制率为SD、PR 及CR 占比之和[8]。(2)肿瘤标志物:治疗前后分别取患者4 ml 静脉血(空腹状态下),离心15 min(转速=3 500 r/min,半径=7 cm),收集其血清,通过放射免疫分析法测定糖类抗原199(carbohydrate antigen 199,CA199)、癌胚抗原(carcinoembryonic antigen, CEA)及甲胎蛋白(alpha-fetoprotein,AFP)水平,试剂盒购自上海高创化学科技有限公司。(3)上皮钙黏附素基因蛋白(epithelial-cadherin,E-cadherin, CDH1)与色素框同源蛋白7(chromobox protein homolog 7, CBX7):取上述患者血清,通过放射免疫分析法测定CDH1 与CBX7 水平,试剂盒购自武汉菲恩生物科技有限公司。(4)不良反应:依据参考文献[9],统计2 组患者不良反应情况。
1.4 统计学处理 应用SPSS 22.0 统计软件分析所得数据,符合正态分布的计量资料采用±s 表示,行t检验;计数资料采用例数和百分比(%)表示,行χ2检验,如果理论数T<1 或n<40,则用Fisher’s 检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 观察组与对照组患者临床疗效比较 观察组患者疾病控制率(79.49%)高于对照组(61.54%),差异有统计学意义(P<0.05)。见表2。
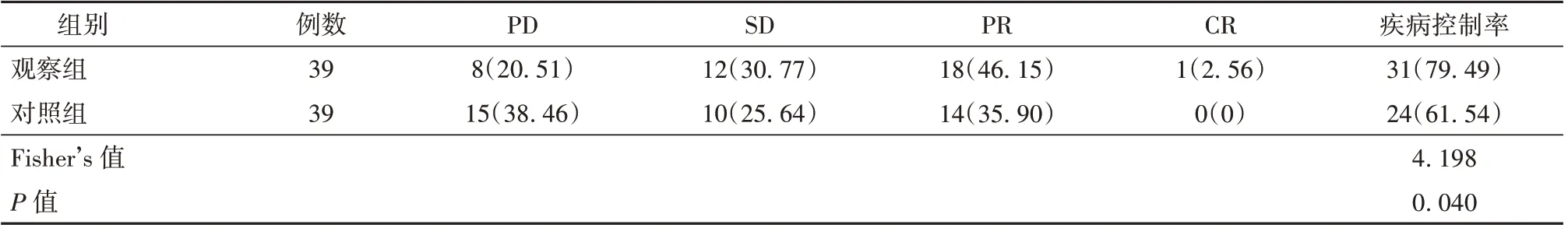
表2 观察组与对照组患者临床疗效比较[例(%)]
2.2 观察组与对照组患者肿瘤标志物水平比较治疗后,2 组患者血清CA199、CEA、AFP 水平均降低(P<0.05),且观察组更低(P<0.05)。见表3。
表3 观察组与对照组患者肿瘤标志物水平比较(±s)
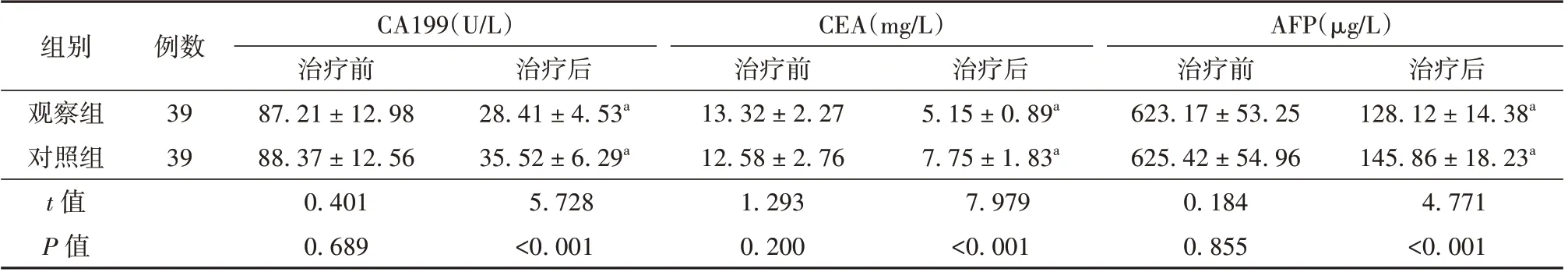
表3 观察组与对照组患者肿瘤标志物水平比较(±s)
注:与治疗前比较aP<0.05;CA199 为糖类抗原199,CEA 为癌胚抗原,AFP 为甲胎蛋白
组别观察组对照组t 值P 值例数39 39 CA199(U/L)治疗前87.21 ± 12.98 88.37 ± 12.56 0.401 0.689治疗后28.41 ± 4.53a 35.52 ± 6.29a 5.728<0.001 CEA(mg/L)治疗前13.32 ± 2.27 12.58 ± 2.76 1.293 0.200治疗后5.15 ± 0.89a 7.75 ± 1.83a 7.979<0.001 AFP(μg/L)治疗前623.17 ± 53.25 625.42 ± 54.96 0.184 0.855治疗后128.12 ± 14.38a 145.86 ± 18.23a 4.771<0.001
2.3 观察组与对照组患者CDH1 与CBX7 水平比较 治疗后,2 组患者血清CDH1、CBX7 水平均降低,且观察组更低,差异均有统计学意义(P<0.05)。见表4。
表4 观察组与对照组患者CDH1 与CBX7 水平比较(±s)
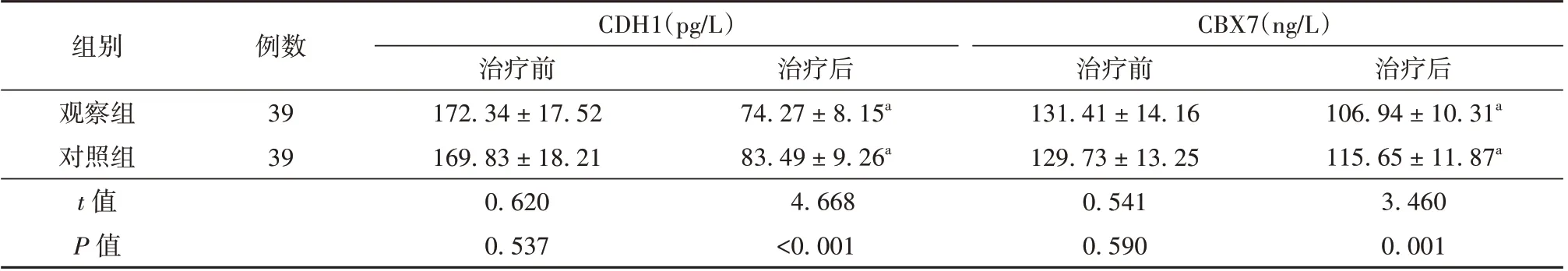
表4 观察组与对照组患者CDH1 与CBX7 水平比较(±s)
注:与治疗前比较aP<0.05;CDH1 为上皮钙黏附素基因蛋白,CBX7 为色素框同源蛋白7
组别观察组对照组t 值P 值例数39 39 CDH1(pg/L)治疗前172.34 ± 17.52 169.83 ± 18.21 0.620 0.537治疗后74.27 ± 8.15a 83.49 ± 9.26a 4.668<0.001 CBX7(ng/L)治疗前131.41 ± 14.16 129.73 ± 13.25 0.541 0.590治疗后106.94 ± 10.31a 115.65 ± 11.87a 3.460 0.001
2.4 观察组与对照组患者不良反应发生率比较 2 组患者Ⅰ~Ⅳ级胃肠道反应、骨髓抑制、肝肾功能损害发生率比较差异无统计学意义(P>0.05)。见表5。
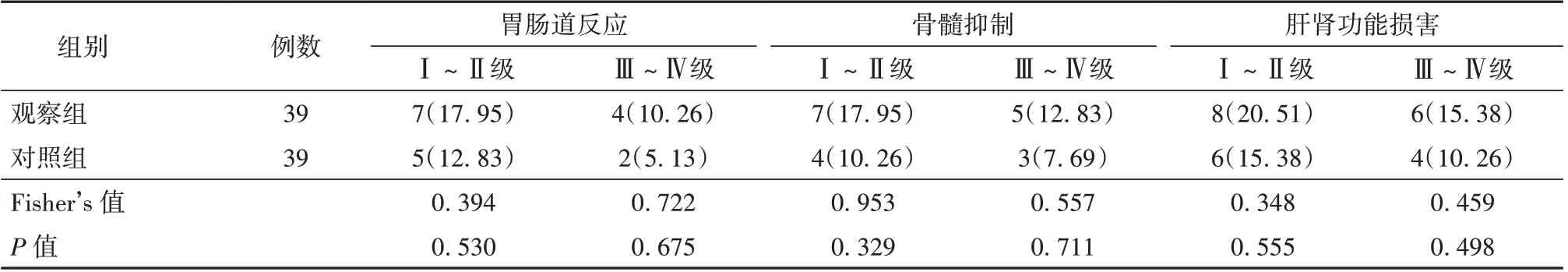
表5 观察组与对照组患者不良反应发生率比较[例(%)]
3 讨论
原发性肝癌早期无典型症状,多数患者确诊时已为中晚期,手术切除等单一的治疗手段控制肿瘤转移与增殖的难度较大[10]。射频消融术抑制病灶与常规开放式手术作用相当,前者能够减少手术的创伤性,但部分患者术后仍有残留病灶,需进一步化疗来增强疗效。相关研究表明,GEMOX 方案能够从多种途径发挥协同增效作用,能够共同抑制或杀灭肿瘤细胞,但奥沙利铂与吉西他滨均具有一定的毒性,长期使用存在耐受度低、毒性低等问题[11]。
程序性死亡配体1(programmed death-ligand 1,PD-L1)与PD-1 为免疫抑制分子,二者可通过抑制T 细胞炎症活动来调节机体免疫系统功能,其能够在阻断免疫系统杀死肿瘤细胞的同时预防自身免疫性疾病[12]。本研究中,观察组疾病控制率(79.49%)高于对照组(61.54%),提示卡瑞利珠单抗联合GEMOX 方案化疗可提高原发性肝癌手术后患者近期疗效,分析原因为卡瑞利珠单抗联合GEMOX 方案化疗能够降低肿瘤的血管生成,使化疗药物更好地靶向肿瘤细胞,同时GEMOX 方案化疗又可以通过杀灭肿瘤细胞来进一步控制肿瘤的生长和扩散,两者联合使用可以发挥协同作用,提高化疗效果。卡瑞利珠单抗给药后可分布于肺脏、肝脏等器官,具有一定的靶向性。本研究中,观察组患者治疗后血清CA199、CEA、AFP 水平明显低于对照组,提示卡瑞利珠单抗可降低原发性肝癌术后患者的肿瘤标志物水平,与既往研究[13]结果类似,从分子学角度明确了其具有良好的抗癌作用。CDH1 在人体中参与转录调节、信号转导等,在肿瘤细胞的黏附、生长、识别、分化等过程中具有重要意义[14]。CBX7 为一种转录抑制因子,能够参与细胞衰老过程,在肝癌等多种恶性肿瘤中呈高表达,其高水平可促进肿瘤的发生与发展[15]。本研究结果显示,观察组患者治疗后血清CDH1、CBX7 水平明显低于对照组,提示卡瑞利珠单抗可降低原发性肝癌手术后患者血清CDH1、CBX7 水平,可阻断原发性肝癌进一步恶化。本研究中,2 组患者不良反应发生率比较差异无统计学意义,提示卡瑞利珠单抗联合GEMOX 方案化疗治疗原发性肝癌手术后患者并不会显著增加患者不良反应,原因可能为相比于其他细胞毒类抗肿瘤药物,卡瑞利珠单抗属于人源化单克隆抗体,其对机体正常细胞的杀伤作用较小,但本研究中观察组患者Ⅰ~Ⅳ级胃肠道反应、骨髓抑制、肝肾功能损害发生率均高于对照组。随着后续样本量的增加,不良反应发生率可能存在一定的差异,仍需后续扩大样本量进一步验证。

