基于网络药理学和分子对接技术探究健脾化湿方治疗溃疡性结肠炎的作用机制
徐张扬,蒋蓓尔,万雨,闵天骄,刘光盛,何颖
溃疡性结肠炎(ulcerative colitis, UC)是一种慢性、病程较长且反复发病的肠道性炎症疾病,其发病机制目前尚未明确,临床表现主要有腹泻、大便黏稠、大便脓血等[1]。目前,UC 的临床治疗目标主要是控制或缓解症状,促进黏膜愈合,减少复发。现有治疗药物主要包括5-氨基水杨酸、类固醇、免疫抑制剂等。虽然中重症患者使用激素类药物起效快、疗效佳。然而,患者在治疗过程中易产生耐药、药物依赖和机会性感染[2-3],且对于轻症患者尤其是肝肾功能欠佳患者而言,药物产生的不良反应可能大于治疗效果[4]。因此,越来越多的患者和医生考虑替代医学方案治疗UC。在北美和欧洲地区,有21%~60%的临床医生采用替代医学方案治疗UC[5]。而中医治疗UC 具有独特的优势,可根据UC 的不同发病机制进行多层次、多角度的辨证论治。中药尤其是中药复方具有多靶点、整体调节等优势,其形式灵活多样,预后效果好,是替代医学方案的首选[6]。
中医将UC 归于“痢疾”“泄泻”“便血”等范畴,主要有“脾虚湿热”“肝旺脾弱”“脾胃虚弱”“脾肾阳虚”等症候[7]。本课题组基于中医基础理论,自拟了具有健脾止泻、缓解脾胃虚弱的健脾化湿方,该方由山药、陈皮、焦山楂、炒薏苡仁4 味药食同源的中药组成。本课题组前期实验证明,健脾化湿方能有效改善UC 小鼠肠道黏膜屏障功能,抑制白细胞介素(interleukin, IL)-1b、IL-6、肿瘤坏死因子-α(tumor necrosis factor, TNF-α)的表达。然而,健脾化湿方治疗UC 的分子机制尚未明确。由于中药具有多成分、多靶点、多通路的作用功效特点,网络药理学可基于大规模的生物信息学和化学信息学数据库,高效筛选和预测中药复方药物靶点,预测中药有效成分与相关靶点的作用机制。分子对接技术能够模拟复方中单一药物与靶点之间的相互作用,揭示药物与靶点的结合模式,从而弥补传统药理学不能系统阐述中药治疗UC 的缺点[8]。目前,已有研究开展如黄岑汤、葛根岑连汤、半夏泻心汤等多种传统中药方剂治疗UC 的网络药理学研究[9]。本研究采用网络药理学方法系统分析健脾化湿方治疗UC 的作用机制,并采用分子对接技术加以验证,为健脾化湿方治疗UC 以及后续实验提供理论依据和指导。
1 材料与方法
1.1 健脾化湿方活性成分及作用靶点筛选 分别以健脾化湿方所包含的单味中药(山药、山楂、陈皮、薏苡仁)为检索词,通过中药系统药理数据库和分析平台(https://old.tcmsp-e.com/tcmsp.php, TCMSP)检索其活性成分,以口服生物利用度(OB)≥30% 和类药性(DL)≥0.18 为筛选条件[10-11],并增加未纳入数据库但文献中已经报道具有生物活性和药理作用的成分。利用Drugbank 数据库(https://go.drugbank.com/)和TCMSP 收集活性成分相对应的作用靶点信息。
1.2 UC 潜在靶点预测 以“ulcerative colitis”为检索词,通过Genecards(https://www.genecards.org/)、OMIM(https://omim.org/)、DisGeNet(https://www.disgenet.org/)数据库,获取UC 相关靶点,以“relevance”(相关性)>5 作为筛选指标,对数据库内相关疾病靶点进行筛选,并应用于与健脾化湿方活性成分对应靶点的交集运算中,得到健脾化湿方治疗UC 的潜在作用靶点。
1.3 “药物活性成分-疾病-靶点”网络互作图构建及关键活性成分获取 将上述得到的交集靶点和健脾化湿方活性成分导入Cytoscapev 3.7.2 软件中,绘制健脾化湿方治疗UC 的“药物活性成分-疾病-靶点”网络互作图。随后利用软件中Centi-ScaPe 2.2 插件对网络进行拓扑学分析,依据“Degree”值筛选出健脾化湿方治疗UC 的关键活性成分。
1.4 蛋白质相互作用(protein-protein interaction,PPI)网络构建及核心靶点网络构建 利用String 数据库version 11.0(https://www.string-db.org/)对交集靶点进行PPI 分析,设置物种为“homosapiens”,high confidence≥0.700。随后利用Cytoscape 中的插件Cytohub 对PPI 网络进行拓扑学分析,以“Degree”值为筛选依据筛选核心靶点,并绘制核心靶点网络。
1.5 基因本体(gene ontology, GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)信号通路富集分析 首先通过R语言对交集靶点进行基因名称的转换,再利用Bioconductor(R) v3.8 对GO 和KEGG 信号通路进行富集分析,设定P<0.05,并将结果绘制成柱状图。
1.6 分子对接验证 选取PPI 网络图和“药物活性成分-疾病-靶点”网络互作图中Degree 值排名前5 位的核心靶点和关键活性成分进行分子对接验证,靶点信息从PDB(http://www1.rcsb.org/)数据库中获得,分别为肿瘤蛋白p53(TP53, PDB ID:1gzh)、肿瘤坏死因子(TNF, PDB ID: 1tnf)、原癌基因JUN(JUN, PDB ID: 2gmx)、苏氨酸激酶1(AKT1,PDB ID: 3qkl)、白细胞介素6(IL-6, PDB ID: 7dc8),关键活性成分从Pubchem 数据库(https://pubchem.ncbi.nlm.nih.gov/)中获取。使用Autodock Vina 2.4.6 进行分子对接,受体与配体之间的结合能力由能量打分函数来评估,其分值越小,表明受体配体之间结合能(binding energy, kJ/mol)越强。对接结果由热图进行展示,结合能<-37.67kJ/mol 的结构利用Pymol 2.0 进行可视化展示。
2 结果与分析
2.1 健脾化湿方关键活性成分 通过在线数据库和文献检索等方式,依据OB 和DL 值进行筛选,共得到健脾化湿方有效活性成分36 个,其中山药16 个,陈皮5 个,山楂6 个,薏苡仁9 个,以及对应的作用靶点122 个。通过在线数据库,依据“relevance”进行筛选,共获得UC 疾病靶点440 个。将二者进行韦恩图分析后,共得到交集靶点75 个,结果见图1。
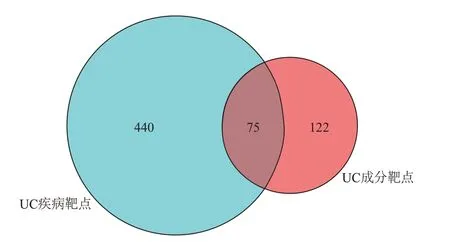
图1 药物靶点和疾病靶点韦恩图
2.2 健脾化湿方“药物活性成分-疾病-靶点”网络互作图 利用交集靶点、药物活性成分、疾病靶点构建“药物活性成分-疾病-靶点”网络互作图,结果见图2,图2 中共包括98 个节点和254 条边。根据Degree 值对药物活性成分进行排序,Degree 值为网络中某一节点与其他节点的连接数目,用于判断该节点在网络中的重要程度,节点的Degree 值越大表明其参与的生物功能越多,其生物学重要性越强。本研究中筛选出排名前5 位的关键活性成分分别为槲皮素、山奈酚、川陈皮素、薯蓣皂素、柚皮素。
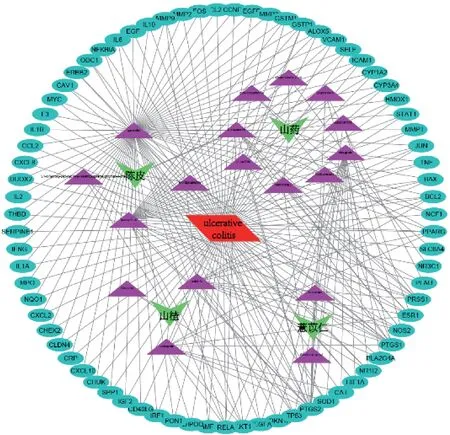
图2 “药物活性成分-疾病-靶点”网络互作图
2.3 交集靶点蛋白质网络互作图(PPI)及核心靶点网络 将获得的75 个交集靶点导入String 数据库进行蛋白质互作分析,物种选择为“homo species”,靶点关联的置信度为0.7,从而得到交集靶点的蛋白质网络互作关系,见图3。将蛋白质互作关系导入软件Cytoscapev3.7.2 中,利用插件Cytohub,以“Degree”值为筛选依据,得出排名前10 位的交集靶点互作图,并以此作为核心靶点网络,结果见图4。由图4 可知,健脾化湿方可能通过作用于IL-6、TNF、AKT1、TP53、JUN、血管内皮生长因子A(vascular endothelial growth factor, VEGFA)、IL-1、CXC模体趋化因子配体 8(CXC chemokine ligand 8, CXCL8)、趋化因子配体2(C-C motif 2, CCL2)、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2, PTGS2)等基因,从而发挥治疗UC 的作用。
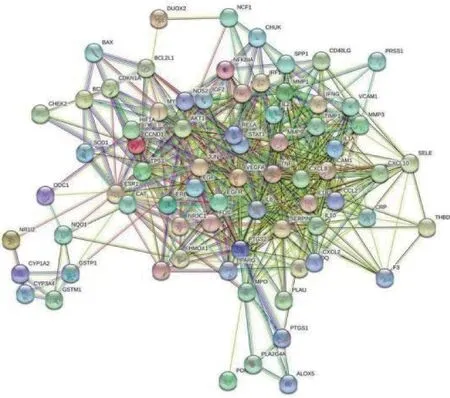
图3 交集靶点蛋白互作网络图
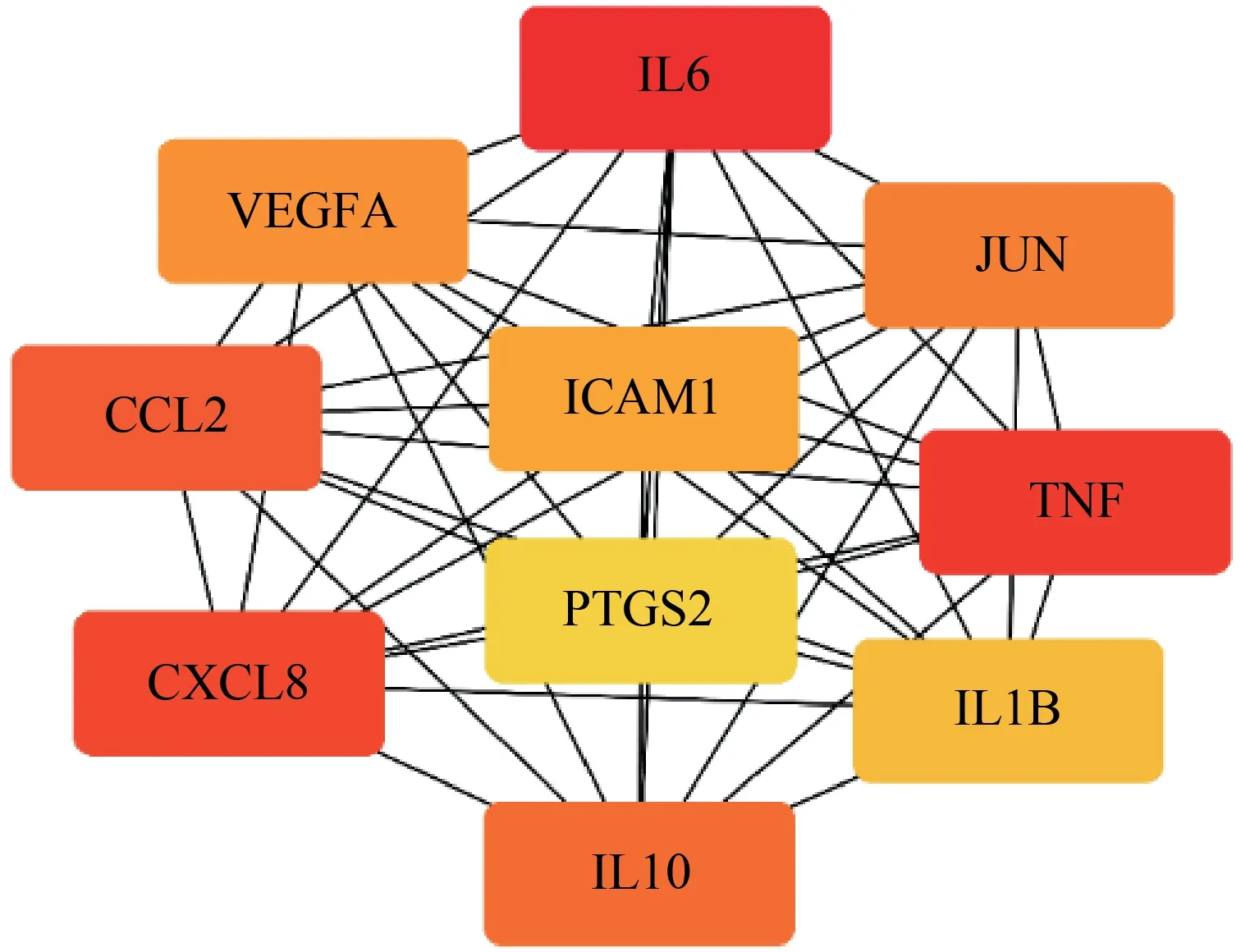
图4 核心靶点蛋白互作网络图
2.4 交集靶点GO 和KEGG 分析结果 利用R 语言对交集靶点进行GO 和KEGG 信号通路富集分析,共得到1 887 条GO 条目和135 条信号通路。依据P值大小,选取了排名前10 位的GO 条目和前20 位的KEGG 信号通路并以柱状图进行展示。见图5。其中涉及的生物过程主要有活性氧代谢、氧化应激反应、细胞内化学应激反应等。由图6 可知,交集靶点主要富集在流体剪切应力与动脉粥样硬化信号通路、糖尿病并发症AGE-RAGE 信号通路、TNF 信号通路、IL-17 信号通路、缺氧诱导因子1信号通路等。以上结果与核心靶点相互印证,表明健脾化湿方可通过抗氧化应激和免疫调节治疗UC。

图5 交集靶点GO 生物过程分析
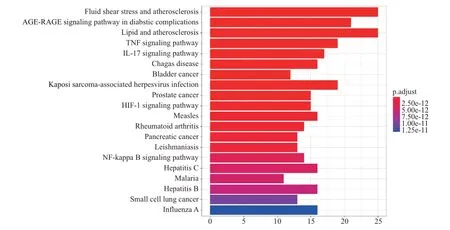
图6 交集靶点KEGG 信号通路结果
2.5 分子对接结果 利用Auto Dock 4.2.6 将TP53、TNF、JUN、AKT1、IL-6 与槲皮素、山奈酚、川陈皮素、薯蓣皂素、柚皮素进行分子对接。对接结果见表1。健脾化湿方的核心成分与TP53、TNF、JUN、AKT1 和IL-6 的结合能均小于-25.08 kJ/mol。其中薯蓣皂素和AKT1、TNF、IL-6 具有较高的结合能力,结合能分别为-39.71、-45.56、-43.47 kJ/mol。另外,山奈酚与TNF(- 38.46 kJ/mol)、IL - 6(-38.87 kJ/mol),槲皮素与TNF(-38.04 kJ/mol)、IL-6(-38.87 kJ/mol),柚皮素与IL-6(-38.87 kJ/mol)均有较强的结合能力。通过Pymol 2.0 软件,选择与核心靶点蛋白结合能最低的药效成分进行分子对接,并进行可视化分析,见图7。分子虚拟对接结果表明,化合物均能与靶蛋白的氨基酸残基形成氢键,稳定结合在靶蛋白的活性口袋中。其中,结合能最强的TNF-α 通过2 个氢键与薯蓣皂素上的LYS-98、GLU-116 相结合;IL-6 通过5 个氢键与槲皮素上的THR-33、HIS-56、PHE-298、LEU-100A、TRP-100C 相结合;AKT 通过1 个氢键与薯蓣皂素上的GLU-191 相结合。分子虚拟对接实验结果验证了网络药理学结果的可靠性。

表1 健脾化湿方5 种种主要成分和5 种核心蛋白的对接分数(kJ/mol)

图7 分子对接3D 示意图
3 讨论
UC 是一种特发性、慢性的结肠黏膜炎症性疾病,起于直肠,通常以连续的方式向近端延伸至部分或整个结肠[1,12],其症状主要表现为脓血便、里急后重、腹痛、腹泻等。中医通常将UC 划归于“泄泻”“大肠泄”“便血”“痢疾”“滞下”等范畴,其病因主要有感受外邪、饮食不节、正气虚损、情志失调等。本研究涉及的健脾化湿方由山药、陈皮、山楂、薏苡仁4 味药食同源中药材组成,具有益气养阴、消积化滞、活血化瘀等功效,能够缓解UC 所引发的脾胃虚弱、寒湿瘀积、气血不畅等症状。本课题组前期建立UC 小鼠模型,在动物水平上证明健脾化湿方能够通过抑制炎症和增强肠上皮连接的稳定性缓解UC。基于此,本研究利用网络药理学与分子对接技术进一步探究该方治疗UC 潜在的分子作用机制。
研究结果表明,槲皮素、山奈酚、川陈皮素、薯蓣皂素、柚皮素在健脾化湿方调控UC 的过程中起到了主要作用,但上述天然产物的含量需进一步实验探究。槲皮素是一种天然黄酮类化合物,具有抗糖尿病、抗阿尔兹海默病、抗肿瘤、抗流感病毒、抗关节炎等功效。林瑞等[13]发现膳食补充30 mg/kg槲皮素能够抑制小鼠结肠组织中促炎因子的产生,如IL-17、IL-6、TNF-α,促进抑炎因子IL-10 的产生,缓解由硫酸葡聚糖钠盐(dextran sulfate, DSS)诱导的UC。此外,槲皮素还能够增加结肠肠道益生菌(拟杆菌、双歧杆菌、乳杆菌)的数量,恢复肠道宿主-微生物的平衡关系;山奈酚同属于黄酮类物质,具有防癌、抗癌、抗炎、抗氧化、抗菌、抗病毒等多种功效。Bian 等[14]发现,在肠道上皮-内皮细胞共培养模型中,80 μm 山奈酚可通过抑制核因子κB(NF-κB)信号通路激活,减轻1 μg/ml 脂多糖诱导的跨上皮电阻(TEER)降低和白细胞介素8(IL-8)过表达。
当结合能小于-17.78 kJ/mol 时,配体与受体之间存在一定的结合活性;当结合能小于-20.92 kJ/mol 时,配体与受体之间存在较好的结合活性;当结合能小于-29.30 kJ/mol 时,配体与受体之间具有较强的结合活性[15]。本研究分子对接结果显示,健脾化湿方核心成分与核心靶点的亲和力普遍较高。健脾化湿方核心成分槲皮素、山奈酚、川陈皮素、薯蓣皂素、柚皮素与IL-6 和TNF-α 均有较强的结合能力。进一步证明了健脾化湿方核心成分能够与核心靶点相互作用缓解UC 症状,尤其是抗炎通路,结果与上述前人研究相互印证,同时与本课题组前期实验结果一致,即健脾化湿方能够通过抑制促炎因子或调节肠道菌群缓解DSS 诱导的UC。
本研究蛋白互作网络图的进一步分析结果显示,促炎细胞因子(IL-6、TNF-α、IL-1b、CXCL8、CCL2)和抑炎细胞因子IL-10 参与了肠内稳态和炎症肠病相关的病理过程。IL-6 作为一种重要的炎症介质,主要作用于间充质细胞和上皮细胞,通过募集多形核白细胞和巨噬细胞实现伤口愈合。在20 550 例克罗恩疾病患者、17 647 例UC 患者的全基因组Meta 分析中发现,通过阻断IL-6 受体的治疗方法可有效缓解肠道炎症[16]。趋化因子作为一种分泌蛋白,主要用于调节免疫细胞在组织中的迁移和定位,在固有免疫反应中起到关键作用[17]。另外,相关研究显示UC 患者结肠黏膜中CXCL8 和CCL2 表达水平显著高于健康对照组[18]。TNF 作为炎症性肠病致病机制中的另一个关键细胞因子,能够诱导肠上皮细胞凋亡[19]。ICAM-1 为一种免疫球蛋白家族的跨膜糖蛋白,在发生局部炎症的结肠组织中,在TNF-α、IL-1β 和IFN-γ 等促炎因子的刺激下表达上调,可募集如巨噬细胞和粒细胞此类炎症免疫细胞,发挥免疫调节作用[20-21]。
本研究生物过程富集结果显示,健脾化湿方主要通过“活性氧代谢”“氧化应激”等过程缓解UC 症状。研究表明,胃肠道易受到活性氧(reactive oxygen species, ROS)的攻击,ROS 的产生与消除之间的平衡变化引发的氧化应激反应是胃肠道黏膜疾病的重要发病机制之一[22]。局部炎症发生时,中性粒细胞和巨噬细胞浸润肠黏膜,释放大量的ROS 和细胞因子,包括IL-6、IL-1b 和TNF-α,导致DNA、蛋白质和脂质氧化损伤,最终促进UC 的发展[23]。青蒿素能够显著抑制线粒体ROS 的产生并组织NOD样受体热蛋白结构域相关蛋白3NLRP3 炎症小体的组装与激活,从而减少IL-1b[24]。此外,生物过程富集结果还提示了“response to lipopoly saccharide”在治疗中发挥的作用。脂多糖是革兰氏阴性菌外膜的主要组成部分,在宿主-病原微生物和固有免疫系统的相互作用及炎症性疾病的发生发展中起到关键作用[25]。脂多糖主要通过抑制肠道功能恢复和刺激促炎细胞因子的释放来破坏肠黏膜屏障的完整性[26]。
本研究KEGG 信号通路富集结果则表明,免疫调节相关通路可能是健脾化湿方治疗UC 的潜在通路,如TNF 信号通路、IL-17 信号通路、氧诱导因子-1(hypoxia-inducible factor-1, HIF-1)信号通路等。IL-17 是肠道炎症发病机制中一个关键炎症因子,在UC 患者的肠道黏膜中呈现上调的表达趋势,其病情严重程度也与外周血中IL-17 表达水平呈正相关[27]。体外培育牛黄可能通过抑制IL-17/IL-17RA/Act1 通路,降低炎症因子和趋化因子表达,从而改善DSS 诱导的UC[28]。
辅助性T 细胞17(thelper cell 17, Th17)被认为是UC 发病过程中的关键效应T 细胞,主要分泌IL-17 发挥肠道免疫调节。有关实验表明,T 细胞的可塑性,尤其是Th1-Th17 轴和Th17-Treg 轴的可塑性在调节肠道免疫反应方面发挥着重要作用[29]。木樨草素可通过调节平衡Th1/Th2 和Th17/Treg 数量改善小鼠肠道炎症并加速肠黏膜愈合[30]。HIF-1 是调节体内氧稳定性的重要转录因子。在生理状态下,肠道黏膜中的HIF-1 表达较低或未表达。而在病理状态下,如发生缺氧应激时,血液重新分配导致肠道血液灌流量急剧下降,引起局部缺血缺氧,从而导致HIF-1 的表达增加,并伴随炎症介质(如TNF-α 和IL-6)的增多,进而加速炎症性肠病的发生[31]。黄岑汤能够通过调节肠道菌群和抑制Ras-PI3K-Akt-HIF-1α、 NF-κB 信号通路缓解小鼠UC 症状[32]。因此,健脾化湿方可能通过抗炎、抗氧化和免疫调节途径治疗UC。
综上所述,槲皮素、山奈酚、川陈皮素、薯蓣皂素和柚皮素可能是健脾化湿方的主要活性成分。IL-6、TNF、IL-1β、CXCL8、CCL2、IL-10 等细胞因子可能是健脾化湿方治疗UC 的潜在靶点。此外,健脾化湿方可能通过调节免疫系统和炎症相关通路中细胞因子的平衡,如IL-17 通路和Th17 细胞分化通路治疗UC。本研究基于网络药理学和分子对接技术对健脾化湿方缓解UC 的分子作用机制进行了初步研究,为深入研究其分子机制提供了思路和方向。但本研究仍存在一定的局限性。一方面,本研究主要讨论已经过实验验证和用于临床治疗的靶基因,可能会遗漏未经过实验验证的潜在治疗靶点。另一方面,本研究缺少对潜在治疗信号通路的实验验证。后续本课题组将结合前期动物实验结果,从免疫调节和抑制炎症着手,阐明健脾化湿方治疗UC 的分子机制。

