PDCA 循环法在某院药物临床试验资料管理工作中的应用
王贝贝,于娟,蔡国伟,张桂芹,丁长玲,王玉玖
1.滨州医学院附属医院国家药物临床试验机构,山东滨州 256600;2.滨州医学院附属医院皮肤性病科,山东滨州 256600;3.滨州医学院附属医院临床试验伦理委员会,山东滨州 256600
在临床上,研发的药物要想正常使用,需要先进行临床试验,环节和程序十分复杂,涉及到的信息很多,因此产生大量的试验资料。对于这部分资料的管理一直是临床工作的重点内容,也是后期对试验过程进行反思和调整的基础依据。但实际上,从很多医院开展的相关工作进行分析,药物临床试验资料管理工作凸显出一定的问题,比如资料不全面、归档不规范、书写内容不够详细等。这会影响到临床其他工作的开展,甚至影响到研发药物的上市。为了解决这个问题,有研究人员提出应用PDCA 循环法进行药物临床试验资料管理,研究结果显示该方法有良好的管理效果[1]。本次研究选择2020 年1 月—2021 年12 月期间滨州医学院附属医院开展药物临床试验资料管理的工作人员442 名为研究对象,探讨PDCA 循环法的应用效果。现报道如下。
1 资料与方法
1.1 一般资料
选择2020 年1—12 月本院在未实施PDCA 循环法之前涉及到药物临床试验工作的工作人员210名,列为对照组。然后选择在2021 年1—12 月实施PDCA 循环法之后的相关工作人员232 名,列为研究组。对照组中男114 名,女96 名;年龄28~44 岁,平均(35.4±5.3)岁;工作年限4~16 年,平均(9.3±2.4)年。研究组中男127 名,女105 名;年龄27~46岁,平均(35.2±4.3)岁;工作年限4~18 年,平均(10.5±3.7)年。对比两组工作人员的基础资料,差异无统计学意义(P>0.05)。具有可比性。
1.2 方法
对照组:采取常规管理方法。根据医院制订的药物临床试验相关管理制度,约束医务人员的行为,配合考核机制的应用;定期组织考核工作,根据考核结果进行奖惩;鼓励医务人员自主学习,不断学习药物临床试验相关的知识内容;等等。
研究组:采取PDCA 管理方法,具体内容如下:(1)Plan(计划)阶段。分析问题,制订解决方案。药物临床试验机构办公室工作人员专门开会讨论或者是通过问卷调查形式,回顾过往归档的药物临床试验资料管理情况,根据实际操作以及将来临床试验规范化管理的趋势,从场地、人员、制度等方面,分析出当前临床试验资料管理中存在的问题,以此为基础展开分析,明确导致问题出现的具体原因,针对原因进行解决和排除,制订科学的改变计划,调整工作方案。比如结合药物临床试验质量管理规范及相关档案资料管理要点,修订临床试验资料的管理制度及标准操作规程[2]。(2)Do(实施)阶段。贯彻落实,坚决执行方案。①要确保有足够的资料存储空间,配备有专门的加锁文件柜,资料室能实现防火、防盗、防潮、防霉、防虫等安全措施。②根据《药物临床试验质量管理规范》等相关法规,结合实际情况,修订机构药物临床试验档案资料管理制度和标准操作规程,要求内容详细、具体,具有可操作性,要涵盖项目从最初机构立项到试验启动运行、试验结束归档整个临床试验过程[3]。③还要加强机构专职资料管理员的专业知识培训,让其掌握药物临床试验资料管理的相关要求,提高资料管理专业知识和水平,不断改进管理中的不足[4]。④要建设临床试验原始资料电子信息化查询系统。(3)Check(检查)阶段。定期检查,发现问题。药物临床试验进行中的资料收集是整个资料管理的关键。机构资料管理员对于进行中的临床试验项目,要和项目研究者、监查员等密切联系,了解项目进展情况,定期检查专业组临床试验档案资料管理是否规范,是否遵循机构新修订的资料管理制度及标准操作规程。(4)Action(总结、处理)阶段。肯定有效方法,总结经验巩固成绩。在实践过程中要对有效的方法加以肯定、总结,把效果好的提炼为标准,形成标准化模式坚决执行下去。对于在实践中发现的新问题或没有解决的问题,转入下一循环,要再次组织大家进行探讨、分析,找出原因,研究如何解决,促使临床试验资料管理持续规范化改进[5]。
1.3 观察指标
①对两组的药物临床试验资料管理工作进行评估,记录医务人员出现的病例报告记录不规范、方案偏离、不良事件上报问题、试验药物管理问题及知情同意问题等相关问题的发生情况。
②对比两组药物临床资料管理方面的完整性合格率,分为准备、进行和完成3 个阶段。
1.4 统计方法
使用SPSS 25.0 统计学软件分析数据,数据采取频数(n)和百分比(%)表示,组间比较行χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组工作人员药物临床试验资料管理问题发生情况对比
研究组的病例报告记录不规范、方案偏离、不良事件上报问题、试验药物的管理问题以及知情同意问题等问题总发生率远低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组工作人员药物临床试验资料管理问题发生情况对比
2.2 两组工作人员药物临床试验资料完整性合格率对比
在准备阶段,两组的资料完整性合格率对比,差异无统计学意义(P>0.05),而在进行和完成阶段,研究组的资料完整性合格率远高于对照组,差异有统计学意义(P<0.05)。见表2。
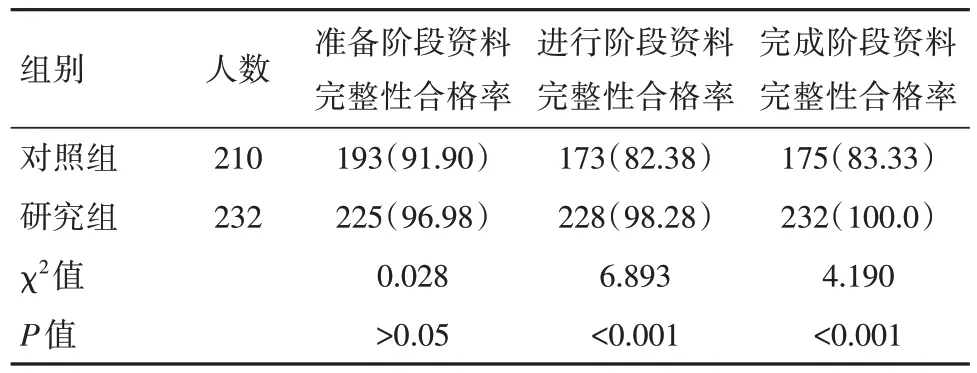
表2 两组工作人员药物临床试验资料完整性合格率对比[n(%)]
3 讨论
本医疗机构于2013 年5 月通过原国家食品药品监督管理总局认定,获得药物临床试验机构资格,目前有10 个备案的药物专业组。机构配备有专门的资料室用于存放结束后的所有档案资料,同时安排专人负责进行这部分档案资料的管理。截止目前,本院已经承接了200 余项临床试验,其中有50 余项已经结束,结束后项目的资料已存放在机构资料室。并且随着新专业组认定工作的开展,后期本机构将承接越来越多的临床试验,临床试验资料也是越积越多。在临床试验进行前、临床试验进行中对资料的收集、整理的完整性、准确性、系统性以及临床试验结束后资料归档的及时性,及存储空间是否能够满足后续需求都是需要面临的严峻考验[6-8]。
新时期,因为药物临床试验的重要性突出,需要单位有一定的资质才能进行,所以对其资格认定的检查更加严格和广泛[9]。同时,对于新研发的药物,也提出就审批结果进行现场核查的工作要求。在这个背景下,相应资料管理工作逐渐凸显出一些问题,具体如下:归档不及时,管理制度不完善,归档资料的存放空间不足,资料管理意识不强,档案管理信息化程度不高等。基于上述问题的存在以及对医院实际工作情况的考量,本机构不断探索先进的药物临床试验资料管理方法,尝试新的管理理念和措施,并总结和优化具体的管理措施。本次研究主要是提出PDCA 循环法的应用[10]。PDCA 循环是各个管理领域应用广泛的模式,将管理工作划分成4 部分,分别是计划、执行、检查、处理,要求管理工作按照这个步骤进行,不断发现存在的问题,然后纳入下一个循环进行解决,实现管理质量的螺旋式提升[11-12]。
研究结果显示,研究组的病例报告记录不规范、方案偏离、不良事件上报问题、试验药物的管理问题以及知情同意问题等问题总发生率为1.29%,远低于对照组的10.0%(P<0.05);这意味着进行PDCA 循环法管理可以及时发现医务人员在临床试验资料管理工作中存在的各项问题,并提出可行的解决措施,将发现的问题解决之后,相关问题的发生率会显著降低。同时,研究结果显示,在准备阶段,两组的资料完整性合格率对比,差异无统计学意义(P>0.05),而在进行和完成阶段,研究组的资料完整性合格率远高于对照组(P<0.05);这意味着进行PDCA 循环法管理可以提高医务人员的责任意识,使他们在临床试验各个阶段的资料管理工作中做好资料信息的收集、整理和归纳工作,从而保证资料的完整性和合格率。

