睡眠时间对慢性肾脏病的影响及其机制的研究进展▲
陈泽平 马华林
暨南大学第二临床医学院,广东省深圳市 518000
【提要】 慢性肾脏病(CKD)正在成为全球主要的公共卫生问题,其带来的社会和经济负担是巨大的。近年来,越多越多的文献分析了睡眠时间与CKD之间的关联,但得到的结果并不完全一致。本文结合相关文献资料,对过短或过长的睡眠时间对肾脏疾病的不利影响及其可能机制进行综述。
慢性肾脏病(chronic kidney disease ,CKD)正在成为全球主要的公共卫生问题。在30岁以上的人群中,CKD的中位患病率为7.2%,在64岁以上的人群中,各国的CKD患病率多在23.4%到35.8%之间[1]。CKD带来的社会和经济负担是巨大的,不仅包括昂贵的肾脏替代治疗,还包括更差的生活质量与更高的心血管事件发生率、死亡率、全因死亡率[2-4]。因此,确定新的预防策略对于降低CKD风险及其心血管疾病的发病率和死亡率至关重要。
近几十年来,越来越多的证据表明,睡眠时间是影响代谢健康的危险因素。根据美国国家睡眠基金会推荐的睡眠时间,成年人的正常睡眠时间为7~9 h,老年人的正常睡眠时间为7~8 h[5]。流行病学证据表明,过短或过长的睡眠时间可对机体产生不利影响,导致多种疾病,包括肥胖、糖尿病、高血压、心血管疾病等[6-11]。至于睡眠时间与CKD之间的关联,睡眠时间缩短对肾脏的不利影响更为明确,多数研究已证实短睡眠时间与蛋白尿[12]、低估算肾小球滤过率(estimate glomerular filtration rate, eGFR)[13]、CKD、终末期肾脏病(end-stage renal disease,ESRD )[14]相关。而睡眠时间延长与CKD之间的关联并不明确,有研究认为睡眠时间延长与低eGFR[15]或CKD[16]的高患病率有关,也有部分研究提出了不同意见,认为两者之间没有关联[13,17]。因此,本综述主要通过检索大量相关的文献,探讨睡眠时间对CKD的影响,并总结归纳两者之间的可能机制,以此推断是否可通过改善睡眠时间来降低人群中CKD的发病率和死亡率。
1 睡眠时间对CKD的影响
改善全球肾脏病预后组织指南指出,在反映肾功能的指标中,低肾小球滤过率(glomerular filtration rate, GFR)和白蛋白尿是肾脏损害的标志,尿白蛋白水平升高可独立预测一般人群的肾功能损害的进展[18-19]。目前的研究多用这两项指标来反映肾功能,并通过直接研究睡眠时间与CKD/ESRD的发病率的关联性来验证不恰当的睡眠时间是否对肾脏造成不良影响。
1.1 睡眠时间与蛋白尿 尿蛋白有定量和定性两种检测方法,不同的检测方法可对最终的结果产生不同的影响。应用定性法检测尿蛋白(将蛋白尿定义为通过试纸法测得的尿蛋白≥1+)的研究结果表明[20-22],睡眠时间缩短的研究对象有更高的蛋白尿风险,并独立于其他危险因素,但在睡眠时间延长的研究对象中,并未观察到此类不良后果。应用定量法检测尿蛋白[将蛋白尿定义为尿白蛋白/肌酐比值(urine albumin creatine ratio,UACR)≥30 mg/g]的研究结果表明[12,23-25],睡眠时间过短或过长均会导致更高的蛋白尿风险,睡眠时间与UACR之间存在U形关联,见表1。
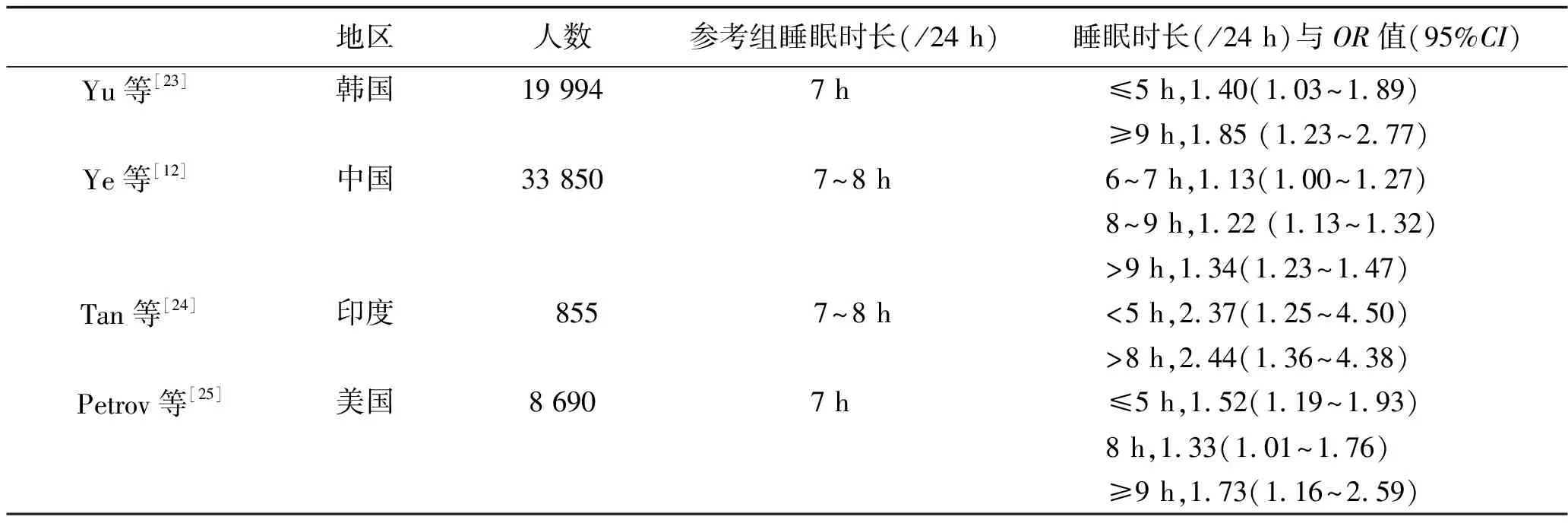
表1 睡眠时间与UACR呈U形关联
定性法(如试纸法)只能检测白蛋白,灵敏度不足以检测其他蛋白质,如本周蛋白、球蛋白等。当尿试纸条出现1+阳性时,尿白蛋白的排出量大于300 mg/L,已达到临床白蛋白尿水平,这样的灵敏度无法检测出早期肾损伤[26]。该检测方法在很大程度上取决于尿液中的蛋白质浓度,并不能反映蛋白质的排泄率,当尿量多且尿液稀释时可能会出现假阴性结果,而当尿量少且尿液浓缩时可能会出现假阳性结果[27]。现在多推荐使用UACR进行尿蛋白的评估,其能发现尿蛋白处于微量白蛋白尿的阶段(即30~300 mg/g之间),能更好地反映早期肾损伤。
1.2 睡眠时间与GFR和eGFR 睡眠时间缩短可导致eGFR更快地下降。一项对4 238名美国护士进行的健康研究(前瞻性队列研究)[13]的结果显示,与每晚睡眠时间7~8 h的参与者相比,每晚睡眠时间6 h、5 h或更短时间的参与者肾功能快速下降的风险更大,不同睡眠时间的参与者eGFR下降的速度分别为1.2 mL/(min·1.73 m2·年)(睡眠时间不超过5 h)、0.9 mL/(min·1.73 m2·年)(睡眠时间6 h)、0.8 mL/(min·1.73 m2·年)(睡眠时间7~8 h)、0.8 mL/(min·1.73 m2·年)(睡眠时间超过9 h)。另一项CKD患者的前瞻性队列研究也报告了相同的结果[28]。但两项研究均存在着明显的局限性,即研究的主体是某一特定的群体(护士或CKD患者),在反映总人群睡眠时间与GFR的关系方面缺乏一定的代表性。另外,更多研究指出过短或过长的睡眠时间均可导致GFR增加,即肾小球超滤,提示肾脏不良结局[25, 29-31]。体内存在过多的蛋白质,肾小球排泄超负荷蛋白质会增加GFR,这种能力称为肾功能储备;肾功能储备的丢失是CKD的特征,因为无法通过继续增加GFR来应对蛋白质超负荷,最终导致CKD的进展[32-33]。一般情况下,GFR会随正常衰老而不可避免地下降,通常在30~40岁之后开始下降,50~60岁后下降速度可能会加快。这种下降似乎是细胞和器官衰老的正常生理过程的一部分[34]。为了排除年龄因素导致的生理性GFR下降或合并基础肾功能不全的参与者对结果产生混杂影响, Ye等[12]将全部参与者分成两组:正常eGFR组[eGFR≥90 mL/(min·1.73 m2)]和低eGFR组[eGFR<90 mL/(min·1.73 m2)]。在正常eGFR组中,eGFR值与睡眠时间呈U形关联,与睡眠时间7~8 h的参考组相比,睡眠时间过长或过短均可导致肾小球超滤;在低eGFR组中,eGFR值与睡眠时间呈N形关系,eGFR值在7~8 h人群位于最高值,过长或过短的睡眠时间均会导致eGFR值的下降。这表明短睡眠时间和长睡眠时间都对肾功能有不良影响,对健康个体最初表现为肾小球超滤,对合并肾损伤的个体则表现为肾功能进行性下降。
1.3 睡眠时间与CKD风险 多数研究表明,与标准睡眠时间相比(多为7~8 h),过长或过短睡眠时间的参与者有着更高的CKD风险(如表2)[14, 35-39]。一篇分析了8项相关研究的荟萃分析结果也表明睡眠时间与CKD风险表现为U形关联,睡眠≤6 h/晚和≥8 h/晚的个体患CKD风险调整后的OR值分别为1.13(95%CI,1.02~1.25;I2=29%)和1.14(95%CI,1.07~1.22;I2=0%)[38]。另外,学者Park等[14]通过孟德尔随机化研究证实了睡眠时间缩短与肾功能下降之间存在因果关系。但关于睡眠时间与CKD风险之间的关联,还有其他不同的结果: Guo 等[17-18]的研究表明,睡眠时间较短的个体有更高的CKD风险,而睡眠时间延长与CKD之间无显著关联;而Kim等[16,24]的研究表明CKD的较高患病率仅与更长的睡眠时间相关。此外,针对不同性别的研究也出现不同的结果:Choi等[15]的研究表明,睡眠时间与CKD之间的关联仅存在于女性中,而Nakajima[40]的研究仅在男性参与者观察到睡眠时间与CKD的相关性。

表2 睡眠时间与CKD风险呈U形关联
CKD继续进展,可演变为ESRD。目前关于睡眠时间和ESRD风险的流行病学研究较少,并且结果不尽相同。例如, Geng等[41-42]的前瞻性队列研究证实了极短和极长的睡眠时间与ESRD的高发病率显著相关。而另外两项前瞻性队列研究[14,28]显示了矛盾的结果,即睡眠时间与ESRD患病率无显著相关性。据此前的横断面研究报告[43],晚期CKD可导致多种睡眠障碍的患病率升高,包括昼夜睡眠模式逆转、睡眠潜伏期延长,以及与睡眠呼吸暂停或不宁腿综合征相关的碎片化睡眠。与肾功能正常的个体相比,非透析依赖性CKD和ESRD患者出现睡眠问题则更为普遍。因此,对于ESRD患者,睡眠与肾脏疾病之间的双向因果关系较难区分,睡眠问题不仅是肾脏疾病的原因也是症状。未来还需要更多相关的研究,来验证肾脏疾病与睡眠问题之间的因果关系。
2 睡眠时间对CKD的影响机制
2.1 全身炎症反应和氧化应激 睡眠剥夺会增加白细胞介素(interleukin, IL)-6[44]、C反应蛋白(C reactive protein, CRP)[45]、白细胞[46]、肿瘤坏死因子-a(tumor necrosis factor, TNF-a)[47]水平,表现为全身炎症反应。例如Meier-Ewert等[45]的研究证实,不管是急性完全睡眠剥夺还是短期部分睡眠剥夺均可导致CRP浓度升高,而CRP是一种稳定性较好的炎症标志物。另外,动物实验表明睡眠剥夺会增加体内活性氧的含量,一旦活性氧等促氧化剂超过身体抗氧化系统的最大负荷,就会发生氧化应激[48]。睡眠时间的延长也被证实与全身炎症反应相关,一篇涉及72项研究的荟萃分析[49]结果表明,过长的睡眠时间与较高水平的CRP和IL-6相关,炎症相关信号通路的激活可能反映了极端睡眠时间影响健康的一种机制。持续的微炎症状态已被认为是CKD的一个重要组成部分,在其病理生理学中发挥着独特的作用,并在一定程度上可导致心血管疾病,增加全因死亡率。在一项CKD队列研究中,炎症标志物(IL-1β、IL-1受体拮抗剂、IL-6、TNF-α、CRP和纤维蛋白原)与肾功能指标呈负相关[50],这表明机体炎症反应可导致肾损害。褪黑素是松果体的主要产物,具有强效的抗氧化和抗炎作用,慢性肾功能衰竭可损伤松果体并影响褪黑素的产生。在大鼠实验中,褪黑素给药可减轻氧化应激水平和肾组织的炎症细胞浸润,从而延缓大鼠慢性肾功能衰竭的进程,这也间接表明氧化应激对肾脏的不利影响[48]。另外,ESRD(尿毒症)环境会使机体产生高度氧化应激反应[51],这也导致肾功能进一步恶化。
2.2 下丘脑-垂体-肾上腺轴激活 正常睡眠分为两个时相:快波睡眠和慢波睡眠。由一个慢波睡眠和一个快波睡眠组成睡眠周期,每个循环周期大约每90~110 min发生一次。前半夜慢波睡眠占优势,后半夜快波睡眠占优势[52]。下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)在保持机敏和调节睡眠中起重要作用。Born等[53]发现服用促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)或皮质醇可显著减少快波睡眠,同时增加清醒时间。而睡眠时间的异常也与HPA激活有关。Buckley认为睡眠剥夺可激活HPA[54],动物研究进一步表明,长期睡眠受损可能会导致HPA应激反应的基本神经内分泌变化[55]。睡眠时间延长与HPA之间的关联尚未明确。Späth-Schwalbe等[56]发现,早晨从睡眠到清醒的过渡,会刺激ACTH和皮质醇的释放;与短睡眠组相比,长睡眠组ACTH和皮质醇水平增加,说明睡眠时间的延长也可激活HPA。另外,有研究表明,睡眠时间的延长与碎片化睡眠、白天嗜睡和睡眠质量下降有关[57-58]。Patel等[59]发现,睡眠时间超过9 h者比正常睡眠者更容易打鼾,睡眠质量更差;睡眠质量差可增强HPA应激反应性,从而对机体产生不良影响[56]。综上,过短或过长的睡眠时间都可能激活HPA,使HPA的活性保持在较高水平,从而对健康代谢产生不利影响。并且,睡眠受损会增强HPA的分泌活动,而相关激素水平的升高又会反作用于睡眠[60],导致恶性循环。
2.3 交感神经激活 目前的研究已证实短睡眠时间激活交感神经系统而对肾脏产生不良影响,至于长睡眠时间与交感神经之间的关联仍不明确。在动物实验中,睡眠剥夺的大鼠有更高的血管紧张素(angiotensin,Ang)II[61]、ACTH、皮质醇、多巴胺和去甲肾上腺素水平[62],表明睡眠剥夺会增加大鼠的肾交感神经活动。在正常睡眠期间,特别是在非快速眼动睡眠期间,交感神经活动减少和迷走神经张力增加,这是夜间睡眠时血压下降的原因。因此,睡眠时间的减少可导致交感神经系统的激活并且弱化睡眠期间血压下降的现象[63-64]。相关研究表明,有多个可能的交感神经激活与肾脏之间的关联机制:(1)有研究发现,与血压正常的受试者相比,合并高血压的血液透析患者使用神经节阻滞剂异丙嗪后血压显著下降,表明交感神经过度活跃可能为慢性肾衰竭患者血压升高的重要原因[65-66]。(2)交感神经活动与左心室肥厚相关,CKD患者可表现出去甲肾上腺素和左心室肥厚之间的正相关关系[67],而去甲肾上腺素水平还与心力衰竭、心律失常、动脉粥样硬化有关[68-69]。因此,交感神经激活可增加心血管事件风险而对肾脏产生不良影响。(3)儿茶酚胺对肾脏损伤的直接作用,可能与β-肾上腺素能受体激活或肾小球单位中的足细胞功能受损有关。在动物实验中,对肾脏次全切除的大鼠使用低剂量的莫索尼定、α-肾上腺素能和β-肾上腺素能受体阻滞剂可改善肾损伤,也说明交感神经系统激活后释放儿茶酚胺可促进肾脏损伤[70-71]。
2.4 肾素-血管紧张素-醛固酮系统紊乱 肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)是众所周知的血压调节系统,它通过对心脏、血管和肾脏的协调作用来控制体液和电解质平衡。在RAAS的经典途径中,肾素由肾小球旁器分泌,作用于循环中的血管紧张素原,生成AngⅠ,Ang I对血压几乎没有影响, 其在肺中通过血管紧张素转换酶转化为Ang II,Ang II通过与G蛋白偶联受体1型和2型结合作用于心脏和肾脏[72]。RAAS与睡眠周期之间关系密切。先前的研究报告了不同睡眠时间的平均肾素活性水平,发现慢波睡眠时间肾素活性水平高,而在快波睡眠时间,肾素平均活动水平达到最低点[73-74]。Charloux等[75]发现在正常的夜间睡眠期间可观察到较高水平的醛固酮脉冲幅度,且从夜间转变为白天时,仍可观察到较高水平的醛固酮脉冲幅度和脉冲频率,证实了通常被认为是纯昼夜节律的24 h醛固酮节律受到睡眠-觉醒周期的强烈影响,RAAS与睡眠之间有着密切关联。多项研究表明睡眠结构的改变可导致RAAS的紊乱。在动物实验中[61],大鼠经历睡眠剥夺可观察到Ang II浓度的降低,表明了睡眠剥夺可导致RAAS发生紊乱;Kamperis等[76]的研究发现,睡眠剥夺的受试者有着更低的血浆肾素、Ang II和醛固酮水平,直接导致肾小管对钠的重吸收减少,明显增加了利尿作用。RAAS影响CKD的机制复杂,目前研究多集中在Ang II和醛固酮上[72]。在体内,Ang II所致的毛细血管内高压和肾小球超滤可导致慢性肾损伤;另外Ang II作为细胞因子可通过机体的免疫机制促进CKD的进展[77-78]。醛固酮通过盐皮质激素受体发挥作用,介导肾脏和心血管疾病的发生,已被证实与肾小球硬化和肾脏纤维化有关[79-80]。
2.5 昼夜节律改变 人的行为和生理活动在24 h内有着独特的生物节律,与昼夜循环同步,称为昼夜节律,对维持健康至关重要。Martino等[81]通过突变昼夜节律调节基因酪蛋白激酶-1ε构建动物模型并突变等位基因,将昼夜节律从野生型的24 h减少到+/tau杂合子的22 h,当+/tau杂合子的仓鼠处于24 h的昼夜节律时,慢性昼夜节律紊乱使杂合子动物表现出心肌间质纤维化、心肌肥厚和心功能障碍,导致心肌病和心力衰竭。除此之外,Martino等还观察到慢性昼夜节律紊乱所致的严重的肾脏病理表现,包括肾小管扩张、肾小球缺血性改变和肾脏广泛纤维化。而在适合其基因型的光周期(22 h)中,循环行为模式正常化,心肾表型逆转,心脏和肾脏显示正常的结构和功能。Martino等的研究结果表明,昼夜节律的长期紊乱(例如在轮班工人、跨洋乘务员或睡眠障碍患者中)可能更易导致心脏和肾脏疾病。昼夜节律由人体的生物钟系统所调控,生物钟可以分为两部分:位于下丘脑视交叉上核的中央时钟,以及位于全身各个组织中的外围时钟。外围时钟在它们各自的组织中发挥着不可或缺的独特作用,驱动各种生理功能的特定基因的昼夜节律的表达[82]。肾脏是一个重要的外围时钟,大多数肾脏生理过程,包括RAAS、肾血流量调节、肾小球滤过和肾小管重吸收等,遵循昼夜节律[75, 83-87]。动物研究表明,约43%的蛋白质编码基因的转录显示出昼夜节律波动,而仅肝脏的昼夜节律转录物总数超过肾脏(肝脏中约16%,肾脏中约13%),这表明肾脏存在强大的生物钟活动[88]。过短或过长的睡眠模式都会扰乱正常的生物节律,并对肾脏产生不良影响。肾功能昼夜节律的紊乱可能通过多种不同机制与高血压、免疫球蛋白A肾病、肾病综合征、肾纤维化和肾结石等疾病相关联[89],最终导致CKD,因此,保持正常的昼夜节律是预防这些疾病的重要长期生活方式。
2.6 其他 不恰当的睡眠时间可增加继发肾损害的危险因素,继而导致CKD。过长或过短的睡眠时间已被证明是多种代谢紊乱的危险因素,例如肥胖[90-91]、2型糖尿病[92-93]和高血压[94-95],而这些疾病也会导致肾脏疾病,且不受控制的糖尿病和/或高血压患者更容易发展为ESRD[96]。其机制可能为:在肥胖患者中,肾小球肥大和超滤可通过增加肾小球的毛细血管壁张力和降低足细胞密度来加速肾损伤[97];高血糖状态可通过超滤损伤、晚期糖基化终末产物蓄积等导致糖尿病肾病[98];而高血压可导致肾小球内高压,最终进展为肾小球硬化和肾功能受损[98]。此外,不宁腿综合征也与自我报告的较长睡眠时间有关,其或可通过激活交感神经系统导致蛋白尿[99]。
3 讨 论
本综述通过研究大量文献,分析了过短或过长的睡眠时间与CKD之间的关联。大多数人类研究的睡眠数据是由本人自我报告的主观睡眠时间,少部分是由多导睡眠监测或腕部活动记录仪测量到的客观睡眠时间。自我报告的主观睡眠时间可能存在偏差,尽管一些研究表明,自我报告的主观睡眠时间与仪器测量的客观睡眠时间中度相关[100],但主观睡眠数据不可避免地受到回忆或者反应偏差的影响,进而造成偏倚。
在反映肾功能的指标中,大部分文献集中讨论了睡眠时间与蛋白尿、GFR、CKD或ESRD之间的关联。然而,这些指标均存在一定的局限性。(1)关于蛋白尿:蛋白尿定义的不同的研究可以得到不同的结果,例如当蛋白尿被定义为尿蛋白≥1+时,睡眠时间延长与蛋白尿无关联,而当蛋白尿被定义为尿白蛋白/肌酐≥30 mg/g时,睡眠时间延长与蛋白尿之间有关联,提示不同的检测方法可对结果造成影响。(2)关于GFR:一方面,它可受到多个因素的影响,包括肌肉质量和蛋白质摄入量[101];另一方面,随着年龄增大,无论是否存在肾脏疾病,GFR都会降低,导致很难区分自身衰老因素对肾脏损伤的混杂影响。(3)大部分研究以CKD/ESRD作为结局指标,要证实睡眠时间是肾脏损伤的独立危险因素,需区分其余危险因素对肾脏的混杂影响。CKD的危险因素包括吸烟、肥胖、高血压和糖尿病,以及接触重金属、过量饮酒、使用镇痛药物史、急性肾损伤史、心血管疾病史、高脂血症、代谢综合征等[96]。临床上常见的肾损伤大都是多种危险因素共同作用的结果,针对肾功能不全的治疗也多强调肾脏一体化治疗,理想状态下通过完全排除其他危险因素来验证睡眠时间对肾脏的不良影响似乎是困难的。
尽管我们认为不恰当的睡眠时间与CKD有关,但部分研究报告了两者之间无关联甚至相反的结果。我们分析其原因包括以下几点:(1)研究样本多来自于局部地区或某医院、某体检中心,因此使用该数据得到研究的结果不一定能代表总人群。(2)部分研究主体存在可导致CKD的危险因素,例如高血压、糖尿病等,不能排除原发疾病对肾脏的混杂影响。(3)睡眠时间对健康结果的影响可能存在性别差异。据文献报告,中年女性的CKD患病率高于中年男性[102],睡眠不足的女性发生与蛋白尿相关的代谢紊乱的风险较男性更高[103-104]。因此,睡眠时间与CKD的关联在两性中可能表现出不同的结果。另一方面,有研究者观察到不同性别人群的社会学特征(如社会地位、受教育水平、经济水平等)存在差异,这些显著的差异不可避免对结果产生混杂影响。(4)上述研究人群来自不同种族(如东亚、印度、美国黑人等),在一定程度上无法消除种族因素对结果的混杂影响。(5)可能存在其他的对肾脏产生影响的混杂因素,例如抑郁、不健康行为、缺乏运动等,这些相关的混杂因素可能减弱睡眠时间与CKD之间的关联。
本综述还探讨了不恰当的睡眠时间对肾损伤的可能机制,推测全身炎症反应、HPA激活、交感神经激活、RAAS紊乱、昼夜节律紊乱等机制可能解释不恰当的睡眠时间对肾脏的不利影响。当前涉及不恰当的睡眠时间对肾损伤的文献较匮乏,未来还需要更多相关的文献来完善睡眠时间与CKD之间的可能机制。总之,过短或过长的睡眠时间均可对肾脏产生不利影响,合适的睡眠时间可预防慢性肾脏疾病的发生和发展。

