过磷酸钙反应原理再剖析
颜 鑫
(湖南化工职业技术学院化学工程学院 湖南株洲 412004)
化工生产中有些化学反应是一步完成的,有些分为两步、三步甚至多步才能完成,这些分步反应常有一个显著的特点,就是两步或多步反应相加应等于总反应。普通过磷酸钙(简称过磷酸钙,亦称普钙)是一种最常用的水溶性速效磷肥,主要成分是水合磷酸二氢钙[Ca(H2PO4)2·H2O,又称磷酸一钙]和CaSO4,其生产原理由两步组成[1-2]。第一步由H2SO4分解磷矿粉[主要成分是氟磷酸钙Ca5(PO4)3F]产生H3PO4、CaSO4和HF,第二步由产生的H3PO4与剩余的磷矿粉反应生成Ca(H2PO4)2·H2O和HF,化学反应过程如下:
第一步:Ca5(PO4)3F+5H2SO4→5CaSO4+3H3PO4+HF↑
(1)
第二步:Ca5(PO4)3F+7H3PO4+5H2O→5Ca(H2PO4)2·H2O+HF↑
(2)
总反应:2Ca5(PO4)3F+7H2SO4+3H2O→7CaSO4+3Ca(H2PO4)2·H2O+2HF↑
(3)
副反应:Ca5(PO4)3F+2H3PO4+10H2O→5CaHPO4·2H2O+HF↑
(4)
3Ca5(PO4)3F+H3PO4+10H2O→
5Ca3(PO4)2·2H2O+3HF↑
(5)
第一步反应中的CaSO4为CaSO4·1/2H2O,第二步反应结束后才转化为无水CaSO4,为了简化反应过程,直接用无水CaSO4代替。在实际生产中,这两步反应是过磷酸钙生产过程的两个不同阶段,也是在不同反应器中进行的。第一步反应主要在混合器中进行,是快速放热反应,反应时间仅为1~6 min,所需时间取决于磷矿粉的种类及粒径、H2SO4的浓度及温度、混合器类型等;磷矿粉主要为粉碎至D90通过0.15 mm(100目)筛的磷灰石或磷块岩粉末,混合器通常采用立式。第二步反应在化成室和熟化仓库中进行,化成室又分为回转化成室、皮带化成室、链板化成室等,化成时间需要20~60 min,仓库熟化时间需要7~30 d,才能使磷矿粉的总分解率达到94%~96%,所需时间取决于磷矿粉的种类及粒径、H2SO4的浓度及温度、化成器类型等。总反应即H2SO4与磷矿粉反应生成过磷酸钙、CaSO4和HF。但是在《无机化工生产技术》教学过程中发现,第一步反应和第二步反应相加并不等于总反应。即使不考虑CaSO4和Ca(H2PO4)2分子式中结晶水的存在和转化,上述两个分步反应式之和仍不等于总反应式。
关于过磷酸钙生产的化学原理在相关教材中已有大量阐述[1-2],本文在此只补充剖析两个分步反应与总反应的关系、两步反应所分解的磷矿粉数量,并探讨对过磷酸钙实际生产的指导意义。
1 两个分步反应之和不等于总反应的原因
1.1 磷酸分解的磷矿石物质的量实际上不到硫酸物质的量的1/3
第一步反应属于快速反应,反应物H2SO4是二元强酸,且在反应过程中得到了充分和完全的利用。第二步反应中的H3PO4虽然是三元中强酸,但由于产物为Ca(H2PO4)2·H2O,是过磷酸钙的主要成分,实际上磷酸相当于一元酸参与反应,且反应过程中未得到完全和充分的利用。
为简化起见,暂不考虑磷矿粉中钙盐、镁盐和倍半氧化物等杂质在第一步、第二步反应中对H2SO4和H3PO4的消耗,仅以杂质含量较少的过磷酸钙优等品为例进行分析。由于第一步反应中产生了HF,造成了酸的挥发流失,流失的HF与H3PO4的物质的量之比为1∶9。因此,不仅理论上第一步反应所消耗的H2SO4的物质的量要多于所产生的H3PO4的物质的量,而且是所产生的H3PO4(按一元酸计)实际物质的量的3倍以上,即理论上参与第二步反应的磷矿粉的量还不到第一步反应的1/3。实际上H2SO4分解的磷矿粉的量应大于总量的2/3,H3PO4分解的磷矿粉的量小于总量的1/3。
1.2 两个分步反应需要乘以相应系数再相加才等于总反应
由国家标准《过磷酸钙》(GB/T 20413—2017)可知,优等品的有效磷(以P2O5计)的质量分数≥18.0%,水溶性磷(以P2O5计)的质量分数≥13.0%,游离H3PO4(以P2O5计)的质量分数≤5.5%。假如典型的过磷酸钙优等品中有效磷、水溶性磷、游离H3PO4的质量分数分别按19%、14%、5%进行计算,水溶性磷包括H3PO4和Ca(H2PO4)2·H2O,水溶性磷和游离H3PO4的含量之差即为Ca(H2PO4)2·H2O的含量(质量分数为9%);有效磷中另有枸溶性磷(以P2O5计,质量分数5%),枸溶性磷主要成分为CaHPO4·2H2O(磷酸氢钙)和Ca3(PO4)2·2H2O(磷酸三钙),见反应(4)和(5)。国家标准中各成分的质量分数和典型组成见表1。第一步反应产生的H3PO4中只有9/19即47.4%的磷酸转化为Ca(H2PO4)2·H2O,另外仍有5/19即26.3%的H3PO4转化为枸溶性磷,其余作为游离酸存在于产品中。

表1 典型的过磷酸钙优等品组成(均以P2O5计) %
事实上,由于H2SO4用量通常为理论用量的103%~105%,是充分且完全利用的;H3PO4由于酸性较弱,反应后期的磷矿粉粒径较大、反应活性较差,总有一定量的H3PO4和磷矿粉同时残留于过磷酸钙产品中,没有得到充分分解和完全利用,因此H2SO4分解磷矿粉的量占磷矿粉总量超过2/3,而H3PO4分解的磷矿粉占比小于1/3。
基于上述分析,如果将第一步反应乘以7/5,第二步反应乘以3/5,然后再相加,两步反应的磷酸相互抵消,分步反应式相加等于总反应式。这说明在过磷酸钙生产中,两个分步反应理论上不是1∶1的关系,而是7∶3的关系。因此,对于分步反应,有时直接相加不等于总反应式,而要根据实际反应,乘以合适的系数后再相加才等于总反应式。
2 两步反应分解的磷矿粉比例的推测
假设反应(1)中H2SO4的理论物质的量为10,则H3PO4的理论物质的量为9。由于H3PO4只按一元酸参与反应,实际表观物质的量只有3,可见H2SO4的物质的量是H3PO4的物质的量的3.33倍。理论上H2SO4及其产生的H3PO4能够使磷矿粉完全分解,则磷矿粉的总物质的量应为H2SO4和H3PO4的物质的量之和13。当H2SO4的实际用量是理论用量的105%时,H2SO4的实际物质的量为10.5,产生的H3PO4实际物质的量为3.15,但磷矿粉的总物质的量并未增加,仍然是13。当过磷酸钙产品中游离H3PO4的质量分数为5%左右时,则可以推测出H2SO4实际分解磷矿粉的比例、H3PO4理论上和实际分别分解磷矿粉的比例、产品中残留的磷矿粉比例等,数据见表2。
表2 不同生石灰加入量的试验结果

表2 过磷酸钙优等品生产参数的合理估算
推测过程:
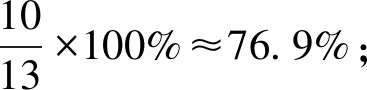
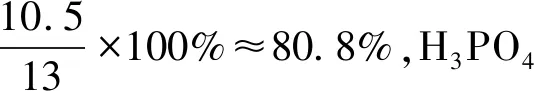
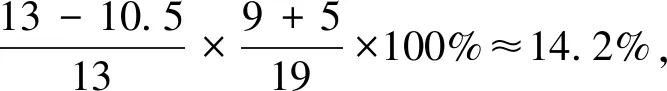
(4)计算H3PO4残留物质的量应该为H3PO4实际物质的量×游离H3PO4在枸溶性磷中所占比例26.3%,3.15×26.3%≈0.83。
表2中的推测数据,如残留的磷矿粉比例等与实际生产中的数据是非常接近的,说明推测的理论依据是可靠的。
3 对过磷酸钙实际生产的指导意义
专著和教材上的内容:第一步反应理论上分解的磷矿粉占70%,第二步反应理论上分解的磷矿粉占30%[1-2];由于实际H2SO4用量为理论用量的103%~105%,实际上第一步反应分解的磷矿粉为72%~74%[1-2]。
由表2的数据可知,理论上第一步反应H2SO4分解的磷矿粉约占76.9%,第二步反应H3PO4分解的磷矿粉约占23.1%。在实际生产中,如果H2SO4用量按理论用量的105%进行计算,则反应第一阶段约有80.8%的磷矿粉参与H2SO4的分解反应,剩下约19.2%的磷矿粉参与H3PO4的分解反应,但实际上H3PO4分解的磷矿粉仅为14.2%。
H2SO4用量超出理论用量越多,第一步反应占比越大,过磷酸钙产品中过量的H3PO4就越多,残留的磷矿粉就越少。H2SO4过量的具体数值取决于磷矿粉的种类、反应活性,也与H2SO4浓度和温度等条件相关。一般来说,过量H2SO4的应用并不会导致过磷酸钙产品中有游离H2SO4的存在,因为H2SO4的物质的量相对磷矿粉的物质的量始终都是不足的,而且游离H2SO4并不能与Ca(H2PO4)2共存,因为生成的Ca(H2PO4)2也将与H2SO4反应生成CaSO4和H3PO4,化学方程式如下:
Ca(H2PO4)2+H2SO4→CaSO4+2H3PO4
(6)
可见,适当过量的H2SO4只是导致过磷酸钙产品中少量H3PO4的残留,并不影响产品的品质和应用。但仍然要严格控制H2SO4用量和比例,过剩系数一般不能超过1.05,以免游离H3PO4含量超过5%,造成游离H3PO4含量超过残余磷矿粉含量,导致整个体系呈酸性。
4 结语
(1)过磷酸钙生产反应原理中,两个分步反应直接相加并不等于总反应,其本质是第一步反应所有H2SO4的物质的量明显大于第二步反应H3PO4的物质的量,H2SO4的物质的量理论上是H3PO4的物质的量的3.33倍。将第一步反应式乘以系数7/5,第二步反应式乘以系数3/5,才能抵消两步反应中的H3PO4,然后再相加,就等于总反应式。这说明两步反应理论上不是1∶1的关系,而是7∶3的关系。
(2)理论上第一步反应中H2SO4分解的磷矿粉应占76.9%而不是70%,第二步反应中H3PO4分解的磷矿粉理论上应为23.1%而不是30%。
(3)实际生产中,由于H2SO4用量通常超过理论用量的5%,且H2SO4反应完全,因此,过磷酸钙优等品中第一步反应分解的磷酸粉应为80.8%。由于H3PO4酸性较弱,反应不充分,产品中残留5%左右的游离H3PO4和5.1%的磷矿粉,残留的游离H3PO4和磷矿粉的含量基本上是一致的,因此第二步反应分解的磷矿粉为14.2%左右。
(4)本文依据过磷酸钙的生产原理和理论,对实际生产中H2SO4用量的上限为理论用量的105%,造成游离H3PO4含量超过残留磷矿粉含量以及整个体系呈酸性的情况进行了切合实际的剖析,对正确估算游离H3PO4含量和残留磷矿粉数量等具有一定的指导意义。

