LASP1基因对人结直肠癌LOVO细胞增殖、迁移和凋亡的影响及其机制
徐益平,尚韬
0 引言
结直肠癌(colorectal cancer, CRC)是全球常见的消化道恶性肿瘤之一,国际癌症研究机构统计数据显示,CRC发病率在所有肿瘤中位居第三,死亡率仅次于肺癌位居第二[1]。远处侵袭和转移是CRC相关死亡发生的重要原因之一,尽管CRC治疗手段不断发展,转移性结直肠癌患者的疗效和预后仍不理想[2-3]。因此,开发新的分子诊疗手段,防治结直肠癌的转移,对于提高结直肠癌患者长期生存和改善预后意义重大。上皮细胞-间充质转化(EMT)指上皮细胞获得间充质表型的细胞重编程过程,在结直肠癌转移侵袭过程中发挥重要作用[3]。LIM和SH3蛋白1(LASP1)是CRC发展过程中一种转移相关蛋白,可通过介导EMT、诱导癌细胞侵袭性表型影响结直肠癌进展[4]。粘附斑激酶(focal adhesion kinase, FAK)/蛋白激酶B(AKT)可介导结直肠癌细胞EMT促进细胞迁移、侵袭能力[5]。研究报道LASP1可通过诱导FAK/AKT信号通路促进非小肺细胞癌的增殖和侵袭能力[6]。LASP1能否通过FAK/AKT信号通路促进结直肠癌发展、转移还未明确。本研究拟通过体外实验探究LASP1介导FAK/AKT在结直肠癌细胞增殖、迁移侵袭中的作用,以期完善CRC转移的作用机制,为其防治带来新办法。
1 材料与方法
1.1 主要试剂
LOVO人结肠癌细胞(赛百慷(上海)生物技术股份有限公司,iCell-h126);pCMV6-ddk-myc、pCMV6-ddk-myc-LASP1、LASP1-siRNA、NC-siRNA(上海吉玛公司合成提供);Lipofectamine 3000 试剂(美国Invitrogen抗体公司,L3000-008);DMEM高糖培养基(美国Hyclone试剂公司, SH30243.01);Transwell小室、Basement Membrane Matrix基质胶(美国康宁试剂公司, 3422、356234);BCA蛋白定量试剂盒(北京索莱宝科技公司, pc0020);FAK、p-FAK、AKT、p-AKT蛋白抗体(美国Affinity抗体公司,AF6397、AF3398、AF6261、AF0016);LASP1蛋白抗体(美国Abcam抗体公司,ab117806);RIPA裂解液、Tunel细胞凋亡检测试剂盒(上海碧云天生物公司,P0013D、C1090);反转录试剂盒(江苏康为世纪生物公司,CW2569);MTT试剂盒、总RNA提取试剂TRIzol(生工生物工程(上海)公司,E606334-0500、B511311)。
1.2 实验仪器
BB150细胞培养箱、Micro17R低温高速离心机(美国Thermo公司);610020-9Q化学发光仪(中国上海勤翔仪器公司);CMaxPlus酶标仪(美国MD公司);CFX Connect实时荧光定量PCR仪(美国BIO RAD公司)。
1.3 细胞转染
LOVO细胞使用含10%胎牛血清、1%的青霉素改良的DMEM培养基,置于37℃、5%CO2培养箱中培养。使用Lipofectamine 3000试剂将pCMV6-ddk-myc(空白质粒)、pCMV6-ddk-myc-LASP1(LASP1过表达质粒)、NC-siRNA(sc-37007)(空白沉默质粒)、LASP1-siRNA(sc-105607)(LASP1沉默质粒)转染至LOVO细胞,并根据转染的质粒进行相应分组,分别为pCMV6-NC组、pCMV6-LASP1组、NC-siRNA组、LASP1-siRNA组。
1.4 qRT-PCR检测LASP1基因表达
提取各组细胞RNA,反转录PCR进行DNA扩增,实时荧光定量PCR检测LASP1表达。反应条件为变性95℃ 10 min,扩增反应,95℃ 15 s,60℃ 60 s,40次,溶解曲线,95℃ 15 s,60℃ 60 s,95℃ 15 s。采用2-△△CT法对结果进行相对定量分析。引物序列见表1。

表1 引物序列Table 1 Primer sequence
1.5 MTT实验
取对数生长期细胞接种于平板。每孔加入10 μl MTT溶液与细胞混合,放回培养箱内孵育24 h后取出。酶标仪测定490 nm处吸光度值,进行细胞存活计算。
1.6 Tunel染色
平板接种细胞后用4%多聚甲醛通透细胞。每平板细胞中加入50 μl Tunel检测液,室温下避光孵育1 h。PBS漂洗三次,制片、封片。荧光显微镜下观察拍照并计数Tunel阳性细胞数量。
1.7 Transwell实验
Transwell小室放入24孔培养板,细胞加入上层小室,培养箱中培养24 h。取出后,棉签擦掉上室底层细胞。4%多聚甲醛固定下层小室细胞10 min,PBS洗3次,0.1%结晶紫染液染色计数迁移至下室中的细胞数量。30 μl Matrigel稀释液包被Transwell小室后4℃孵育过夜,上室加入细胞,培养箱中培养24 h,棉签擦掉上室底层细胞和剩余Matrigel稀释液,4%多聚甲醛固定10 min,PBS洗3次,0.1%结晶紫染液染色计数侵袭至下室中的细胞数量。
1.8 划痕实验
各组细胞接种于平板,200 μl移液器吸头划线创建伤痕,分别24、48 h观察划线内细胞愈合情况,并拍照计数。
1.9 Western blot实验
RIPA裂解收集细胞,离心收集底部细胞沉淀。BCA法测定细胞总蛋白浓度,随后转至PVDF膜,5%脱脂奶粉孵育,TBST清洗。加入检测的稀释后的FAK、p-FAK、AKT、p-AKT、LASP1一抗抗体,4℃下摇床振荡孵育过夜。隔天室温下振荡30 min,将上层液体轻轻吸出,TBST清洗3遍。5%脱脂奶粉封闭液稀释,稀释对应二抗抗体振荡孵育1.5 h,TBST清洗。ECL化学发光显影,计算各蛋白相对表达含量。
1.10 统计学方法
采用SPSS16.0统计软件进行数据分析,多组间数据比较采用One-way-ANOAY单因素方差分析,组间两两比较采用Tukey检验。所有数据以均值±标准差(x±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 转染结果鉴定
与pCMV6-NC组相比,pCMV6-LASP1组细胞LASP1mRNA表达显著上升(P=0.002)。与NCsiRNA组比较,LASP1-siRNA组细胞LASP1mRNA表达显著下降(P=0.001),见表2。结果显示细胞转染成功,可用于后续实验检测。
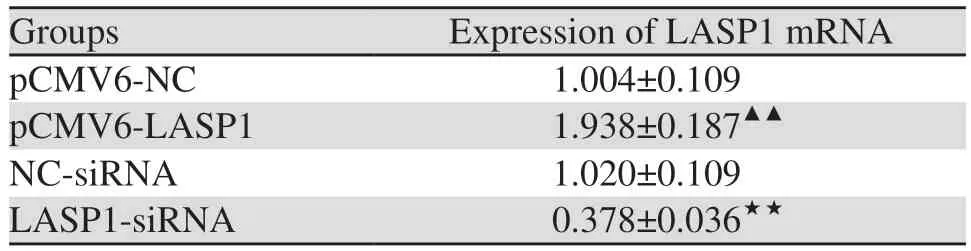
表2 qRT-PCR检测LOVO细胞转染后LASP1的表达Table 2 LASP1 mRNA expression in transfected LOVO cells detected by qRT-PCR
2.2 LASP1对LOVO细胞增殖的影响
MTT实验结果显示,与pCMV6-NC组相比,pCMV6-LASP1组的细胞存活率显著上升(P=0.000),与NC-siRNA组比较,LASP1-siRNA组的细胞存活率显著下降(P=0.000),见表3。
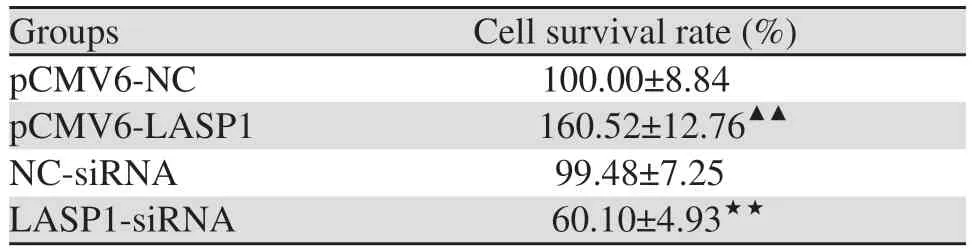
表3 LASP1过表达或沉默对LOVO细胞存活的影响Table 3 Effects of overexpression or silencing of LASP1 on the survival of LOVO cells
2.3 LASP1对LOVO细胞迁移侵袭的影响
Transwell和划痕实验结果显示,与pCMV6-NC组相比,pCMV6-LASP1组细胞的迁移以及侵袭数量显著上升(分别P=0.003、P=0.000),24和48 h伤口愈合率均显著升高(分别P=0.004、P=0.009);与NC-siRNA组比较,LASP1-siRNA组细胞的迁移以及侵袭数量显著下降(分别P=0.002、P=0.001)、24 h和48 h伤口愈合率均显著降低(P=0.006、P=0.004),见图1。
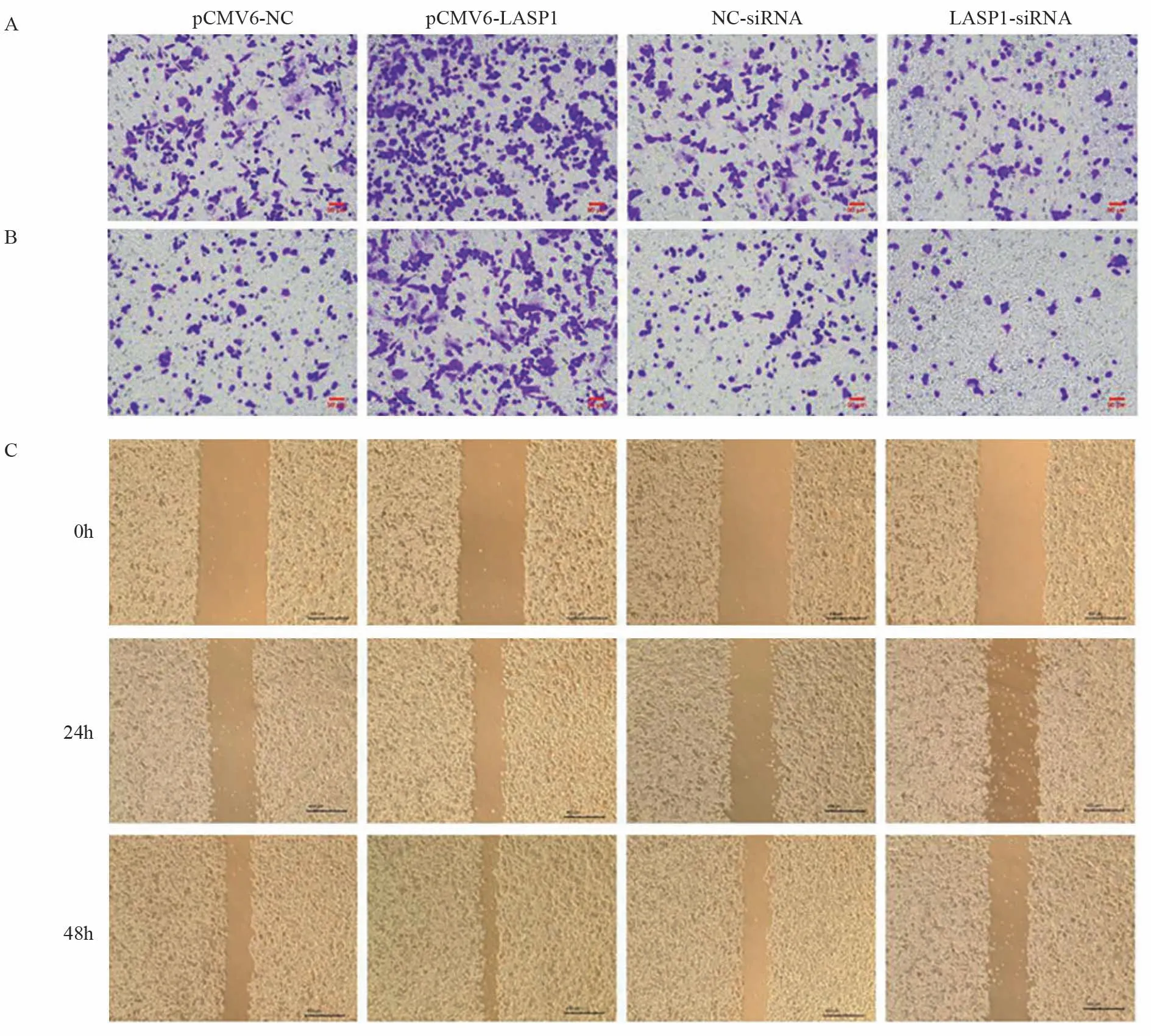
图1 LASP1过表达或沉默对LOVO细胞迁移及侵袭能力的影响Figure 1 Effects of LASP1 overexpression or silence on migration and invasion of LOVO cells
2.4 LASP1对LOVO细胞凋亡的影响
Tunel染色结果显示,与pCMV6-NC组相比,pCM V 6-L A S P 1 组细胞凋亡率显著降低(P=0.003);与NC-siRNA组比较,LASP1-siRNA组细胞凋亡率显著升高(P=0.000),见图2。
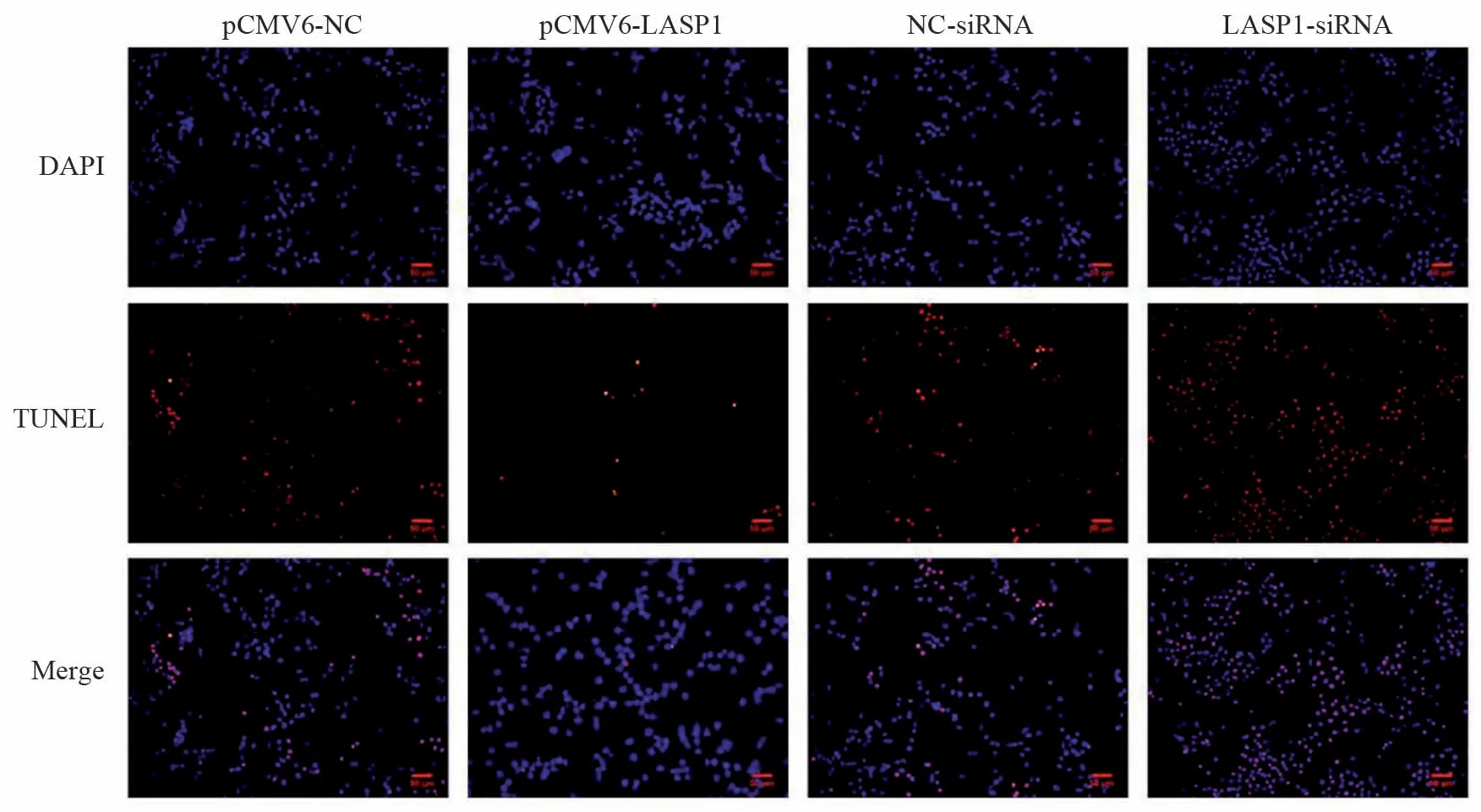
图2 LASP1过表达或沉默对LOVO细胞凋亡的影响 (Tunel染色)Figure 2 Effects of LASP1 overexpression or silence on apoptosis of LOVO Cells (Tunel staining)
2.5 LASP1对LOVO细胞LASP1、FAK/AKT通路蛋白表达的影响
Western blot实验结果显示,与pCMV6-NC组相比,pCMV6-LASP1组细胞LASP1、p-FAK/FAK、p-AKT/AKT蛋白表达显著上升(分别P=0.002、P=0.010、P=0.004);与NC-siRNA组比较,LASP1-siRNA组细胞LASP1、p-FAK/FAT、p-AKT/AKT蛋白表达显著下降(分别P=0.000、P=0.005、P=0.002),见图3。

图3 LASP1过表达或沉默对LOVO细胞相关蛋白表达的影响Figure 3 Effects of LASP1 overexpression or silence on related protein expression in LOVO cells
3 讨论
LASP1基因位于染色体17q11-21.3,属于大肌动蛋白结合神经蛋白家族成员,在人体大部分组织内低表达[7-8]。LASP1的两端为LIM和SH3结构区域,可分别与肌动蛋白和其他信号受体发生作用,参与细胞运动、侵袭等过程[8]。LASP1在晚期结直肠癌组织中表达显著高于早期,可介导EMT促进CRC迁移,而敲除LASP1表达可以抑制CRC的转移侵袭[9]。而在体模型表明,LASP1过表达促进了小鼠结直肠原位肿瘤生长和进展[10]。本研究通过构建LASP1过表达质粒和干扰质粒转染人结肠癌LOVO细胞,通过细胞功能实验检测LASP1不同表达对LOVO细胞的影响,结果与朱龙海等[11]研究相符,表明LASP1基因的表达与结肠癌细胞迁移侵袭相关。
FAK为促转移功能蛋白,磷酸化表达增加可促进CRC细胞EMT及迁移和侵袭能力[12-13]。研究表明,FAK表达降低可抑制CRC细胞与胞外基质粘连作用,进而抑制CRC细胞迁移[14]。AKT相关通路为调节细胞生长、增殖和抗凋亡的重要通路,结直肠癌出现淋巴结转移、浆膜层浸润以及肿瘤低分化患者其癌组织p-AKT表达显著升高,p-AKT表达与CRC发展、预后相关[15]。Xu等研究表明FAK蛋白与AKT蛋白可相互作用,敲减CRC细胞FAK表达可抑制p-AKT表达,从而抑制CRC细胞干细胞样特性与转移能力[16]。其他相关研究表明,FAK/AKT信号通路激活,可增强CRC细胞迁移、侵袭能力和EMT[5,17]。Zhou等研究结果表明LASP1可通过激活AKT促进CRC进展[18]。本研究结果表明,LASP1可调控CRC细胞中FAK/AKT信号通路的表达,由此推测LASP1可介导FAK/AKT信号通路参与CRC细胞增殖、迁移及侵袭过程。
综上,本研究结果表明LASP1基因表达促进了LOVO细胞增殖、迁移和侵袭能,而敲减LOVO细胞LASP1表达起相反作用,LASP1介导FAK/AKT通路表达是其促进CRC发展机制之一。由于本课题组条件有限,未能进行动物模型实验进一步研究LASP1介导FAK/AKT表达对CRC进展的影响。以后我们将继续探索LASP1介导FAK/AKT调控CRC进展的机制,为临床防治CRC转移提供新的方向。
利益冲突声明:
所有作者均声明不存在利益冲突。

