一种速生抗性泡桐苗的组培繁育及种植环境监测
黄蕊 覃国乐 黄金艳 唐秀楠 刘彩梅

收稿日期:2023-07-19
基金项目:2022年国家级大学生创新创业训练计划项目“广西乡土碳汇树种泡桐组培研究”(202210605012)。
作者简介:黄蕊(2001—),女,广西灵山人,在读本科生。
*为通信作者,E-mail:893894541@qq.com。
黄 蕊,覃国乐,黄金艳,等.一种速生抗性泡桐苗的组培繁育及种植环境监测[J].南方农业,2023,17(16):-251.
摘 要 研究以白花泡桐根萌嫩芽为外植体,对消毒方式、植物生长调节剂及其浓度配比条件进行优化,筛选出合适的外植体灭菌方式为酒精消毒10 s+0.1%氯化汞溶液消毒20 min,初代培养基是6-BA(6-苄氨基嘌呤)0.8 mg·L-1+NAA(萘乙酸)0.25 mg·L-1+TDZ(噻苯隆)0.1 mg·L-1,继代培养基是MS+6-BA0.5 mg·L-1+NAA0.08 mg·L-1+TDZ0.02 mg·L-1,生根培养基是1/2MS+IBA(吲哚-3-丁酸)
0.75 mg·L-1+ NAA0.8 mg·L-1+活性炭0.1g·L-1+氯化胆碱0.05 mg·L-1。利用风云二号气象卫星对泡桐种植环境进行监测,结果表明泡桐对CO2和粉尘有较强的吸收能力,并有效降低了土壤的pH值。
关键词 速生抗性;泡桐组培苗;种植;环境监测
中图分类号:S792.43 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2023.16.077
白花泡桐(Paulownia fortunei)是我國速生木材和园林绿化树种之一,不仅能改善生态环境,解决当前我国木材供应不够充足的问题,还有助于提高农民收入[1]。由于泡桐属种间可天然杂交,自然形成的种子变异的可能性较大,为保证母本的优良性状,埋根、埋条和组培等无性繁殖是繁殖泡桐优株的主要方式[2]。但是埋根和埋条的繁殖速度慢且人力投入大、占地面积大。泡桐组培繁育技术研究始于20世纪80年代,但当时仅对泡桐离体快繁技术进行了初步研究,未形成高效的再生体系和遗传转化体系。本项目优选白花泡桐无节良材母株,重点研究速生抗性白花泡桐组织培养技术及种植推广,并利用风云二号气象卫星对泡桐种植环境进行监测。
1 材料与方法
1.1 试验材料
由广西绿桐林业科技有限公司提供种根,经大棚里埋根所萌发的嫩芽。
1.2 试验方法
培养基配比设计见表1。
0.08 mg·L-1+TDZ 0.02 mg·L-1;诱导生根的培养基为1/2MS+IBA 0.75 mg·L-1+ NAA 0.8 mg·L-1+活性炭
0.1 g·L-1+氯化胆碱0.05 mg·L-1。
以上培养基中均添加蔗糖30 g·L-1、琼脂5.2 g·L-1,pH调至6.8;121 ℃高温灭菌20 min。
1.3 实验过程
1.3.1 白花泡桐外植体消毒和培养
覃玉凤在开展柠檬草(Cymbopogon citratus)组织培养技术研究中发现,下部萌芽外植体诱导率较高,原因可能是茎段下部分生细胞较多,幼化性强,分化能力较强[3]。在植物组培的整个过程中,外植体消毒至关重要。对植物外植体消毒常用的方法有流水冲洗、0.1%氯化汞消毒、酒精消毒、肥皂水清洗及青霉素酸钠浸泡等方式[4-6]。本研究在借鉴前人对外植体消毒的经验基础上,对白花泡桐采用无菌水冲洗3~5次,用酒精消毒10 s,再用无菌水清洗3次,再用0.1%氯化汞溶液消毒20 min,在消毒时持续晃动瓶子使外植体表面与氯化汞溶液充分接触,待回收0.1%氯化汞溶液后再用无菌水清洗3~4次,然后将芽取出置于无菌滤纸上吸干水分,剪去芽下端和叶柄后,转入外植体培养基中。
1.3.2 白花泡桐继代培养
将初代培养的无菌苗茎段剪切成1.5 cm左右并去除叶柄进行继代培养,接种20瓶,重复3次,统计继代培养过程中的污染率,培养20 d后统计腋芽诱导率。
1.3.3 白花泡桐生根诱导
按照前述配方对植株进行根系诱导实验,在培养基中接种无菌苗,定期观察和记录植株生长情况,培养30 d后,统计生根率。
1.3.4 白花泡桐炼苗及移栽
选择生根培养基中植株正常、根系发育良好、茎段粗壮、株高7 cm以上的芽苗为炼苗材料。为提高组培苗的质量,将所得的生根苗置于室温、自然光下炼苗5 d,打开瓶盖炼苗时喷施10%磷酸二氢钾1~2次,有助于提高组培苗的茎秆硬度,提高成活率。取出白花泡桐组培苗并洗净根部培养基,移栽到装有移栽基质的营养杯中,保持温度25 ℃左右和湿度70%~80%,培养30 d后统计其成活率。
1.3.5 白花泡桐育苗阶段炼苗土金属成分和pH测量
采用6种基质作为炼苗基质,分别为天桥种植基地土壤、中州种植基地土壤、椰糠、驯化旧基质、进口泥炭、复配基质,且按顺序命名为1号、2号、3号、4号、5号、6号,并将其研磨成细粉末状,烘干待测。1)金属成分检测:将研磨细的干燥土壤适量分类装袋,使用土壤重金属检测仪依次检测。2)pH测量:将土壤和纯水按照1∶5的质量比,搅拌成溶液,静置分层后,用pH计测量上层清液。
1.3.6 培养条件
培养光照强度和时间按培养阶段进行不同处理,初代、继代、生根及实验培养为光照培养,光照强度为1 500~2 500 lx,每天12~14 h。诱导愈伤及愈伤组织增殖实验暗培养。室内温度均为(25±2)℃,炼苗移栽置于大棚中培养。
1.3.7 实验数据处理
污染率、成活率、腋芽诱导率、愈伤组织诱导率、生根率、愈伤组织增殖率的计算公式如(1)~(6)
所示。
(1)
(2)
(3)
(4)
(5)
式中,R1、R2、R3、R4、R5分别为污染率、成活率、腋芽诱导率、愈伤组织诱导率、生根率,%;n1为污染个数、n2为接种数、n3为未污染且成活个数、n4为萌发腋芽数、n5为接种茎段数、n6为产生愈伤组织的外植体数、n7为接入外植体数、n8为生根植株
数,个。
(6)
式中,R6为愈伤组织增殖率,%;m1为培养后愈伤组织质量、m2为接入时愈伤组织质量,kg。
1.3.8 种植环境卫星监测
水、土壤、大气等是环境监测的重点,其工作内容包括调查、布点、取样、测试、分析等[7-8]。通过建立的生态环境监测系统实现生态环境、大气环境质量及自然灾害等的实时预警预报,充分发挥生态环境监测及环保技术的作用[9]。本实验主要通过风云二号气象卫星对泡桐种植环境中的CO2浓度变化、盐碱地块土壤pH值变化进行监测,为实现“碳达峰、碳中和”及盐碱地种植土壤改良提供数据支撑和理论参考。
2 结果与分析
2.1 白花泡桐消毒与接种
采用上述消毒措施处理后,成活率为80%。
2.2 白花泡桐继代培养生长情况
继代第20 d白花泡桐生长状况良好,成活率为89.6%,腋芽诱导率达76%,增殖系数达到最大值5,所培养出的材料较好,根茎和顶芽枯萎、死亡或者植株玻璃化的现象较少,而且所得幼苗茎秆均匀健壮,叶片大且鲜绿,苗高5~6 cm。
2.3 白花泡桐生根诱导
将无菌植株接种到生根诱导培养基,接种5~8 d
后基部膨大出现愈伤组织,出现根点,根的生长速度较快。8~10 d后可观察到白花泡桐长出大量根系,培养30 d,生根率可达98%,根的数量多且壮实,生长均匀,瓶苗的大部分根可以在整个培养基上生长。叶片深绿丰满,株高在7~10 cm。
2.4 白花泡桐炼苗及移栽
白花泡桐组培苗诱导生根15 d后,选择根系发育良好、茎段粗壮、株高7 cm以上的苗进行炼苗移栽。置于室温、自然光下炼苗后,移栽到装有移栽基质的营养杯中,培养30 d后其成活率可达85%。
2.5 白花泡桐育苗阶段炼苗土金属成分和pH测量
所采集的6个区域的土壤样品中,中州种植基地的泡桐苗生长状况良好,天桥种植基地和驯化旧基质的生长情况不好,其中驯化旧基质的苗死亡的情况出现较多,故对这3个区域的金属成分进行比对分析,如表2所示。
测定采集的6种基质pH值:天桥种植基地pH为6.28;中州种植基地pH为4.53;椰糠pH为6.44;驯化旧基质pH为6.54;进口泥炭pH为5.18;复配基质pH为6.25。由此可知泡桐炼苗适宜在微酸和中性土壤中生长。
2.6 卫星监测种植环境CO2变化结果
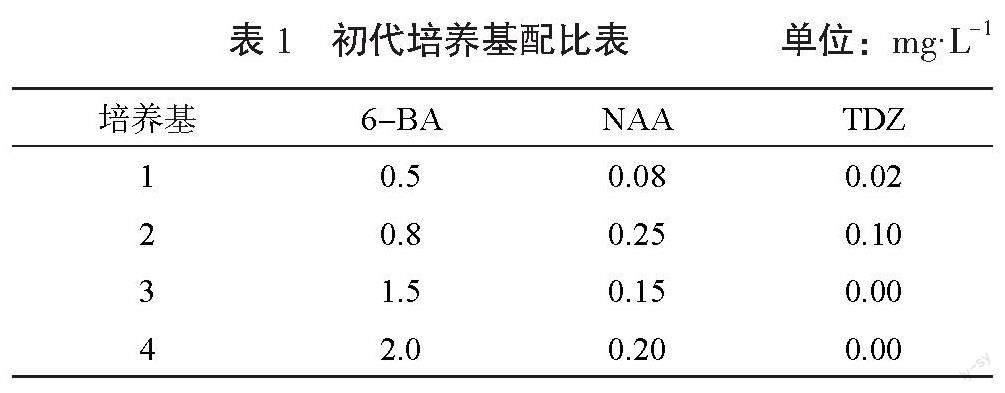
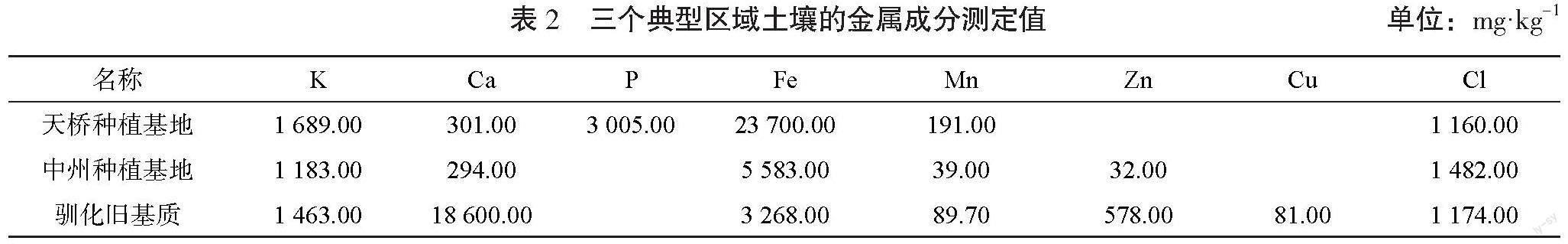
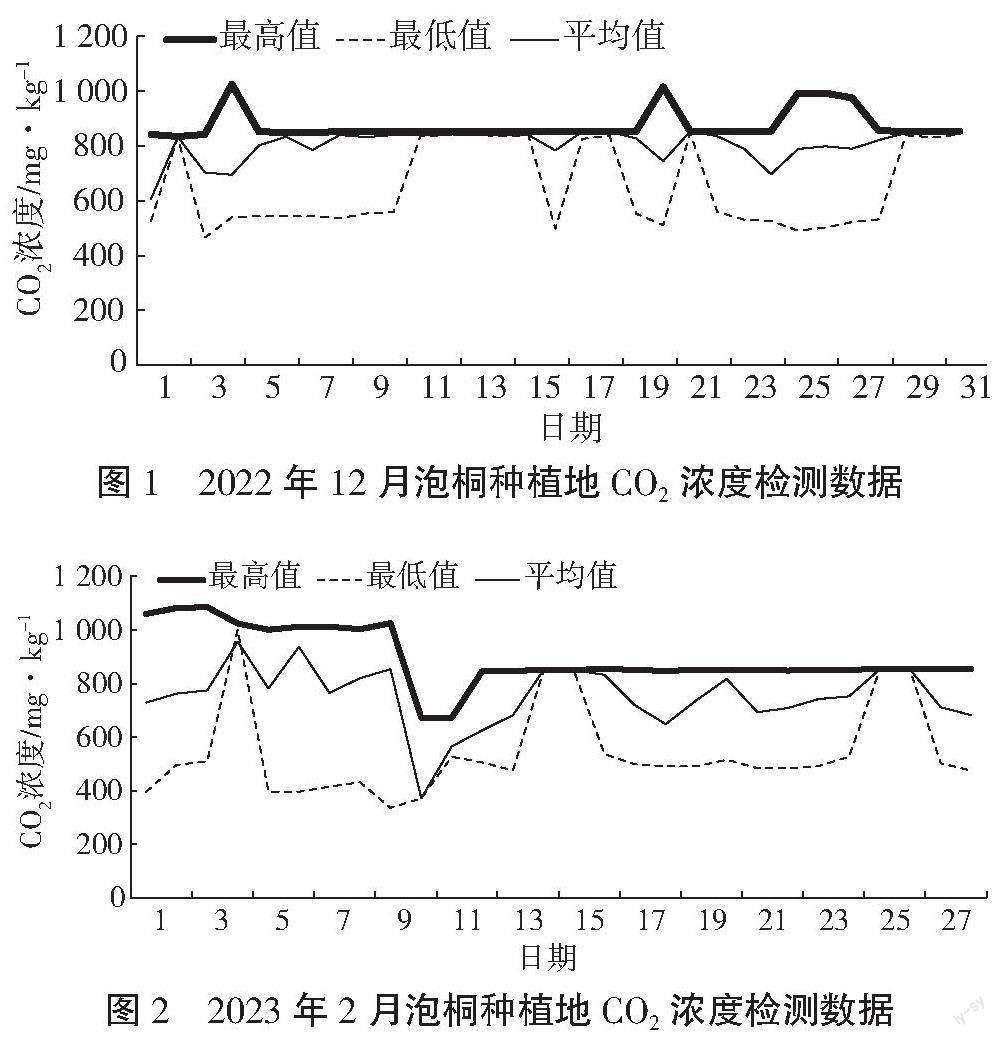
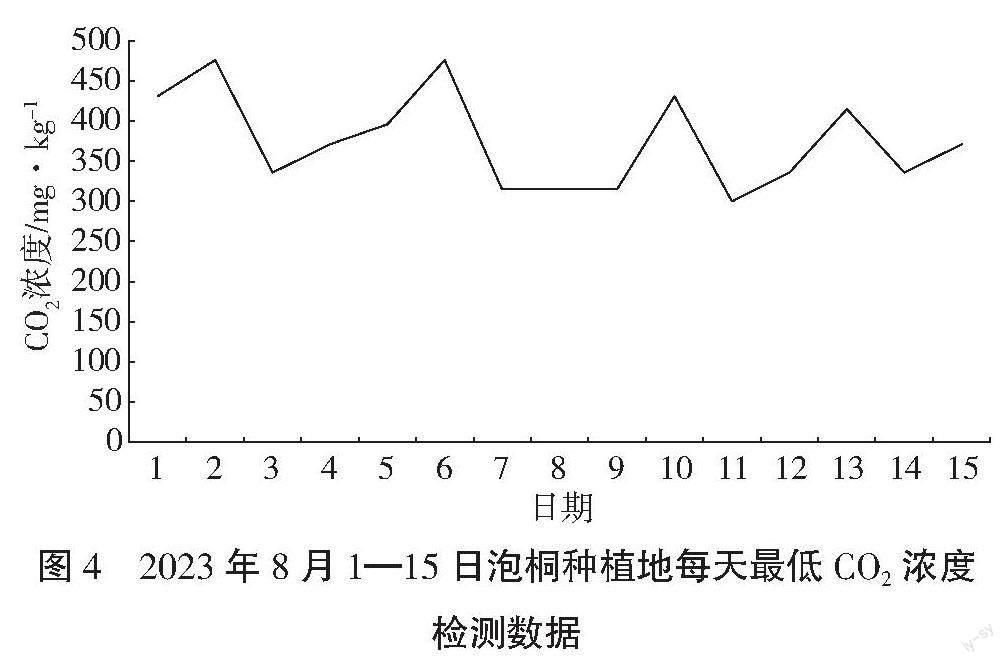
通过风云二号气象卫星从2022年12月至2023年8月中旬对泡桐种植环境中的CO2浓度进行监测,结果表明泡桐种植地CO2浓度显著降低,说明泡桐能够吸收环境中的CO2,有利于种植环境往生物固碳方向发展,见图1~图4。
从图1可以看出,2022年12月泡桐种植地CO2浓度最高值高于840 mg·kg-1的天数为31 d;2023年2月泡桐还在休眠期,无叶片进行光合作用,种植地CO2浓度最高值仅有2 d(10日、11日)低于800 mg·kg-1
(图2);从图3可以看出2023年7月泡桐种植地最低CO2浓度高于600 mg·kg-1的天数为8 d,其余23 d
的CO2浓度低于600 mg·kg-1,整个7月基本都小于800 mg·kg-1。原因是泡桐树在5月为始叶期,历经
5月和6月,泡桐叶片明显增加,这时光合作用明显增强,吸收CO2能力提升。
从图4可以看出15 d的时间里1日、2日、6日和
10日为睛天高温天气,空气CO2浓度在476 mg·kg-1向415 mg·kg-1递减,其余时间基本为下雨天,空气CO2浓度在396 mg·kg-1向300 mg·kg-1递减,因为这个阶段泡桐的叶片数和叶面积明显增多,吸收的CO2量比7月更多。
2.7 卫星监测种植环境pH变化结果
根据2022年钦北区近海泡桐种植基地土壤的pH变化数据,pH由9.2降低到8.3左右,说明泡桐在碱性土壤中也能生长,并能逐渐降低土壤的碱性,其落叶腐烂后提高了土壤的有机质含量。
3 结论与讨论
继代第20代以后白花泡桐生长状况较差,增殖系数变低且根茎、顶芽、叶柄还会出现不同程度的枯萎和死亡,与苏江在白花泡桐增殖培养中植物生长调节剂浓度配比失当时的情况相似[10]。张永珊在藏红花球茎生物学特性及繁育增殖的初步研究中表明氯化胆碱可促进组培苗生根、根的伸长,且不定根短粗有助于培养健壮的组培苗,提高移栽成活率[11]。因此在NAA和6-BA的基础上添加氯化胆碱有助于无菌苗生根。炼苗有助于移栽,若不进行炼苗直接移栽,易引起白花泡桐组培苗根部腐烂死亡使得移栽成活率降低[12]。组培苗从无菌环境进入有菌環境生长要对移栽基质进行消毒,做好移栽后一段时间内的覆膜保湿、保温等工作可确保组培苗移栽的成活率。
不同的植物生长调节剂组合对白花泡桐植株的生长高度、增殖系数、叶片数量、腋芽数会产生一定的影响,在参试因素中,白花泡桐植株生长高度的因素影响力排序为6-BA>TDZ>NAA。与Mohamad添加了高浓度6-BA的培养基中植株长得最高的结论相似[13]。利用风云二号气象卫星对泡桐种植环境进行监测,结果表明泡桐对CO2和粉尘有较强的吸收能力,并能有效降低土壤的pH值。
4 展望
泡桐树是生态环境友好的乡土速生树种,既能吸收环境中的CO2还能降低碱性土壤的pH值,市场前景广,经济价值高。上述研究结果和经验可以为白花泡桐优株种苗组培快繁产业化提供技术支撑,为打造碳汇交易林,助力实现“双碳”目标贡献力量。
参考文献:
[1] 李筱莉,邬树德.泡桐资源开发利用的探讨[J].安徽林业,1992(3):12.
[2] 李芳东,邓建军,张悦,等.白花泡桐优树组织培养幼化技术研究[J].中南林业科技大学学报,2010,30(8):22-28.
[3] 覃玉凤.香茅草组织培养技术研究[D].南宁:广西大学,2018.
[4] 杨曦,苏翠,沈丽春,等.不同预处理对番木瓜外植体消毒效果比较研究[J].南方农业,2016,10(10):
60-62.
[5] 朱文涛.特有濒危药用植物羌活离体组培快繁技术研究[D].泸州:西南医科大学,2016.
[6] 陈灿.白芨组培快繁技术体系的建立研究[D].长沙:湖南农业大学,2016.
[7] 陈光秀,李辉,郭可可,等.环境监测在生态环境保护中的作用与发展[J].冶金管理,2023(9):37-39.
[8] 班惠昭.生态环境监测及环保技术探究[J].山西化工,2021,41(5):270-272.
[9] 何新刚.生态环境长期定位监测信息化管理研究[J].中小企业管理与科技,2019(7):20-21.
[10] 苏江,冼康华,付传明,等.白花泡桐优树组织培养及产业化快繁技术[J].广西植物,2017,37(11):
1386-1394.
[11] 张永珊.藏红花球茎生物学特性及繁育增殖初步研究[D].南昌:南昌大学,2021.
[12] 马玲,仇文婷,王彦军,等.珍稀中药材白芨组培快繁体系的建立[J].中国农学通报,2020,36(19):
80-84.
[13] MOHAMAD M E , AWAD A A , MAJRASHI A. et al. In vitro study on the effect of cytokines and auxins addition to growth medium on the micropropagation and rooting of Paulownia species (Paulownia hybrid and Paulownia tomentosa)[J]. Saudi Journal of Biological Sciences,2022,29(3):1598-1603.
(責任编辑:刘宁宁)

