鸭昼夜节律相关基因RORB与蛋重的相关性分析
陶志云,朱春红,徐文娟,章双杰,宋卫涛,刘宏祥,屠琦,王志成,李慧芳*
(1. 江苏省家禽科学研究所,江苏 扬州 225125;2. 苏州海关综合技术中心,江苏 苏州 225100)
RORs为维甲酸相关孤儿受体,属于核受体超家族的一个亚家族,该亚家族由RORα(NR1F1、RORA或RZRα)[1-3],RORβ(NR1F2、RORB或RZRβ)[4-6],和RORγ(NR1F3、RORC或TOR)组成[7-11],在昼夜节律、代谢、炎症和癌症中发挥重要作用[12]。研究表明,RORα表达在肝脏、肾脏、视网膜和肺中表现出微弱的昼夜节律振荡,并且ROR α通过2个保守的RORα响应元件直接激活BMAL1的转录,从而维持稳健的昼夜节律[13]。RORβ在小鼠松果体和视网膜中显示出节律性表达模式[14]。RORγ在肝脏、棕色脂肪组织和肾脏中表现出振荡表达模式,但在骨骼肌和胸腺中不存在[15-16]。RORα或RORβ缺陷的小鼠表现出异常的昼夜行为[6,17-18],而在RORγ-/-小鼠中未发现昼夜行为异常[19]。这些研究表明,ROR的节律表达在很大程度上取决于ROR亚型和组织类型。振荡器的核心环由异二聚体激活剂BMAL1和CLOCK组成,它们激活PERs和CRYs的表达。PER和CRY异二聚体与BMAL1时钟复合物相互作用并负调控其转录活性[12,20-22]。但在家禽中尚未见RORs相关研究报道。
本课题组在前期对高蛋重和低蛋重两组鸭的全基因组混池重测序中发现RORB基因为鸭产蛋量相关的受选择候选基因之一,且该基因上存在多个差异SNP位点(数据尚未发表),提示该基因在产蛋性能的调节中可能发挥作用。为了进一步确认该基因在产蛋中的作用,本研究采用Illumina方法对鸭RORB的基因序列进行个体测序,以分析这些SNP的差异,并将这些差异SNP与产蛋性能进行相关分析,同时检测RORB及其相关基因在蛋重不同鸭组织中的mRNA表达水平差异,进一步探讨鸭RORB基因在产蛋性能中的作用。
1 材料与方法
1.1 试验动物及分组
试验鸭为金定鸭,共250只,按照蛋鸭饲养标准饲养,90日龄时进行体重称量,剔除个体过大和过小的鸭只,将个体适中的鸭进行上笼饲养,上笼后逐渐增加光照时间,在达到产蛋高峰期后维持16 h光照直到试验期结束,在299、300、301和449、450、451日龄时分别称量连续3 d蛋重,作为个体300和450日龄的平均蛋重,根据个体300日龄时蛋重情况分别选取高蛋重,低蛋重2种极端表型以及中蛋重组个体各30只,共90只进行蛋重差异分析,并采集这90只鸭的血液,供后续提取DNA用。
1.2 个体选择和样品采集
分别在高蛋重、中蛋重和低蛋重组450日龄时各组分别随机选择8只鸭屠宰,采集卵巢髓质部组织,-80 ℃冰箱用于RNA提取。
1.3 DNA提取、PCR扩增和文库构建
采用血液小量提取试剂盒提取各样本DNA(TIANGEN,DP348),以提取的各DNA为模板,采用多重PCR方法对样本进行扩增,PCR扩增引物分别为Z-35251072-F:5′-tcctagtccaagcagtatattcac-3′,Z-35251072-R:5′-cagtggaggcctacataataaaag-3′;Z-35256947-F:5′-tttacagcacctcttctatctacc-3′;Z-35256947-R:5′-tacatgtccagaatactttgcaag-3′;Z-35278196-F:5′-aatttaagagggagaaaaaccag-3′;Z-35278196-R:5′-ttgatatgacactacaacagttcc-3′。第一轮扩增体系为:Primer Mix(50 nmol/L)2 μL,dNTP(2.5 mmol/L)0.8 μL,Taq酶(5 U/μL)0.1 μL,10× buffer 1 μL,基因组DNA(20 ng/μL)2 μL,Mg2+(100 mmol/L)1 μL,石蜡油10 μL,ddH2O 3.2 μL,共计20 μL;第一轮PCR反应条件如下:①95 ℃ 15 min 预变性,1个循环;②94 ℃ 30 s,60 ℃ 10 min,4个循环;③94 ℃ 30 s,60 ℃ 1 min,72 ℃ 30 s,20个循环。第二轮PCR扩增体系为:Barcode (2 μmol/L)3.6 μL,dNTP(2.5 mmol/L)0.8 μL,Taq酶(5 U/μL)0.1 μL,一轮产物样本稀释液10 μL,Mg2+(100 mmol/L)1 μL,10×buffer 2 μL,ddH2O 3.6 μL,石蜡油20 μL,总体系40 μL。第二轮PCR扩增反应条件为:①95 ℃ 15 min,1个循环;②94 ℃ 30s,60 ℃ 4 min,5个循环;③94 ℃ 30 s,65 ℃ 1 min,72 ℃ 30 s,10个循环。对预变性二轮扩增获得的产物进行混样,对混样后的文库进行纯化并精确定量后稀释至测序所需浓度(10 ng/μL)。
1.4 第二代测序
基于Illumina X-10测序平台对RORB上3个遗传变异进行单个样本的DNA高通量测序。具体方法为:①桥式PCR:使用NaOH将双链DNA文库变性为单链;将单链DNA模板杂交到Flow Cell 上;以Flow Cell 表面上的oligos为引物合成第一链;冲走单链DNA模板,以合成的第一链为模板进行35循环的桥式PCR;将与P5接头连接的DNA链从Flow Cell 上去除;阻断3′-OH防止在后续测序过程中继续延伸DNA链;杂交测序引物。② 测序反应:将桥式PCR产物于Illumina X-10测序平台上机测序,操作流程按照标准化工作流程进行。根据测序结果统计每个样本各位点的基因变异情况。
1.5 RNA提取和反转录成cDNA
卵巢组织的总RNA提取按照TRNzol- A+总RNA提取试剂(DP421,TIANGEN公司)说明书进行。提取后的RNA用分光光度计测其纯度和浓度。参照cDNA第一链合成试剂盒(KR118,TIANGEN公司)说明书将RNA逆转录为cDNA。
1.6 荧光定量PCR反应
根据NCBI上PER2、BMAL1、CLOCK和RORB基因组信息,Primer Premier 5.0软件在外显子区设计基因的PCR引物。以β-actin作为内参基因,基因及引物信息见表1。

表1 试验用基因及引物信息
采用SuperReal 荧光定量预混试剂彩色版(SYBR Green)试剂(TIANGEN,FP215),进行荧光定量PCR反应,20 μL反应体系:2×SuperReal Color Pre Mix 10 μL,正反向引物共0.8 μL,cDNA模版2 μL,50×ROX Reference Dye 0.4 μL,ddH2O 6.8 μL,反应条件为:①95 ℃ 5 min预变性;②95 ℃ 25 s,60 ℃ 25 s,72 ℃ 25 s,40个循环;③95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s。qRT-PCR试验结果采用2-ΔΔCt方法计算基因的相对表达量。
1.7 数据分析
数据结果以“平均值±标准差”来表示,采用SPSS 20.0软件中的单因素方差分析和相关回归分析方法进行统计分析,P< 0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同组别鸭蛋重差异分析
由表2可见,低蛋重组、中蛋重组和高蛋重组三组间无论在300日龄还是450日龄蛋重差异均显著(P<0.05)。

表2 不同组别鸭蛋重差异分析
2.2 RORB基因突变位点不同基因型鸭蛋重差异分析
由于RORB基因位于母鸭的Z号染色体,该染色体仅有1条,由表3可见,RORB基因Z-35251072 C>T和Z-35256947 T>C突变位点的碱基类型在300 d蛋重差异不显著(P>0.05),450 d蛋重差异显著(P<0.05),RORB基因Z-35278196 T>C的突变位点的不同碱基类型在300 d和450 d的蛋重差异均显著(P<0.05)。
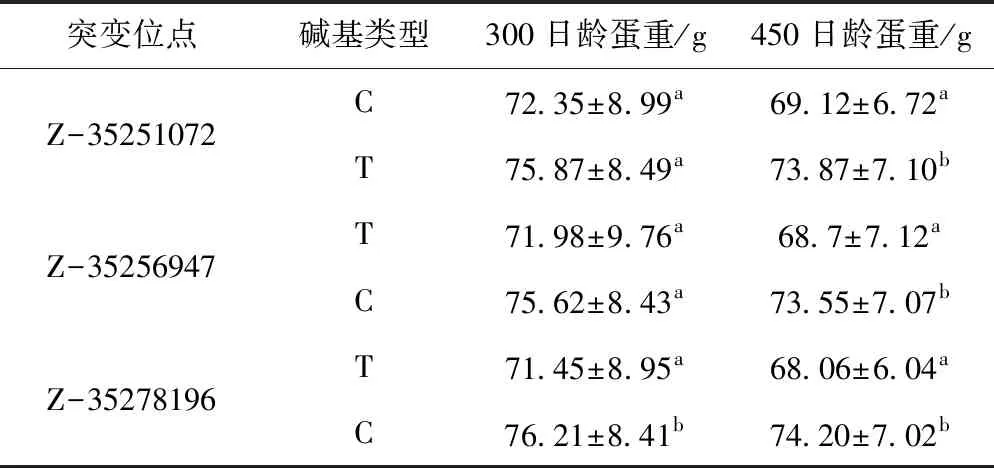
表3 RORB基因突变位点不同碱基类型鸭蛋重差异分析
2.3 鸭RORB各突变位点相互间及与产蛋性能的相关性分析
由表4可见,鸭RORB基因Z-35251072 C>T,Z-35256947 T>C,Z-35278196 T>C 3个突变位点相互间呈显著正相关,即若Z-35251072位点是野生型C,则Z-35251072 和Z-35256947位点也多为野生型T,反之亦然;Z-35278196 T>C和Z-35256947 T>C 2突变位点与300 d蛋重呈不显著负相关(P>0.05),与450d蛋重呈显著负相关(P<0.05);Z-35278196 T>C突变位点与300日龄蛋重和450日龄蛋重均呈显著负相关(P<0.05)。
2.4 鸭RORB及其相关基因表达量差异分析
由表5可见,RORB和PER2基因在低蛋重组的表达量显著高于中蛋重和高蛋重组(P<0.05),在高蛋重和中蛋重组间的差异不显著(P>0.05),CLOCK和BMAL1基因在高蛋重组的表达量显著高于中蛋重和低蛋重组(P<0.05),在中蛋重和低蛋重组间差异不显著(P>0.05)。
3 讨论
生物节律是一种被广泛认知的生物体随昼夜周期变化而呈现的生命活动周期性变化的现象。在家禽中生物节律对性腺发育、产蛋周期以及生长等具有调节作用[23],而其本质是受时钟基因的节律性表达的影响。在鸡中对产蛋量高和低的母鸡的大白卵泡、小黄卵泡和大黄卵泡3个发育阶段的卵泡转录组研究中发现18个与产卵相关的候选基因,其中包括RORB[24],提示RORB与禽产卵相关的发育相关,本研究首次发现影响鸭的300日龄和/或450日龄蛋重的鸭RORB基因Z-35251072上C→T,Z-35256947上T→C,Z-35278196上T→C 3个突变位点,且这3个遗传突变相互间呈正相关,与蛋重呈显著负相关。遗传上,产蛋数和蛋重呈负相关,且高达-0.4[25],在茶花鸡上的研究表明43周龄蛋重与43周龄产蛋数相关系数为-0.043[26],由此推测鸭的RORB的遗传突变与鸭的300日龄和450日龄产蛋量呈正相关,再次为RORB基因在禽产卵过程中发挥作用提供理论依据。
本课题组前期通过转录组测序的方法对不同产蛋量鸭基因表达差异研究发现,产蛋鸭卵巢中昼夜节律信号通路相关基因尤其是生物钟基因CLOCK,PER2的表达水平与产蛋量密切相关[27],而且CLOCK和PER2在鸭的不同等级卵泡中均有表达。也有研究发现产蛋鸡漏斗部(捕获蛋黄的部位)和子宫部(形成蛋壳的部位)的生物钟基因BMAL1、CLOCK、PER2和PER3在排卵过程中发挥了重要作用[28]。在本研究中,鸭RORB和PER2在蛋重低组表达量显著增高,而CLOCK和BMAL1在蛋重高组表达量显著增高,这一结果提示昼夜节律相关基因RORB、PER2、CLOCK、BMAL1在调节鸭的蛋重中可能发挥重要作用。研究表明,在分子水平上,时钟系统由几个互为联系的负反馈和正前馈回路组成的整体网络。生物钟的基本分子循环系统在组织之间是相似的,正环主要由基本螺旋-环-螺旋/PAS型转录激活子BMAL1和CLOCK或其旁系同源物NPAS2组成,而2种隐色素(CRY)和3个周期蛋白(PER)参与循环通路的负性调控[12,19-21,29]。BMAL1时钟异二聚体通过与靶基因启动子调控区中的E-box增强子(CACGTG)相互作用,积极调节许多基因的昼夜节律表达,包括PER和CRY。当PER和CRY蛋白积累到临界水平时,其又通过直接与BMAL1-CLOCK复合物相互作用抑制BMAL1-CLOCK介导的转录,包括其自身的转录,随后导致PER和CRY蛋白水平降低,并导致新的激活和抑制循环[12]。本研究发现,CLOCK和BMAL1基因呈现一致性的表达变化,与PER2基因的表达变化相反,这一结果与上述的循环通路的调控理论是相符的,而RORB与PER2的基因表达呈一致性的变化,据此推测鸭RORB对昼夜节律时钟网络具有负调控作用。本研究结果进一步丰富了鸭昼夜节律相关基因,尤其是鸭RORB的相关研究,为鸭的产蛋性能调控奠定理论基础。
4 结论
本研究通过Illumina测序的方法检测了金定鸭RORB基因上Z-35251072、 Z-35256947、Z-35278196这3个位点的SNP突变情况,并分析了其与蛋重的相关性,证实3个SNP的突变与蛋重显著负相关;RORB及相关基因的表达在不同蛋重组中差异显著;这些结果提示RORB基因在蛋重的调节中可能具有重要作用。
——称蛋重

