ω-3 多不饱和脂肪酸促进1型糖尿病模型小鼠胰岛β细胞再生的作用研究
邢朝凤,唐敏怡,徐绮华,张宗猛,封文斌,穆云萍,李芳红,赵子建
(广东工业大学生物医药学院,广东 广州 510006)
1型糖尿病(type 1 diabetes mellitus,T1DM)主要是由自身免疫T淋巴细胞介导胰岛β细胞破坏,导致胰岛素分泌严重不足引起[1]。目前,T1DM治疗以终身每日注射重组胰岛素为主,重组胰岛素的应用为T1DM患者的治疗做出了巨大的贡献,能够大幅延长患者的生命。然而,注射外源性胰岛素时常发生严重的低血糖,而且T1DM患者也容易出现并发症,如视网膜病变、神经病变和心血管疾病。但是目前还无有效的手段能够阻断自身免疫进程对胰岛的攻击,以及延缓早期患者疾病的进展。大量研究尝试利用特异的单克隆抗体作为自身免疫的拮抗药物[2-3],以干预自身免疫系统攻击胰岛的进程。但是这类药物非常昂贵,而且有各种副作用,不适合长期应用于T1DM治疗。
自Edmonton Protocol 10公布以来,异体胰岛移植曾经为T1DM患者能够摆脱终身胰岛素治疗,根治糖尿病带来很大的希望。2000年的研究揭示了使用胰岛移植替代胰岛素疗法治疗T1DM的潜力,7名受试患者持续1年没有补充外源性胰岛素[4]。此后,1 000多名T1DM患者单独或在肾移植后接受了胰岛移植治疗[5]。然而,由于胰腺供体的匮乏,并且移植的胰岛在一年左右开始纤维化[6],长期存活效果欠佳,且患者需要长期使用免疫抑制剂和抗排异反应的药物等一系列原因,因此,在近期实施临床胰岛移植的患者数量大幅减少,已经无法成为摆脱终身注射胰岛素治疗T1DM的新型疗法。因此,探索胰岛β 细胞再生,从细胞水平增加分泌胰岛素的细胞数量,成为糖尿病治疗倍受期待的选择。
最近的一系列遗传学和临床研究揭示,ω-3 PUFAs在抑制自身免疫以及保护和增强胰岛功能方面的机制和治疗潜力[7]。在动物研究中,Otani等研究表明,妊娠期和哺乳期母体饮食中ω-6/ω-3 PUFAs的比例较低(3.0),推迟了非肥胖型糖尿病(non-obese diabetes,NOD)小鼠后代糖尿病的发病时间。两项大规模临床观察研究显示,通过对婴儿和儿童使用富含EPA/DHA的药物进行早期干预,对T1DM的发生发展具有明显的预防和治疗作用。Stene等在一项基于大规模人群的病例对照研究中报道,在出生后第一年饮食补充鱼肝油和维生素D可明显降低儿童期T1DM的发病率。
本课题组前期研究发现NOD小鼠通过mfat-1转基因表达能够提高ω-3 PUFAs的含量,进而几乎完全阻止了胰腺β细胞受到促炎细胞因子的攻击,同时明显增加了胰岛素的分泌[8]。为了证明ω-3 PUFAs并非通过抑制自身免疫攻击胰岛β细胞,从而缓解机体的胰岛素分泌不足的情况,本研究使用STZ诱导小鼠胰岛β细胞损伤模型,探索ω-3 PUFAs促进胰岛α细胞转分化为β细胞的作用,为将来利用 ω-3 PUFAs 预防与治疗T1DM的方案提供理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性C57BL/6J小鼠(6周)购自江苏集萃药康生物科技有限公司,mfat-1小鼠是本实验室构建。实验小鼠均饲养于华南理工大学大学城校区 SPF级实验动物中心,动物中心使用许可证号: SYXK(粤)2017-0178。 研究方案获得华南理工大学动物实验伦理委员会批准。
1.1.2主要试剂 STZ(S0130)和鼠抗 glucagon(G2654)单克隆抗体购自 Sigma公司;兔抗 insulin(4590s)单克隆抗体、兔抗Alexa Flour 488(4412s)荧光二抗和鼠抗Alexa Flour 555(4409s)荧光二抗均购自Cell Signal Technology公司 ;97% EPA乙酯(批号:02200201)购自成都国为生物医药有限公司;75%鱼油(EPA ∶DHA=25% ∶50%)购自上海贺普实业有限公司;小鼠胰岛素ELISA试剂盒(90080)购自Crystal Chem公司。
1.1.3仪器 GC气相色谱仪(美国Agilent);激光共聚焦(德国 Zeiss);酶标仪(瑞士Tecan);低温离心机(美国Thermo);石蜡包埋机(德国SLEE);冷冻台(中威电子仪器有限公司);石蜡切片机(美国Thermo);qTOWER3G analytic(德国 Jena)。
1.2 方法
1.2.1T1DM小鼠模型的建立与分组 取7周的野生型C57BL/6J 和mfat-1雄性小鼠,腹腔注射溶于无菌柠檬酸缓冲液(pH 4.5,0.05 mmol·L-1柠檬酸钠)的STZ,剂量为60 mg·kg-1,连续给药5 d。1周后取尾部静脉血,检测血糖连续2周高于11.1 mmol·L-1的小鼠,确认为糖尿病小鼠模型。随后进行以下实验分组:野生型(WT)组; mfat-1组; EPA组;鱼油(fish oil)组。
1.2.2细胞培养 利用小鼠胰岛α细胞系αTC1进行体外培养。首先在细胞培养基中分别加入5 μmol·L-1DHA+EPA,5 μmol·L-1EPA给予细胞适应性培养7 d,之后分别增加ω-3 PUFAs总浓度至25 μmol·L-1,对照组加入相应浓度的DMSO,即分为DMSO(Con)组、EPA组、DHA+EPA组。培养4周之后,经过固定,利用荧光染色标记胰岛素(insulin)和胰高血糖素(glucagon),并使用荧光共聚焦显微镜观察记录。
1.2.3ELISA法检测小鼠血清中insulin水平 糖耐受试验过程中在0、30、60和90 min小鼠尾部取血,分离血清,按照小鼠胰岛素ELISA试剂盒说明书检测糖耐受过程中各时间点小鼠insulin水平。
1.2.4免疫荧光法检测细胞和小鼠胰腺组织中insulin与glucagon表达水平 将细胞系以5×105L-1的密度接种,ω-3 PUFAs处理后,PBS洗去残留培养基,4%多聚甲醛固定 30 min,PBS清洗后用1/1 000的Triton-100室温下穿透20 min,清洗后用1%牛血清白蛋白室温下封闭1 h,吸去封闭液,加入一抗(1 ∶100兔抗insulin,1 ∶1 000鼠抗glucagon)4 ℃孵育过夜,第2天,PBS清洗3次后,加入二抗(1 ∶1 000兔抗Alexa Flour 488,1 ∶1 000鼠抗Alexa Flour 555),室温避光孵育1 h,PBS清洗后滴加DAPI室温避光孵育5 min,PBS清洗,滴加抗荧光淬灭封片剂,在荧光显微镜下拍摄。

2 结果
2.1 ω-3 PUFAs对αTC1细胞系胰岛素分泌的影响结果显示,在DHA与EPA 1 ∶1混合处理组以及单独使用EPA处理4周后,胰岛α细胞可产生胰岛素(Fig 1),而对照组细胞未发现胰岛素染色阳性,表明,ω-3 PUFAs可以在体外培养条件下促进α细胞分泌胰岛素。
2.2 ω-3 PUFAs对αTC1细胞系向β细胞转分化的影响利用qRT-PCR法检测3组细胞培养4周后关键转录因子的mRNA在细胞中的表达情况,并发现相较于对照组细胞,调控胰岛素表达的关键基因ins1、ins2在EPA以及DHA+EPA共同培养后均明显提高。胰-十二指肠同源盒1(pdx1)基因作为胰岛素基因转录激活的关键性调控因子,也是胰岛β细胞的特异性表达基因。结果显示,pdx1在EPA单独培养组中表达明显提高,而且在DHA+EPA组中也有明显增强。Pax4 是β 细胞和δ 细胞分化过程中的一个关键性的转录因子,在胰腺发育过程中控制着内分泌细胞的命运。在DHA+EPA组中,Pax4表达的明显增强表明α细胞正在向β 细胞方向分化。
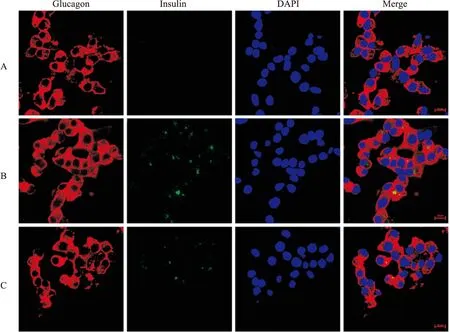
Fig 1 Confocal images of αTC1(insulin, green; glucagon, red; DAPI, blue)

Fig 2 Expression of specific genes in pancreatic α cells and pancreatic β
2.3 ω-3 PUFAs 对糖尿病小鼠随机血糖水平的影响在明确了ω-3 PUFAs 能够促进α细胞向β细胞方向分化之后,进一步利用WT和mfat-1转基因小鼠连续5 d注射STZ(60 mg·kg-1)诱发糖尿病,并在注射STZ 6周后,选取连续2周随机血糖均超过11.1 mmol·L-1的WT小鼠给予按体质量4 g·kg-1的EPA和fish oil(50%EPA和25%DHA)治疗。结果显示, mfat-1组小鼠在注射STZ后随机血糖明显低于WT组模型小鼠,并且野生型模型小鼠给予EPA治疗后其随机血糖水平也明显下调,而fish oil组小鼠的随机血糖与WT组相比差异无显著性,但是呈现了下调趋势(Fig 3A)。表明,内源性和外源性ω-3 PUFAs对T1DM均有明显的防治作用。
2.4 ω-3 PUFAs对糖尿病小鼠葡萄糖稳态的影响随机血糖水平升高的直接原因之一是由体内血清胰岛素水平下降导致的葡萄糖耐量降低,如果糖耐量试验后30 min 内血糖超过7.8 mmol·L-1,则表明胰岛β细胞储存和释放胰岛素的功能受损,机体对葡萄糖的吸收和利用能力下降,这是诊断糖尿病的确诊试验。本研究结果显示, STZ给药第11周,分别向各组小鼠腹腔注射葡萄糖,30 min 后WT和mfat-1小鼠血糖开始恢复,从第60 min开始,ω-3 PUFAs干预组小鼠血糖明显低于WT组小鼠(Fig 3B)。此外,葡萄糖耐量试验(injection glucose tolerance tests,IGTT)结果显示,ω-3 PUFAs干预组曲线下面积(area under the curve,AUC)明显低于WT模型组,表明ω-3 PUFAs明显改善机体对葡萄糖的吸收与利用,降低血糖总量(Fig 3C)。
机体葡萄糖耐量增加或降低,一方面受血清胰岛素的直接调控,另一方面也可能是外周胰岛素抵抗的下降或增高所致。因此在进行IGTT 试验的同时,在腹腔注射葡萄糖 0、30、60和90 min后经尾部取血检测各组小鼠血清胰岛素水平。结果显示,空腹时mfat-1组和EPA组小鼠相较于WT组小鼠明显上调,给予葡萄糖刺激30 min后,各组小鼠血清中的胰岛素水平没有明显差异,但60 min 和90 min后,ω-3 PUFAs干预组血清胰岛素分泌水平明显高于WT组(Fig 3D),表明,ω-3 PUFAs 明显改善STZ引起的T1DM小鼠β细胞胰岛素分泌功能。为了进一步探究ω-3 PUFAs增强葡萄糖耐受性与葡萄糖诱导的胰岛素分泌增加之间的联系,本研究继续展开了胰岛素耐受性试验,结果显示,造模30 min后,4组小鼠血糖水平没有明显差异(Fig 3E,F),表明ω-3 PUFAs可促进STZ诱发的T1DM小鼠葡萄糖代谢的正常化。
2.5 ω-3 PUFAs干预对小鼠胰腺中多不饱和脂肪酸含量和比例的影响利用气相色谱检测各组小鼠胰腺中各种PUFAs 含量,结果如Tab 1 所示,与WT组相比,mfat-1组、EPA组和fish oil组小鼠胰腺组织中α-LA、EPA以及C22:5含量明显高于WT组(P<0.01),而外周血中AA含量明显低于WT(P<0.01)。此外,ω-3 PUFAs干预明显降低胰腺组织中ω-6/ω-3 PUFAs的比例,表明内外源性ω-3 PUFAs均能够促进小鼠体内的ω-6 PUFAs转化为ω-3 PUFAs,降低ω-6/ω-3 PUFAs比例,为进一步探究ω-3 PUFAs 防治T1DM的发生发展奠定了基础。
2.6 ω-3 PUFAs 对糖尿病小鼠胰岛β细胞再生的影响本研究进一步利用免疫荧光技术,检测WT组和mfat-1组(注射STZ第12周)小鼠胰岛的功能,观察两组小鼠分泌胰岛素与胰高血糖素功能的变化。结果显示,与WT组相比,ω-3 PUFAs干预组小鼠部分胰岛细胞恢复了分泌胰岛素功能,进而可以维持正常的血糖浓度以及糖代谢水平,且存在可同时分泌胰岛素和胰高血糖素的细胞(Fig 4),表明ω-3 PUFAs干预可促进胰岛α细胞转分化为β细胞。但ω-3 PUFAs促进胰岛β细胞再生以及α细胞转分化的分子机制还有待进一步研究。
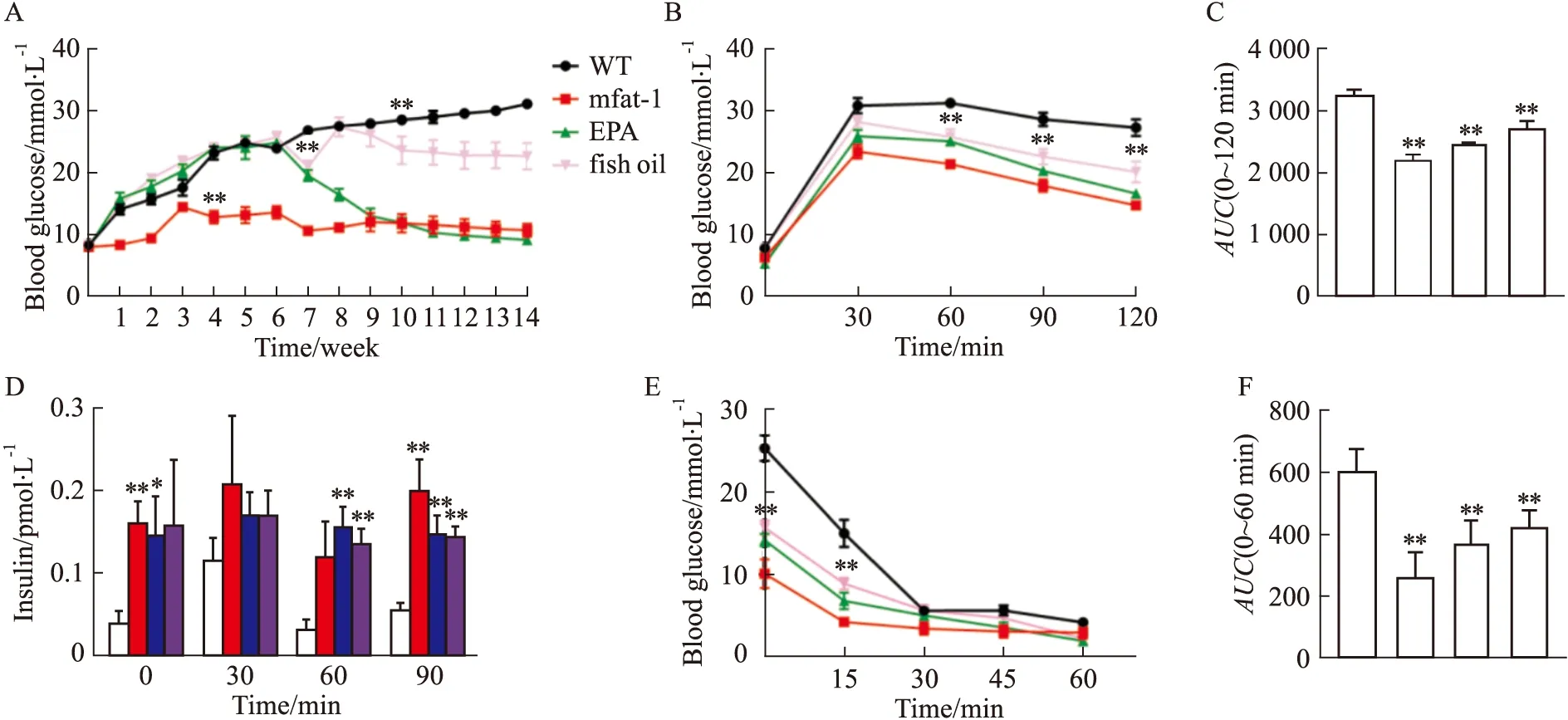
Fig 3 ω-3 PUFAs normalized glucose metabolism in T1DM
Tab 1 Analysis of ω-3 PUFAs and ω-6 PUFAs composition and rations in pancreatic samples of
3 讨论
T1DM的发病率和患病率在全球范围内有很大差异[9-10],不同国家的发病率随着时间的推移而发生变化[11],但T1DM一直是儿童最常见的慢性疾病之一[12]。无论是T1DM还是T2DM最终都引起胰腺β细胞丢失和慢性高血糖。在人类中,β细胞增殖发生在发育早期,成年人的β细胞增殖水平很低,几乎检测不到[13]。因此,依赖于重新激活成人β细胞增殖来治疗T1DM在正常情况下是一个不切实际的幻想。重要的是,尽管糖尿病治疗取得了最新进展,但与健康个体相比,T1DM患者仍然显示出较短的预期寿命和恶化的生活质量。目前旨在开发替代疗法,使用不同来源的细胞(例如干细胞,前体或分化细胞)替换丢失的β细胞成为一种有前途的治疗方法。然而,尽管在体外模仿胚胎β细胞发育方面取得了重大进展,但仍然需要更深入地了解胰岛β细胞发生发展的遗传程序,以最终产生完全分化的β细胞。有研究表明,在产生胰高血糖素的细胞中异位表达Pax4,其可以转化为产生胰岛素的β样细胞[14]。研究发现Pax4在小鼠α细胞中的错误表达也诱导其新生和转化为β样细胞,这些细胞具有分泌胰岛素的功能,并允许逆转化学诱导的高血糖的多个循环。研究还发现胰高血糖素细胞中Arx活性的下调是α转化为β样细胞的主要触发因素。在T1DM研究的背景下,产生胰高血糖素的细胞的再生能力及其转化为β样细胞的潜力非常有趣。然而,上述转基因方法并不能转化为人类糖尿病的治疗方法。
已有研究揭示,利用营养干预或基因治疗手段提高体内ω-3 多不饱和脂肪酸水平,可以实现早期干预、延缓和逆转T 细胞亚群失衡导致的自身免疫进程以及T1DM的进展,更意外发现了胰岛α细胞转分化为分泌胰岛素的β细胞的现象[15]。本研究结果发现,αTC1细胞中添加EPA或者EPA+DHA培养一段时间后开始表达胰岛素,EPA处理组胰岛β细胞特异性基因ins 1、ins 2以及pdx 1不仅相较于对照组明显上调而且与EPA+DHA处理组相比也明显上调,说明EPA更能促进胰岛α细胞转分化为胰岛β细胞。
在STZ诱导的糖尿病模型中,过表达 mfat-1 基因从而使胰腺富集 ω-3 PUFAs 也可以预防糖尿病的发生发展[16]。然而,最近研究发现,ω-3 PUFAs喂养无法模拟在 mfat-1转基因小鼠中观察到对胰岛β细胞的保护作用,引起这些争论的原因可能是混杂饮食因素,喂养过程可能会产生许多变量,包括所用油中的杂质、食物储存和饮食持续时间,这些都会影响组织中脂肪酸的分布。通过转基因表达mfat-1,细胞增加ω-3 PUFAs 和减少ω-6 PUFAs 可增强分离的胰岛和胰岛中葡萄糖、氨基酸和 GLP-1 刺激的胰岛素分泌[17]。本研究发现,与 WT 相比,在 mfat-1 转基因小鼠中观察到的更高血清胰岛素水平和更大的胰岛,与最近报道的 mfat-1转基因小鼠胰岛数据一致[8]。
本研究最引人注目的是,无论在糖尿病小鼠中内源性的将ω-6 PUFAs转化为ω-3 PUFAs,还是外源补充ω-3 PUFAs后,都能促进小鼠血糖水平的稳定和正常化,并且补充EPA的效果尤为明显。这充分说明,血浆和胰腺中丰富的ω-3 PUFAs可以保护小鼠免受STZ引起的胰岛β细胞破坏,ω-3 PUFAs水平与高血糖防治密切相关。研究发现,即使在T1DM和T2DM患者胰岛中仍然存在大量有生理功能的胰岛α细胞,Thorel等通过选择性表达大鼠胰岛素启动子下游的白喉毒素受体,发现随着99% β细胞的消融,α细胞可进入“双激素”(同时表达胰岛素和胰高血糖素)状态并进一步发展为单一胰岛素分泌细胞,表明β细胞再生可源于非β细胞,同时提示α细胞在β细胞团的损伤修复中发挥重要作用[18]。本文研究结果同样发现了无论是mfat-1小鼠还是营养干预的小鼠胰腺组织切片,都存在胰岛α细胞和胰岛β细胞共定位现象,即α细胞进入了“双激素”状态,表明 ω-3 PUFAs 在胰岛β细胞损伤的情况下,可促进胰岛α细胞转分化为胰岛β细胞,但是是否能够促进胰岛α细胞完全转化为胰岛β细胞还有待进一步研究。
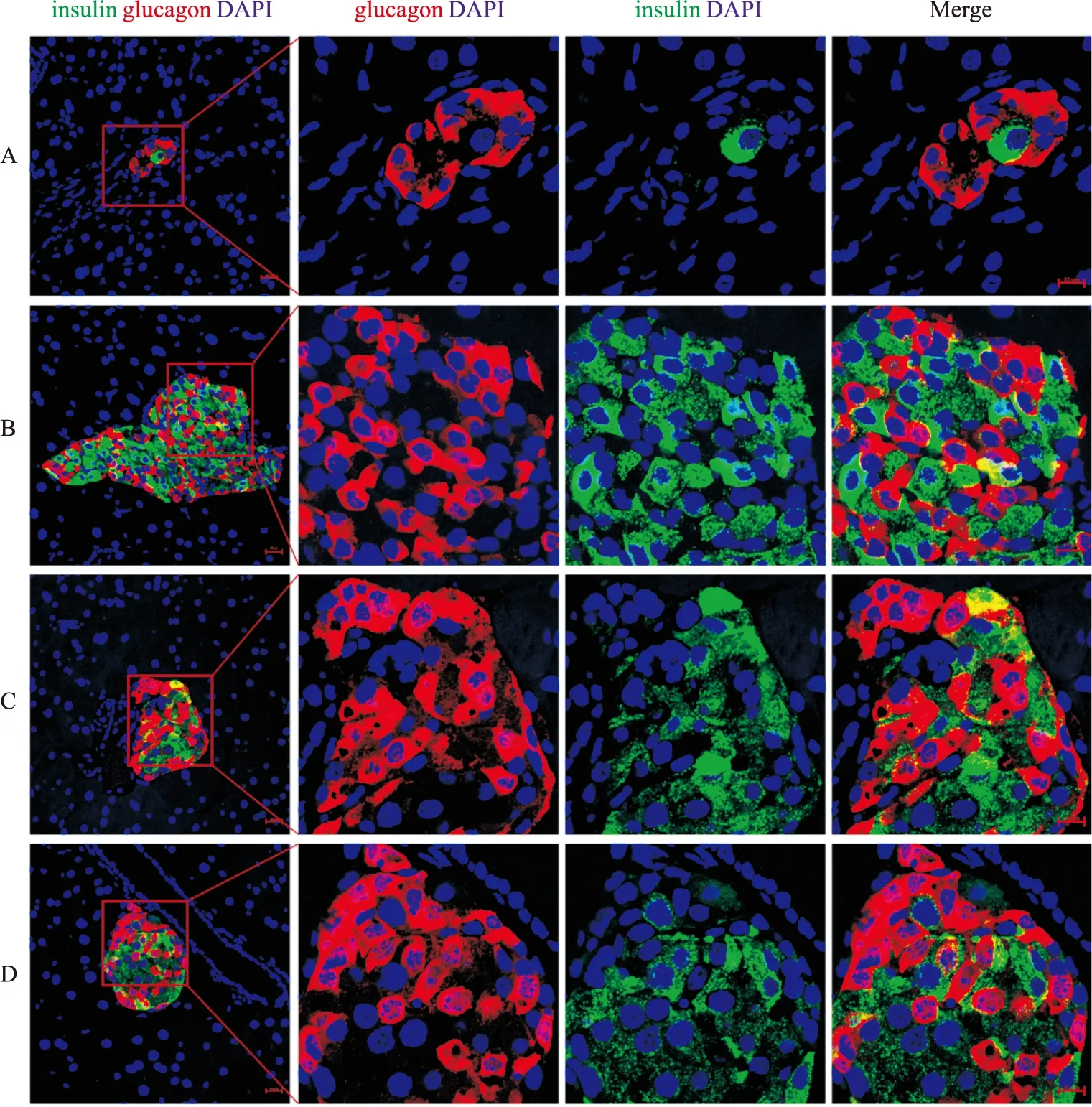
Fig 4 Islet and β cell regeneration and colocalization of α cells and β cells in diabetic mice treated with ω-3 PUFAs
综上所述,本研究首次证明转基因表达mfat-1及胰腺富集 ω-3 PUFAs可以预防并治疗化学药物诱导的糖尿病;并且EPA扮演了至关重要的角色,其作用是通过促进胰岛α细胞转分化为胰岛β细胞,从而增加胰岛素的分泌预防及治疗T1DM。本研究为ω-3 PUFAs 防治T1DM 提供了理论基础,但其相关机制有待深入研究。

