二甲双胍通过miR-129-5p缓解脓毒症相关肺损伤
袁 媛, 刘金虹, 袁江汉, 周发春
(1.重庆医科大学附属第一医院重症医学科,重庆 400016;2.天津市宝坻区人民医院药剂科,天津医科大学宝坻临床学院,天津 301800)
脓毒症是由宿主对感染反应失调所引起的危及生命的器官功能障碍,其死亡率可高达25%~30%[1]。脓毒症发病机制极其复杂,包括炎症失衡、免疫功能障碍、细胞自噬等[2]。脓毒症伴随的多器官功能障碍是重症患者死亡的重要原因。尽管目前脓毒症治疗已取得较大进展,但脓毒症合并急性肺损伤(acute lung injury, ALI)患者的死亡率仍高达30%~40%[3],远远高于其他有ALI因素的患者。促炎和抗炎细胞因子的相互作用和随后的级联激活引起的全身炎症反应失衡被认为是ALI发病的关键。失衡的炎症反应,导致脓毒症相关肺损伤,血管通透性增加,肺组织水肿、结构破坏,从而引发功能障碍[4]。因此,研究脓毒症相关肺损伤中有效的抗炎药物治疗具有重要意义。
MET因具有安全性高、价格低廉以及出色的降糖能力,被推荐为2型糖尿病( type 2 diabetes mellitus, T2DM)治疗的首选用药。除了降糖作用外,二甲双胍还被证实具有抑炎作用。MET还可通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/蛋白激酶(B protein kinase B, AKT)通路,抑制脓毒症大鼠体内炎症反应,减少神经元细胞凋亡达到脑保护作用[5]。
微小RNA(microRNAs, miRNA)是一类重要的非编码小RNA,在多种疾病的发生发展过程中扮演重要角色。miRNA已被证实参与脓毒症调控,miR-129-5p作为miRNA一员被证实可减轻过氧化氢诱导的细胞自噬和凋亡[6]。在脓毒症小鼠模型中,miR-129-5p还可通过调节肺表面活性蛋白D(surfactant protein D, Sp-D)表达减轻脓毒症引起的急性肠道功能损伤[7]。二甲双胍已被证实可通过调节miRNA表达,起到器官功能保护作用,在糖尿病视网膜血管病变中,MET可通过与miRNA的结合减缓疾病进展,并可通过调节miR-138-5p表达,参与炎症调控,缓解肺损伤[8]。然而,MET在脓毒症相关肺损伤中的作用是否与miR-129-5p相关尚未报道,本研究拟通过观察MET对脓毒症中miR-129-5p水平、炎性因子表达和肺损伤的影响,来初步判断MET和miR-129-5p的关系及可能机制研究。
1 材料与方法
1.1 主要材料小鼠肺泡巨噬细胞(mouse alveolar macrophages, MHS)购于美国ATCC公司,LPS(Sigma, 美国),MET(麦克林,上海),Lipofectamine 6000促转剂、CCK-8试剂盒、RIPA裂解液、BCA试剂盒(碧云天,中国),miR-129-5p模拟物(mimic)、抑制剂(inhibitor)和阴性对照(NC)由上海吉玛公司构建,SPF级雄性C57BL/6小鼠,购于重庆医科大学实验动物中心,TRIzol试剂 (Ambion, 美国),cDNA 逆转录试剂盒(Accurate, 中国) ,SYBR Green Master Mix (TaKaRa, 日本),ELISA检测试剂盒(Thermo,美国),PI3K抗体(48184)、p-PI3K(12057)、AKT抗体(33224)以及p-AKT(13357)抗体均购自(SAB,美国)、流式细胞仪(Becton-Dickinson, 美国)、Annexin V-FITC/PI凋亡检测试剂盒(碧云天,中国)。
1.2 细胞复苏与造模MHS细胞加入培养基,置于孵箱培育。分3组:对照组,无LPS及MET处理;LPS组,加入LPS(100 μg·L-1);LPS+MET组,加入MET,培育2 h后,加入LPS,继续培育。
1.3 细胞转染以2×105个细胞/孔的密度将细胞接种于6孔板, 孵箱中培育,当细胞增殖达70%~80% 时,使用促转剂转染,孵育48 h, 收集用于后续实验。
1.4 CCK-8检测以3×104个细胞/孔的密度将细胞接种于96孔板,24 h后,将细胞与不同浓度(1、2、3、4、5、6 μmol·L-1)MET一起孵育2 h,然后用或不用LPS继续处理6 h,最后在每孔中加入CCK-8溶液,孵育2 h,450 nm处测量A值。计算细胞存活率。
1.5 流式细胞术以4×105个细胞/孔的密度将细胞接种于6孔板,贴壁24 h后,加入MET(4 μmol·L-1)孵育,2 h后加入LPS继续处理6 h。干预结束后,同时收集培养基中悬浮细胞及贴壁细胞,其中贴壁细胞以0.25%胰酶(不含EDTA)消化变圆则终止。1 000 r·min-1离心5 min,洗涤2次,以500 μL Annexin V-PI结合液调至浓度1×109L-1单细胞悬液,加入5 μL Annexin V-FITC,混匀,后加入10 μL PI染色液混匀,室温避光孵育20 min,冰浴上机待用。
1.6 动物和造模SPF级雄性C57BL/6J小鼠60只(鼠龄6~8周,体质量为18~23 g),动物使用许可证号:SCXK-(渝)2018-0003。小鼠随机分为3组(n=20)。盲肠结扎穿孔(Cecal ligation and puncture,CLP)手术组[9]:小鼠戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉,剃毛,消毒,沿腹中线垂直切开,找到盲肠,在其末端1/3处结扎,2 mm三棱针穿刺盲肠末端2孔,后还纳。假手术(Sham)组:不进行盲肠结扎穿孔;CLP+MET组:术前给予小鼠MET(200 mg·kg-1)腹腔内注射,30 min后进行造模。3组小鼠术后均进行常规复苏。
1.7 动物取材造模成功24 h后行动物取材,小鼠麻醉,眼球取血,离心取上清,采血后脱颈处死小鼠,手术分离肺组织,洗净吸干水分,多聚甲醛固定。
1.8 肺组织HE染色固定备用的肺组织,经乙醇梯度脱水,常规石蜡包埋切片,病理HE染色后,在低倍镜下观察各组小鼠肺组织的病理变化。
1.9 肺组织湿干比(W/D)左肺洗净后用滤纸吸干,称量湿重。然后置于80 ℃烤箱48 h至恒重后再次称量干重,计算W/D值。
1.10 RT-qPCR检测TRIzol法从肺组织和细胞中分离总RNA,cDNA逆转录。使用SYBR Green Master Mix在实时PCR系统上进行RT-qPCR,U6为内参,反应体系10 μL,扩增条件为:95 ℃预变性30 s,然后95℃变性5 s,60 ℃退火20 s,共40个循环。miRNA-129-5p引物序列为: 5′-GCGGTCTGGGC-3′(前引物),3′-CGGGTCTGGCG-5′(后引物)。每个样本设置3个复孔。利用2-ΔΔCT公式计算miR-129-5p的表达水平。
1.11 ELISA实验酶联免疫吸附法(ELISA)测定细胞及小鼠血清中TNF-α、IL-6、IL-1β含量,实验步骤严格按ELISA检测试剂盒说明操作。测450 nm处A值,做标准曲线,根据标准曲线方程计算浓度。
1.12 Western blot检测RIPA裂解液裂解肺组织和细胞,离心,取上清,BCA法检测蛋白浓度。加入蛋白上样缓冲液,100 ℃孵育使蛋白变性,电泳、转膜,室温下封闭膜1.5 h后。加入配好的一抗,4 ℃孵育摇床过夜,TBST反复洗涤3次。然后将膜与二抗室温下孵育1 h后,洗膜,显影,ImageJ软件通过灰度扫描分析蛋白质印迹结果。

2 结果
2.1 MET可增强细胞活力LPS处理后,MHS细胞的活力明显降低,不同浓度MET处理(1、2、3、4、5、6 μmol·L-1)后的细胞活力没有明显变化。然而,MET干预后LPS诱导的细胞模型其活力不同程度增强,以4 μmol·L-1时最明显。
2.2 MET下调LPS诱导的促炎因子表达LPS可以刺激巨噬细胞产生促炎因子,诱发炎症反应。将MHS细胞暴露于LPS,IL-6、TNF-α和IL-1β的表达增加,以6 h时最明显(Fig 2)。然而,这些促炎因子在MET干预后被明显抑制。
2.3 MET可抑制LPS诱导的细胞凋亡LPS干预后可见细胞凋亡明显增加,而MET(4 μmol·L-1)干预后可逆转LPS诱导的细胞凋亡。
2.4 MET可逆转LPS所致的miR-129-5p低表达检测发现LPS诱导的MHS细胞miR-129-5p的表达降低,以6h降低最明显。而MET干预后细胞内miR-129-5p的表达可显著升高。
2.5 下调miR-129-5p逆转MET在细胞中的抗炎及细胞保护作用miRNA在脓毒症的发生发展中起着重要作用,课题组前期研究发现,miR-129-5p在脓毒症患者体内表达呈低水平[10]。为了进一步验证,分别转染miR-129-5p mimic和inhibitor。如Fig 5A所示,转染后,miR-129-5p的表达显著升高或降低,表明转染成功。同时miR-129-5p inhibitor可促进LPS诱导的TNF-α、IL-6、IL-1β的表达,miR-129-5p mimic则下调促炎因子的表达。且miR-129-5p inhibitor可逆转MET的抗炎效应。同样,miR-129-5p水平可影响细胞活力,抑制miR-129-5p可逆转MET对细胞的保护作用。
2.6 MET可上调LPS干预后的PI3K/AKT信号通路各蛋白的水平如Fig 6所示,敲低miR-129-5p时,p-PI3K、p-AKT的蛋白水平下调。MET干预后p-PI3K、p-AKT的蛋白水平升高。而下调miR-129-5p的表达可逆转MET对PI3K、AKT的磷酸化。

Fig 1 Viability of MHS cells after MET

Fig 2 LPS-induced inflammatory response down-regulated by
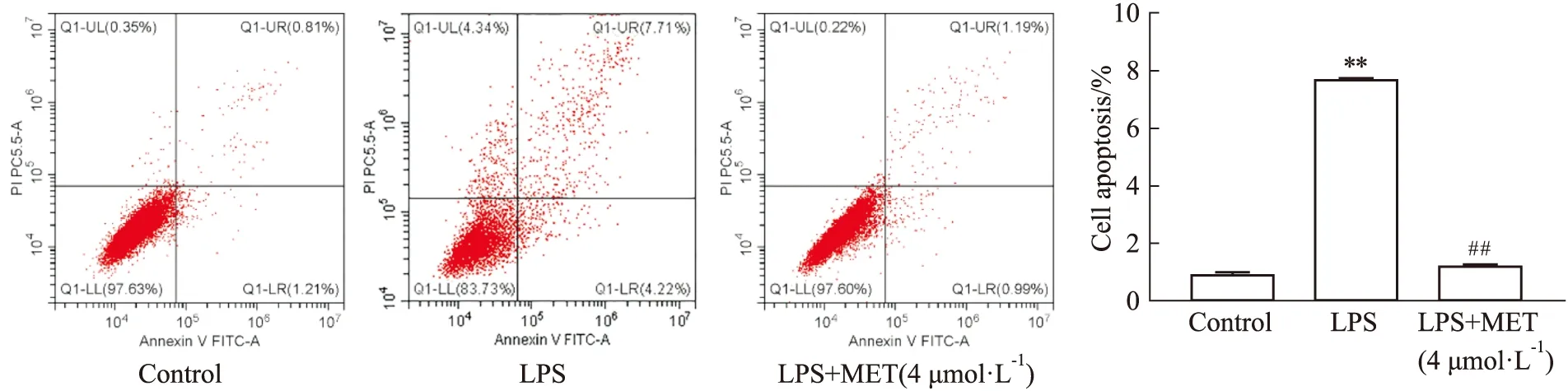
Fig 3 Cell apoptosis after MET **P<0.01 vs Control group; ##P<0.01 vs LPS group.

Fig 4 Expression of miR-129-5p after MET
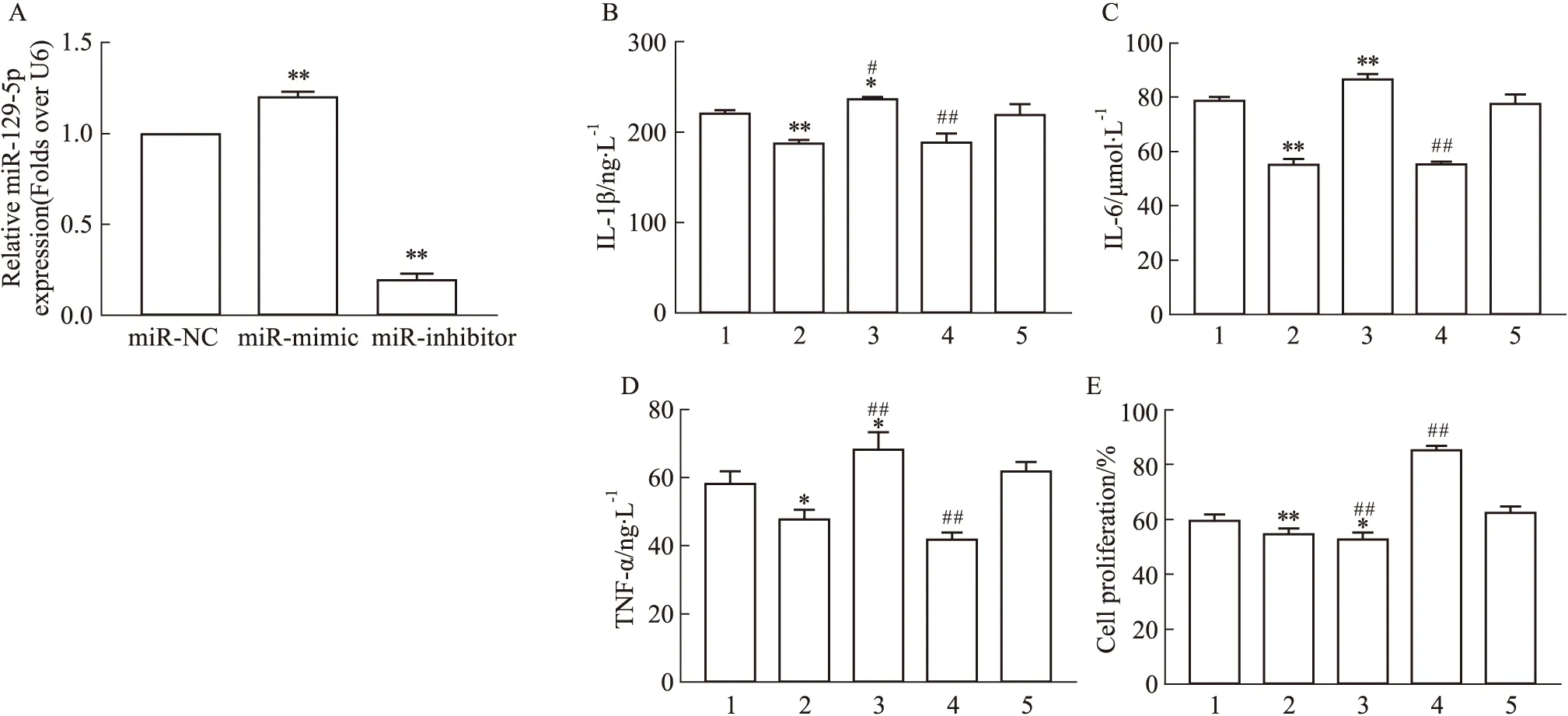
Fig 5 Anti-inflammatory and cytoprotective effects of MET reversed by inhibition of
2.7 MET可减轻脓毒症相关肺损伤,提高小鼠存活率如Fig 7A所示,MET可明显提高小鼠存活率,并减轻其肺水肿。HE染色根据Smith评分进行炎症结果判读[11],发现Sham组组织结构清晰,肺泡及肺间质未见渗出,无明显炎症细胞浸润;CLP组组织结构不清,肺泡及间质内大量渗出,伴较多炎症细胞浸润;MET干预后,肺泡及肺间质渗出及炎性细胞浸润程度较CLP组明显减轻。
2.8 MET可减轻体内脓毒症诱导的炎症反应,上调miR-129-5p的表达CLP小鼠中IL-6、TNF-α和IL-1β的水平上调,miR-129-5p呈低表达。而MET干预后,促炎细胞因子被明显抑制,miR-129-5p水平明显上调。
2.9 MET可上调CLP小鼠体内PI3K/AKT信号通路各蛋白的水平与体外结果相似,CLP组PI3K、AKT蛋白磷酸化水平降低,与CLP组相比,CLP+Met组p-PI3K、p-AKT蛋白的水平显著增加。
3 讨论
脓毒症具有高发病率、高死亡率及进展迅速等特点,其本质是由感染引起的免疫反应失衡,导致的多器官功能障碍。脓毒症相关ALI发生率高达40%,临床表现为呼吸窘迫及进行性、顽固性低氧血症,其病理特征为肺上皮及血管内皮细胞的受损及大量炎性细胞的浸润[12]。
MET可增强胰岛素敏感性,研究表明,在LPS诱导的脓毒症中,MET通过抑制心肌Toll样受体4(Toll-like recetor 4, TLR 4)活性,发挥心脏保护作用,并可缓解脓毒症所致的肺损伤,其机制可能是通过抑制炎症反应、氧化应激和细胞凋亡而实现[13]。我们的研究结果提示,MET可以在体内外模型中下调脓毒症中促炎因子的水平,起到器官功能保护作用。
miR-129-5p作为非编码RNA的一员,与多种正常或异常的病理生理过程密切相关。据报道,miR-129-5p在脓毒症小鼠中低表达,通过调控miR-129-5p水平,可抑制炎症反应,减轻肺损伤[14]。本课题前期研究发现,在脓毒症患者血清中,miR-129-5p水平显著下调,提示其可能参与调控脓毒症进程。在本研究中,我们发现LPS干预后细胞内miR-129-5p的表达水平降低,TNF-α、IL-6、IL-1β水平呈高表达伴随细胞活力降低及凋亡增加。通过MET干预后细胞miR-129-5p表达增加,炎症因子水平下调,细胞活力增强。但敲低miR-129-5p可逆转MET的积极作用。为了进一步验证,我们建立了脓毒症小鼠模型,发现CLP组小鼠肺组织充血水肿明显并大量炎性细胞浸润。且miR-129-5p的表达较对照组下调,伴随TNF-α、IL-6、IL-1β水平增高。MET干预则可减轻肺水肿及炎性细胞浸润,并下调促炎因子的表达。从而起到肺保护作用,提高小鼠存活率。PI3K/AKT信号通路在脓毒症中起关键作用[15],PIK3激活导致AKT磷酸化,促进细胞抵抗炎症和氧化应激诱导的损伤。通过Western blot检测发现,LPS诱导细胞中p-AKT、p-PI3K蛋白表达降低,而MET干预或过表达miR-129-5p可增加p-AKT、p-PI3K蛋白的表达水平。敲低miR-129-5p则呈现出相反的结果,且可逆转MET的作用。同样,在小鼠模型中,MET干预可上调AKT、PI3K蛋白磷酸化水平。上述结果表明,miR-129-5p在脓毒症的发生、发展过程中发挥重要作用,且MET可能通过上调miR-129-5p的表达,激活PI3K/AKT通路,调控脓毒症炎症反应,减少细胞凋亡,缓解肺损伤。

Fig 6 Effect of MET on expression of PI3K, p-PI3K, AKT and
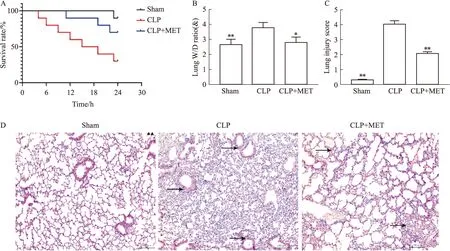
Fig 7 Effects of MET on survival rate and lung injury in sepsis

Fig 8 Effects of MET on expression of IL-1β, IL-6, TNF-α and miR-129-5p in serum of sepsis
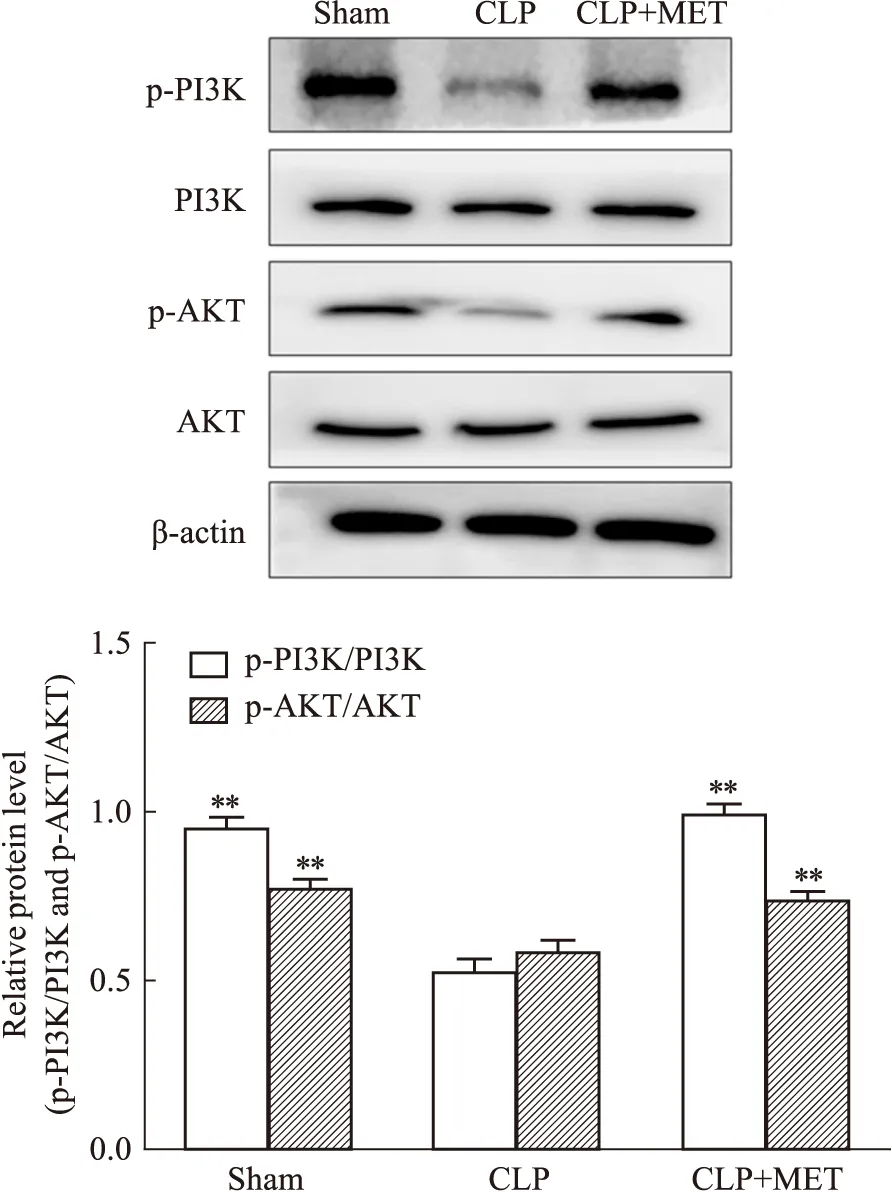
Fig 9 Effect of PI3K, p-PI3K, AKT and p-AKT in lung tissue of septic mice after MET
综上,MET可能通过激活miR-129-5p/PI3K/AKT轴来抑制炎症反应,减少细胞凋亡,减轻脓毒症相关肺损伤。

