神经胶质成熟因子-β诱导糖尿病大鼠视网膜Müller细胞炎症反应的机制研究
罗影 单伟 张俏
摘要:目的 研究神經胶质成熟因子-β(GMFB)对糖尿病大鼠视网膜Müller细胞活化的作用及相关机制。方法 SPF级雄性SD大鼠60只,采用腹腔注射链脲佐菌素(STZ,55 mg/kg)制备糖尿病模型后分为STZ组、STZ+AAV-GMFB组和STZ+AAV-GMFB+K252a组,每组15只。另取15只正常大鼠作为CON组。STZ+AAV-GMFB组和STZ+AAV-GMFB+K252a组大鼠于成模8周后玻璃体腔单次注射AAV-GMFB腺病毒载体5 μL。STZ+AAV-GMFB+K252a组在注射腺病毒基础上给予腹腔注射25 ?g/(kg·d)的K252a。12周后,免疫荧光检测GMFB在Müller细胞中的表达,免疫组织化学染色检测视网膜胶质纤维酸性蛋白(GFAP)的表达,酶联免疫吸附试验检测视网膜炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6的表达,Western blot检测GMFB、脑源性神经营养因子(BDNF)及磷酸化酪氨酸激酶受体B(p-TrkB)蛋白相对表达水平。HE染色检测视网膜病理改变。结果 GMFB在Müller细胞中大量表达。与CON组比较,STZ组GMFB、GFAP表达及TNF-α、IL-1β、IL-6水平增加,BDNF、p-TrkB蛋白表达减少,视网膜神经节细胞(RGC)排列紊乱,数量减少;与STZ组比较,STZ+AAV-GMFB组GMFB、GFAP表达及TNF-α、IL-1β、IL-6水平降低,BDNF、p-TrkB蛋白表达增加,RGC排列整齐,数量增加。TrkB抑制剂K252a能大部分逆转AAV-GMFB的保护作用。结论 糖尿病大鼠视网膜GMFB表达增加,诱导了Müller细胞活化,加重了炎症反应,该作用与抑制BDNF/TrkB信号通路有关。
关键词:糖尿病;糖尿病视网膜病变;炎症;神经胶质成熟因子-β;Müller细胞;BDNF/TrkB信号通路
中图分类号:R587.1,R774.1文献标志码:ADOI:10.11958/20221106
Study on the mechanism of glial maturation factor-β induced inflammatory response of retinal Müller cells in diabetes rats
LUO Ying SHAN Wei ZHANG Qiao
1 Department of Neurology, the First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China;
2 Department of Anatomy, Jinzhou Medical University
△Corresponding Author E-mail: 594926970@qq.com
Abstract: Objective To study the activation and its related mechanisms of glial maturation factor-β(GMFB) on retinal MüLler cells in diabetes rats. Methods Sixty SPF grade male SD rats were divided into the streptozotocin (STZ) group, the STZ+AAV-GMFB group and the STZ+AAV-GMFB+K252a (TrkB inhibitor) group with 15 rats in each group. Another 15 normal rats were taken as the CON group. Rats in the STZ+AAV-GMFB group and the STZ+AAV-GMFB+K252a group were injected with AAV-GMFB adenovirus vector 5 μL in vitreous cavity 8 weeks after modeling. The STZ+AAV-GMFB+K252a group received intraperitoneal injection of K252a (25 ?g·kg-1·d-1). After 12 weeks, the expression of GMFB in Müller cells was detected by immunofluorescence, the expression of glial fibrillary acidic protein (GFAP) in retina was detected by immunohistochemistry, and the retinal inflammatory factor tumor necrosis factor- α (TNF-α), interleukin (IL)-1β and IL-6 were detected by ELISA. The relative expression levels of GMFB, brain derived neurotrophic factor (BDNF) and its tyrosine kinase receptor B (p-TrkB) were detected by Western blot assay. HE staining was used to detect the pathological changes of retina. Results GMFB was expressed in Müller cells. Compared with the CON group, the expression levels of GMFB, GFAP and TNF-α, IL-1β, IL-6 levels increased, the number of retinal ganglion cells (RGC) and the expression levels of BDNF, p-TrkB decreased in the STZ group. Compared with the STZ group, the expression levels of GMFB, GFAP and TNF-α, IL-1β and IL-6 levels decreased, the expression of BDNF, p-TrkB and the number of RGC were increased in the STZ+AAV-GMFB group. However, K252a can largely reverse the protective effect of AAV-GMFB. Conclusion The expression of GMFB in the retina of rats with diabetes is increased, which can induce the activation of Müller cells and aggravate the inflammatory response. This effect is related to the inhibition of BDNF/TrkB signal pathway.
Key words: diabetes mellitus; diabetic retinopathy; inflammation; glial maturation factor-β; Müller cells; BDNF/TrkB signaling pathway
Müller细胞为视网膜神经胶质细胞,对维持视网膜功能尤为重要。高血糖会引起视网膜环境的紊乱,进而影响正常Müller细胞的功能,最终影响整个视网膜功能[1-2]。研究显示,高血糖状态下,Müller细胞活化会释放多种炎性因子,产生严重的神经炎症反应,导致神经元功能障碍,引起新生血管形成[3]。神经胶质成熟因子-β(glial maturation factor-β,GMFB)是一种生长分化因子,介导神经元和神经胶质的生长和成熟。研究显示,GMFB在多种神经炎症和神经变性疾病中表达上调并加重神经变性和神经炎症[4-5]。目前,有关GMFB在糖尿病诱导的Müller细胞活化中影响的研究较少。在高血糖状态下,脑源性神经营养因子(brain derived neurotrophic factor,BDNF)及酪氨酸激酶受体B(tyrosine kinase receptor B,TrkB)在視网膜中表达降低,表明糖尿病性视网膜神经退行性疾病可能与神经营养因子的缺乏有关[6]。Müller细胞可以释放神经营养因子,在维持视网膜稳定方面起重要作用。然而,在高血糖状态下,Müller细胞过度活化可导致神经营养因子释放减少,炎性因子释放增加[7]。本研究旨在探讨GMFB在糖尿病视网膜损伤下的功能定位及其对BDNF/TrkB通路的调控作用。
1 材料与方法
1.1 主要材料 SPF级雄性SD大鼠65只,体质量180~220 g,购自锦州医科大学,生产许可证号:SCXK(辽)2009-2021。链脲佐菌素(STZ)购自美国Sigma公司;TrkB抑制剂K252a(美国AbMole公司);兔抗大鼠GMFB、胶质纤维酸性蛋白(GFAP)、BDNF、p-TrkB一抗,小鼠抗大鼠谷氨酰胺合成酶(GS)一抗,β-actin一抗购自英国Abcam公司,荧光二抗及Western blot二抗购自英国Abcam公司;酶联免疫吸附试验(ELISA)及苏木精-伊红(HE)染色试剂盒购自上海MLBIO公司。
1.2 研究方法
1.2.1 动物分组及模型制备 50只大鼠适应性饲养1周,建模前禁食水12 h,采用腹腔注射STZ(55 mg/kg)制备糖尿病模型。72 h后空腹血糖≥16.7 mmol/L为模型制备成功,其中模型成功45只。采用随机数字表法分成STZ组、STZ+AAV-GMFB组和STZ+AAV-GMFB+K252a组,每组15只。另取15只正常大鼠作为CON组。STZ+AAV-GMFB组和STZ+AAV-GMFB+K252a组大鼠于成模8周后麻醉,解剖显微镜下用微量进样器于内眦角膜缘后1.0 mm处进针,玻璃体腔单次注射AAV2型GMFB敲低腺病毒载体(AAV-GMFB)5 μL(预实验已证实AAV病毒稀释液的安全性),注射后72 h内大鼠出现出血、感染等并发症时予以剔除;STZ+AAV-GMFB+K252a组在注射腺病毒基础上给予腹腔注射K252a,剂量25 ?g/(kg·d)[8];CON组和STZ组给予腹腔注射等剂量生理盐水。AAV-GMFB由上海吉玛生物有限公司设计完成,其靶序列为3′-ACACCGAAGACCTAACTGA-5′,滴度为1×1010 PFU/mL。各组均干预12周,期间均无大鼠死亡,实验遵循国家《实验动物管理条例》。
1.2.2 标本采集 模型制备12周后,用戊巴比妥钠(10 g/L)麻醉大鼠。每组5只大鼠采用4%多聚甲醛灌流1.5~2.0 h,取眼球置于-4 ℃固定液中48 h,常规进行石蜡包埋,5 μm切片,用于免疫荧光、免疫组织化学染色和HE染色。5只大鼠取新鲜视网膜组织进行酶联免疫吸附试验(ELISA)。5只大鼠进行Western blot检测。
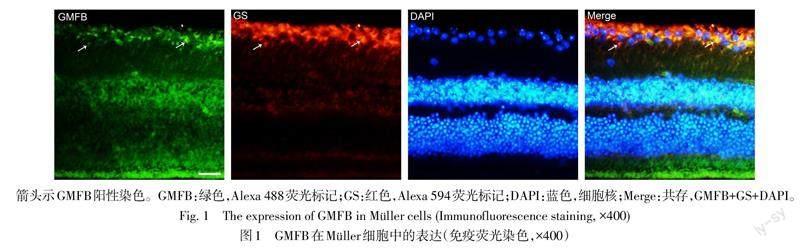
1.2.3 免疫荧光染色观察Müller细胞中GMFB的表达 切片常规脱蜡水化。磷酸盐缓冲液(PBS)洗涤3次,每次5 min,10%山羊血清+0.3% Triton-X 100室温孵育2 h;加入GMFB(1∶300)、GS(1∶500)一抗,4 ℃孵育过夜。PBS洗涤3次,每次10 min,滴加Alexa 488和Alexa 594标记的二抗(1∶500),室温避光湿盒孵育2 h。PBS洗涤3次,每次10 min,抗荧光淬灭封片剂封片,倒置荧光显微镜下拍照观察,实验重复3次。
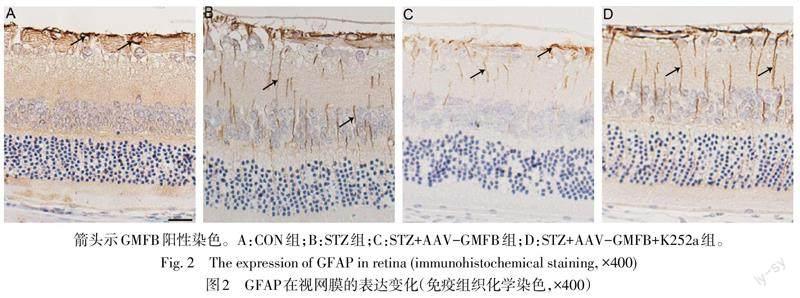
1.2.4 免疫组织化学染色观察视网膜GFAP表达分布 切片常规脱蜡水化,抗原修复后恢复至室温,3% H2O2避光反应10 min。PBS洗涤3次。滴加山羊血清工作液30 min。滴加一抗GFAP(1∶300)4 ℃孵育过夜。次日(>18 h)复温1 h,二抗(1∶500)孵育1 h,PBS洗涤,链霉素亲和素孵育1 h。DAB显色后苏木素复染,梯度乙醇和二甲苯溶液脱水透明,中性树胶封片。显微镜下观察,镜下出现棕黄色颗粒为GFAP表达阳性。
1.2.5 ELISA检测视网膜炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6相对表达水平 取新鲜视网膜,加入裂解液,收集各组上清液,于4 ℃、12 000 r/min离心20 min,按照ELISA说明书加液后37 ℃水浴60 min,弃去液体,每孔加入过氧化氢和3,3',5,5'-四甲基联苯胺混匀后反应15 min。加入终止液,以450 nm波长处测光密度(OD)值。
1.2.6 Western blot检测GMFB、BDNF、p-TrkB蛋白相对表达水平 收集上清液同1.2.5。BCA试剂盒测定蛋白浓度。电泳,转膜,1% BSA封闭2 h。加入GMFB(1∶5 000)、BDNF(1∶8 000)、p-TrkB(1∶5 000)、β-actin(1∶5 000)4 ℃孵育过夜。18 h后TBST洗膜,二抗(1∶5 000)室温孵育2 h,ECL显影。用Image J 1.8.0软件分析各蛋白相对表达水平。
1.2.7 HE染色观察视网膜病理变化 切片常规脱蜡水化后PBS洗3次;苏木素浸染2 min,自来水冲洗;伊红浸染1 min,自来水冲洗;脱水透明后封片,倒置显微镜拍照观察视网膜神经节细胞(RGC)在节细胞层的排列和数量变化。
1.3 统计学方法 采用SPSS 22.0统计软件进行数据分析。符合正态分布的计量资料以x±s表示,多组间计量资料比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 GMFB在Müller细胞中的表达 通过GMFB和Müller细胞标志物GS免疫荧光双标发现,GMFB在Müller细胞中大量表达,见图1。
2.2 各组GFAP表达分布情况比较 CON组GFAP仅表达于节细胞层,STZ组和STZ+AAV-GMFB+K252a组GFAP表达贯穿视网膜全层。STZ+AAV-GMFB组GFAP表达量介于CON组和STZ组之间,见图2。
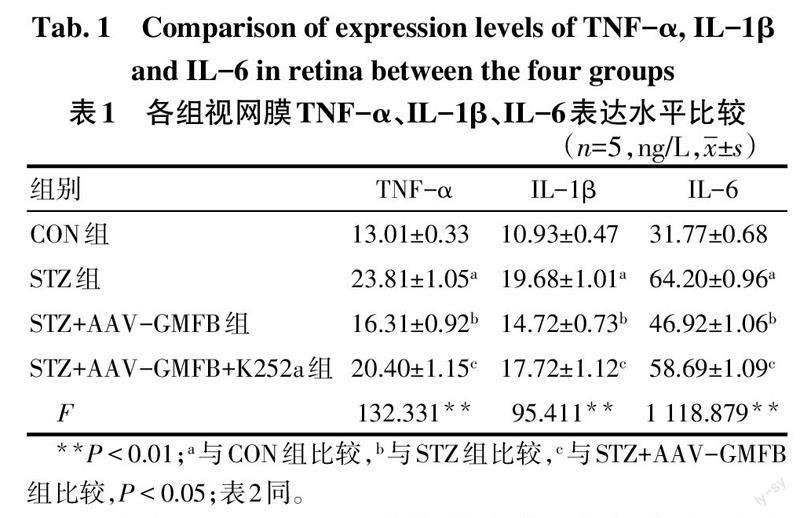
2.3 各组视网膜炎性因子表达水平比较 与CON组比较,STZ组TNF-α、IL-1β、IL-6表达水平增加(P<0.05)。与STZ组比较,STZ+AAV-GMFB组TNF-α、IL-1β、IL-6表达水平降低(P<0.05)。与STZ+AAV-GMFB组比较,STZ+AAV-GMFB+K252a组TNF-α、IL-1β、IL-6表达水平增加(P<0.05),见表1。
2.4 各组BDNF/TrkB通路蛋白相对表达水平比较 与CON组比较,STZ组GMFB相对表达水平增加,BDNF、p-TrkB相对表达水平降低(P<0.05)。与STZ组比较,STZ+AAV-GMFB组GMFB相对表达水平降低,BDNF、p-TrkB相对表达水平升高(P<0.05)。与STZ+AAV-GMFB组比较,STZ+AAV-GMFB+K252a组GMFB相对表达水平无明显变化(P>0.05),BDNF、p-TrkB蛋白相对表达水平降低(P<0.05),见表2、图3。
2.5 各组视网膜病理变化 与CON组比较,STZ组RGC排列紊乱,数量明显减少。與STZ组比较,STZ+AAV-GMFB组RGC排列整齐,数量增加。与STZ+AAV-GMFB组比较,STZ+AAV-GMFB+K252a组RGC排列紊乱,数量明显减少,见图4。
3 讨论
高血糖会引起严重的Müller细胞活化,导致神经营养因子释放减少,炎性因子释放增加[1-2,7]。GMFB主要在中枢神经系统中表达,包括星形胶质细胞、小脑中的神经胶质细胞以及视网膜中的Müller细胞等神经胶质类细胞[4]。研究发现,在出生后14 d的大鼠视网膜中可检测到GMFB mRNA和蛋白,且GMFB的表达主要局限于大鼠视网膜中的Müller细胞[9]。本研究采用GMFB和Müller细胞标志物GS免疫荧光染色后发现,GMFB与GS大量共存,且与CON组比较,STZ组大鼠视网膜GMFB表达明显增加,表明高血糖会诱导视网膜表达GMFB,提示GMFB的表达变化与糖尿病视网膜损伤密切相关。本研究进一步发现,STZ+AAV-GMFB组GMFB相对表达水平较STZ组降低,提示敲低GMFB表达可抑制高血糖引起的Müller细胞活化,减轻细胞损伤程度。
现已确定糖尿病动物模型Müller细胞会被激活,其明显标志之一是GFAP的表达增加[10]。本课题组前期研究发现,正常大鼠视网膜GFAP仅少量表达于节细胞层,而糖尿病大鼠GFAP呈现全细胞免疫阳性[11]。Müller细胞活化后会释放大量的炎性因子,且其是视网膜IL-1β产生的主要来源。在Müller细胞中,高血糖可强烈诱导IL-1β信号通路激活[1]。除IL-1β外,Müller细胞还产生TNF-α和IL-6等炎性因子[12-13]。这些炎性因子加重了糖尿病视网膜慢性炎症,且随病程延长,炎症进展也促进视网膜细胞损伤[3]。本研究结果也证实,STZ组视网膜GFAP、TNF-α、IL-1β、IL-6水平较CON组均增加,提示高血糖会引起Müller细胞处于极度活化状态,这对视网膜是有害的。而注射AAV-GMFB后,上述指标均降低,表明GMFB表达上调是介导的Müller细胞活化诱发的炎症反应的重要原因之一。
BDNF具有神经保护功能和神经营养作用,可以促进神经再生,维持正常的神经元功能[14]。研究发现,糖尿病时BDNF表达明显降低,视网膜功能受损[15]。本研究结果显示,与CON组比较,STZ组BDNF及其受体p-TrkB蛋白相对表达水平降低,提示糖尿病大鼠视网膜中Müller细胞功能下降,炎症反应加重。而与STZ组比较,STZ+AAV-GMFB组BDNF和p-TrkB相对表达水平升高,提示下调GMFB表达可促进BDNF及其受体TrkB的表达,保护视网膜。为了进一步验证BDNF/TrkB途径在GMFB调节视网膜损伤中的作用,本研究在给予AAV-GMFB的同时,给予TrkB受体抑制剂K252a,发现K252a大部分逆转了AAV-GMFB的保护作用,再次证实GMFB在糖尿病视网膜损伤中的作用是通过BDNF/TrkB途径实现的。
综上所述,糖尿病时视网膜GMFB表达明显上调,诱导了Müller细胞活化,进而加重了炎症反应,GMFB表达上调可对视网膜造成损害。AAV-GMFB可抑制Müller细胞活化,降低炎性因子TNF-α、IL-1β、IL-6的表达,保护RGC,该保护作用机制与激活BDNF/TrkB途径密切相关。然而,糖尿病机制复杂,GMFB调控此信号通路进而对糖尿病大鼠视网膜的作用机制仍需进一步验证。
参考文献
[1] ONTKO C D,CAPOZZI M E,KIM M J,et al. Cytochrome P450-epoxygenated fatty acids inhibit Müller glial inflammation[J]. Sci Rep,2021,11(1):9677. doi:10.1038/s41598-021-98425-7.
[2] 張悦,刘含若. Müller细胞在视网膜疾病发病机制中的作用[J]. 国际眼科纵览,2022,46(2):179-184. ZHANG Y,LIU H R. Role of Müller cells in pathogenesis of retinal diseases[J]. Int Rev Ophthal,2022,46(2):179-184. doi:10.3760/cma.j.issn.1673-5803.2022.02.015.
[3] COUGHLIN B A,FEENSTRA D J,MOHR S. Müller cells and diabetic retinopathy[J]. Vision Res,2017,139(10):93-100. doi:10.1016/j.visres.2017.03.013.
[4] FAN J,FONG T,CHEN X,et al. Glia maturation factor-β:A potential therapeutic target in neurodegeneration and neuroinflammation[J]. Neuropsychiatr Dis Treat,2018,14(2):495-504. doi:10.2147/NDT.S157099.
[5] LIU C,SUN W,ZHU T,et al. Glia maturation factor-β induces ferroptosis by impairing chaperone-mediated autophagic degradation of ACSL4 in early diabetic retinopathy[J]. Redox Biol,2022,52(6):102292. doi:10.1016/j.redox.2022.102292.
[6] AFARID M,NAMVAR E,SANIE-JAHROMI F. Diabetic retinopathy and BDNF:a review on its molecular basis and clinical applications[J]. J Ophthalmol,2020,18(5):1602739. doi:10.1155/2020/1602739.
[7] ZHU M,LI N,WANG Y,et al. Regulation of inflammation by VEGF/BDNF signaling in mouse retinal Müller glial cells exposed to high glucose[J]. Cell Tissue Res,2022,388(3):521-533. doi:10.1007/s00441-022-03622-z.
[8] JIANG N,WANG H,LI C,et al. The antidepressant-like effects of the water extract of Panax ginseng and Polygala tenuifolia are mediated via the BDNF-TrkB signaling pathway and neurogenesis in the hippocampus[J]. J Ethnopharmacol,2021,267(3):113625. doi:10.1016/j.jep.2020.113625.
[9] NISHIWAKI A,ASAI K,TADA T,et al. Expression of glia maturation factor during retinal development in the rat[J]. Brain Res Mol Brain Res,2001,95(1/2):103-109. doi:10.1016/s0169-328x(01)00252-2.
[10] GU L,XU H,ZHANG C,et al. Time-dependent changes in hypoxia- and gliosis-related factors in experimental diabetic retinopathy[J]. Eye (Lond),2019,33(4):600-609. doi:10.1038/s41433-018-0268-z.
[11] 张俏,罗影,刘学政. 番石榴叶总三萜改善糖尿病大鼠视网膜损伤的作用机制研究[J]. 天津医药,2020,48(12):1165-1168. ZHANG Q,LUO Y,LIU X Z. The effect of total triterpenoids in guava leaves on retinal injury in diabetic rats[J]. Tianjin Med J,2020,48(12):1165-1168. doi:10.11958/20201920.
[12] GIBLIN M J,SMITH T E,WINKLER G,et al. Nuclear factor of activated T-cells (NFAT) regulation of IL-1β-induced retinal vascular inflammation[J]. Biochim Biophys Acta Mol Basis Dis,2021,1867(12):166238. doi:10.1016/j.bbadis.2021.166238.
[13] ROBINSON R,YOUNGBLOOD H,IYER H,et al. Diabetes induced alterations in murine vitreous proteome are mitigated by IL-6 trans-signaling inhibition[J]. Invest Ophthalmol Vis Sci,2020,61(11):2. doi:10.1167/iovs.61.11.2.
[14] WANG C S,KAVALALI E T,MONTEGGIA L M. BDNF signaling in context: From synaptic regulation to psychiatric disorders[J]. Cell,2022,185(1):62-76. doi:10.1016/j.cell.2021.12.003.
[15] SUZUMURA A,KANEKO H,FUNAHASHI Y,et al. N-3 fatty acid and its metabolite 18-HEPE ameliorate retinal neuronal cell dysfunction by enhancing Müller BDNF in diabetic retinopathy[J]. Diabetes,2020,69(4):724-735. doi:10.2337/db19-0550.
(2022-07-14收稿 2022-09-29修回)
(本文编辑 陆荣展)

