黄连素调节PI3K/AKT/NF-κB信号通路对慢性湿疹大鼠皮肤损伤的影响
秦宗碧 徐爱琴 蔡翔 邱百怡 王首帆 李伶华 朱立宏
摘要:目的 探討黄连素对慢性湿疹大鼠皮肤损伤及磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)/核因子-κB(NF-κB)信号通路的影响。方法 60只SD大鼠分为对照组,慢性湿疹组,黄连素低、中、高剂量组和泼尼松组,每组10只。除对照组外,其余组大鼠背部涂抹2,4-二硝基氯苯(DNCB)构建慢性湿疹模型。进行湿疹面积及严重度指数(EASI)评分;酶联免疫吸附试验(ELISA)检测血清组胺、胃泌素释放肽(GRP)、免疫球蛋白E(IgE)、白细胞介素(IL)-4、IL-6、肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)水平;苏木素-伊红(HE)染色观察皮损组织病理学改变;Western blot法检测皮损组织PI3K/AKT/NF-κB信号通路相关蛋白表达。结果 与对照组比较,慢性湿疹组大鼠皮损组织受损严重,血清组胺、GRP、IgE、IL-4、IL-6、TNF-α水平以及皮损组织IL-4、IL-6、TNF-α蛋白表达和p-PI3K/PI3K、p-AKT/AKT、p-NF-κB p65/NF-κB p65、p-NF-κB抑制蛋白α(IκBα)/IκBα比值升高,血清和皮损组织IFN-γ降低(P<0.05)。与慢性湿疹组比较,黄连素各剂量组和泼尼松组大鼠皮损组织病理损伤有所改善,EASI评分下降,血清组胺、GRP、IL-4、IL-6、TNF-α水平以及皮损组织IL-6、TNF-α蛋白表达和p-PI3K/PI3K、p-AKT/AKT、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα比值降低,血清和皮损组织IFN-γ升高(P<0.05),同时黄连素中、高组和泼尼松组大鼠血清IgE和皮损组织IL-4降低(P<0.05),且黄连素高剂量组效果更好;黄连素高剂量组和泼尼松组上述指标比较差异无统计学意义(P>0.05)。结论 黄连素尤其是高剂量黄连素可抑制PI3K/AKT/NF-κB信号通路激活,减轻免疫失衡和炎症反应,改善慢性湿疹大鼠皮肤损伤。
关键词:小檗碱;皮肤疾病,湿疹性;免疫,细胞;炎症;疾病模型,动物;PI3K/AKT/NF-κB信号通路
中图分类号:R758.23文献标志码:ADOI:10.11958/20221627
Effects of berberine on skin damage in rats with chronic eczema by regulating
PI3K/AKT/NF-κB signaling pathway
QIN Zongbi, XU Aiqin, CAI Xiang, QIU Baiyi, WANG Shoufan, LI Linghua, ZHU Lihong
Department of Dermatology, Wuhan Hospital of Traditional Chinese Medicine, Wuhan 430014, China
Abstract: Objective To investigate the effect of berberine on skin damage and phosphatidylinositol-3-kinase (PI3K)/protein kinase B (AKT)/nuclear factor-κB (NF-κB) signaling pathway in rats with chronic eczema. Methods Sixty SD rats were divided into the control group, the chronic eczema group, the berberine (low, medium and high dose) groups and the prednisone group (n=10 for each group). Except for the control group, the other groups of rats were treated with 2,4-dinitrochlorobenzene (DNCB) on back to establish chronic eczema model. Eczema area and severity index (EASI) scores were measured in groups. Serum levels of histamine, gastrin-releasing peptide (GRP), immunoglobulin E (IgE), interleukin (IL)-4, IL-6, tumor necrosis factor α (TNF-α) and γ interferon (IFN-γ) were detected by enzyme-linked immunosorbent assay (ELISA). Histopathological changes of skin lesions were observed by hematoxylin-eosin (HE) staining. Expression levels of PI3K/AKT/NF-κB signaling pathway-related proteins in skin lesions were detected by Western blot assay. Results Compared with the control group, skin lesions were seriously damaged in the chronic eczema group. Serum levels of histamine, GRP, IgE, IL-4, IL-6 and TNF-α, and protein expression levels of IL-4, IL-6 and TNF-α and p-PI3K/PI3K, p-AKT/AKT, p-NF-κB p65/NF-κB p65 and p-NF-κB inhibitor protein α (IκBα)/IκBα ratio in skin lesions were increased, serum and skin lesion IFN-γ decreased (P<0.05). Compared with the chronic eczema group, the pathological damage of skin lesions of rats was improved in the berberine groups and the prednisone group. EASI score, serum levels of histamine, GRP, IgE, IL-4, IL-6 and TNF-α levels, and protein expression levels of IL-4, IL-6 and TNF-α and p-PI3K/PI3K, p-AKT/AKT, p-NF-κB p65/NF-κB p65, p-IκBα/ IκBα ratio in skin lesions decreased, serum and skin lesion tissue IFN-γ increased (P<0.05). Serum IgE and IL-4 in skin lesions of rats decreased in the berberine groups (medium and high dose groups) and the prednisone group (P<0.05). The effect was better in the high dose berberine group. There were no significant differences in the above indexes between the high dose berberine group and the prednisone group (P>0.05). Conclusion Berberine, especially high dose berberine, can inhibit the activation of PI3K/AKT/NF-κB signaling pathway, reduce immune imbalance and inflammatory response, and improve skin damage in rats with chronic eczema.
Key words: berberine; skin diseases, eczematous; immunity, cellular; inflammation; disease models, animal; PI3K/AKT/NF-κB signal path
慢性湿疹是皮肤科常见的一种过敏性、炎症性疾病,由内外多种因素引起,以红斑、瘙痒、水肿、苔藓化等为特征,病程较长,易反复发作,治愈困难,严重影响患者工作与生活[1]。目前,慢性湿疹的临床治疗方式主要包括以糖皮质激素等为主的局部治疗和以免疫抑制剂、抗组胺药等为主的系统治疗,但治疗效果尚不理想,且存在一定的不良反应[2]。研究表明,中医药治疗慢性湿疹具有疗效显著、不良反应小、患者接受度高等优势[3-4]。黄连素(亦称小檗碱)是从黄连中分离的一种季铵生物碱,具有抗菌、抗炎等生物活性[5]。研究证实,黄连素可通过抑制嗜酸性粒细胞趋化因子活化和白细胞介素(IL)-4、IL-5等Th2型细胞因子的表达以及相关的炎性细胞募集来改善特应性皮炎小鼠皮肤症状和瘙痒[6];外用小檗碱乳膏可显著改善耳廓复合痤疮模型大鼠的皮损[7]。此外,以黄连为君药,配伍当归、姜黄等药材制成的加味黄连膏可通过抑制炎症反应有效治疗湿疹[8]。黄连素对湿疹、带状疱疹等多种皮肤疾病均具有治疗作用[9]。然而,黄连素在慢性湿疹中的作用机制尚不明确。磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)/核因子-κB(nuclear factor-κB,NF-κB)信号通路在炎症性疾病中发挥重要调控作用,例如:抑制PI3K/AKT/NF-κB通路可减轻胶原诱导型类风湿关节炎大鼠炎症反应[10];上调PI3K/AKT/NF-κB信号通路表达可导致人肾小管上皮细胞炎症损伤加重,而抑制PI3K/AKT/NF-κB信号通路则可有效减轻人肾小管上皮细胞炎症损伤[11]。基于以上研究结果,笔者推测黄连素可能通过调节PI3K/AKT/NF-κB信号通路减轻炎症反应,改善慢性湿疹皮肤损伤。因此,本研究通过构建慢性湿疹模型大鼠,探究黄连素对慢性湿疹大鼠皮肤损伤的影响以及PI3K/AKT/NF-κB信号通路在此过程中的作用,以期为黄连素治疗慢性湿疹的临床推广应用提供实验依据。
1 材料与方法
1.1 主要材料
SPF级雄性SD大鼠60只,6周龄,平均体质量(200±15)g,购自中国科学院上海药物研究所,生产许可证号:SCXK(沪)2020-0005。在SPF级实验动物中心统一饲养标准下喂养,符合3R原则。2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB;美国sigma公司);醋酸泼尼松片(浙江仙琚制药股份有限公司,国药准字H33021207);黄连素片(盐酸小檗碱片;杭州赛诺菲民生健康药业有限公司,国药准字H33021708);大鼠组胺、胃泌素释放肽(gastrin-releasing peptide,GRP)、免疫球蛋白E(IgE)、IL-4、IL-6、肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)酶联免疫吸附试验(ELISA)试剂盒(上海富雨生物科技有限公司);兔抗IL-4、IL-6、TNF-α、p-PI3K、PI3K、p-AKT、AKT、GAPDH多/单克隆抗体和HRP标记山羊抗兔/鼠IgG(英国Abcam公司);兔抗IFN-γ多克隆抗体(上海恒斐生物科技有限公司);鼠抗p-NF-κB p65 (Ser536)、NF-κB p65单克隆抗体(武汉伊莱瑞特生物科技股份有限公司);苏木素-伊红(HE)染色试剂盒以及兔抗NF-κB抑制蛋白α(NF-κB inhibitor protein α,IκBα)、p-IκBα多克隆抗体(北京百奥莱博科技有限公司)。
1.2 慢性湿疹模型构建与分组
造模前1 d,所有大鼠背部脱毛(面积为3 cm×3 cm),并随机抽取10只大鼠作为对照组。脱毛次日在脱毛区域涂抹5% DNCB(50 μL)进行第1次致敏,1周后在脱毛区域进行二次脱毛,二次脱毛次日在脱毛区域涂抹1% DNCB(100 μL)进行第2次致敏,持续致敏3周,每周1% DNCB(100 μL)致敏1次。待最后一次致敏完成后3 d,观察大鼠的行为状态,若大鼠出现皮肤干燥粗糙、角化、片状红斑、结痂、棘层肥厚、轻度海绵水肿等症状以及回头舔舐频繁、烦躁不安,提示慢性湿疹模型构建成功[12-13]。对照组在同一时间进行脱毛处理,但不涂抹DNCB。
将造模成功的50只大鼠按照随机数字表法随机分为慢性湿疹组,黄连素低、中、高剂量组和泼尼松组,每组10只。黄连素低、中、高剂量组大鼠灌胃黄连素片分别为0.04、0.08、0.12 g/kg,药物用量参考人和大鼠间等效剂量系数折算法进行计算,人和大鼠体质量分别按70 kg和200 g;泼尼松组大鼠灌胃醋酸泼尼松片25 mg/kg[14];慢性湿疹组和对照组灌胃等体积生理盐水,每天1次,连续给药2周。
1.3 湿疹面积及严重度指数(EASI)评分
分别在给药0周、1周、2周参照EASI评分标准[15]评估各组大鼠皮肤临床症状,包括红斑、鳞屑、苔藓样变、水肿/浸润/丘疹4项,每项以0-3分进行计分:无症状为0分;轻度为1分;中度为2分;重度为3分,各项得分相加为总分。每只大鼠EASI评分由2位实验人员独立进行,取平均值。
1.4 ELISA检测大鼠血清中组胺、GRP、IgE、IL-4、IL-6、TNF-α、IFN-γ水平
给药结束后,腹腔注射戊巴比妥钠麻醉各组大鼠,腹主动脉取血5 mL,3 000 r/min离心15 min,分离上层血清,置于-20 ℃冰箱保存。按照ELISA試剂盒说明书,梯度稀释标准品和血清,使用酶标仪检测各孔450 nm波长处光密度(OD)值。先根据标准品浓度和OD值绘制标准曲线,再根据血清浓度和OD值计算血清中组胺、GRP、IgE、IL-4、IL-6、TNF-α、IFN-γ水平。
1.5 HE染色观察大鼠皮损组织病理学改变
取血完成后颈椎脱臼处死各组大鼠,剪取背部皮损处组织(对照组剪取脱毛区域皮肤组织),将一部分皮损组织置于10%中性甲醛中固定,制备常规石蜡组织切片(厚度4 ?m),将切片脱蜡、水合后依次添加苏木素、伊红染色液进行染色,封片后在光镜下观察皮损组织病理学改变。剩余皮损组织置于-80 ℃超低温冰箱保存。
1.6 Western blot法检测大鼠皮损组织中PI3K/AKT/NF-κB信号通路相关蛋白表达
取出-80 ℃超低温冰箱保存的皮损组织,裂解液充分裂解,获取总蛋白,采用二喹啉甲酸法对蛋白浓度进行定量,随后将蛋白煮沸变性,每泳道上样20 ?g蛋白(20 ?L)进行凝胶电泳(5%浓缩胶、12%分离胶),接着通过电转移将蛋白转至聚偏二氟乙烯膜,使用5%牛血清白蛋白封闭膜2 h,添加一抗稀释液(IL-4、IL-6、TNF-α、PI3K、p-AKT、p-NF-B p65,1∶1 000;IFN-γ、p-PI3K、AKT、IκBα、p-IκBα,1∶500;NF-κB p65,1∶2 000;GAPDH,1∶10 000)4 ℃孵育过夜,洗涤后添加对应种属的二抗工作液(HRP标记山羊抗兔/鼠IgG,1∶5 000),再次洗涤后添加化学发光(emission chemoluminescence,ECL)试剂显色、曝光。GAPDH为内参蛋白,使用Image J软件分析蛋白条带灰度值。
1.7 统计学方法
采用Graphpad Prism 8.0软件进行数据分析。符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结果
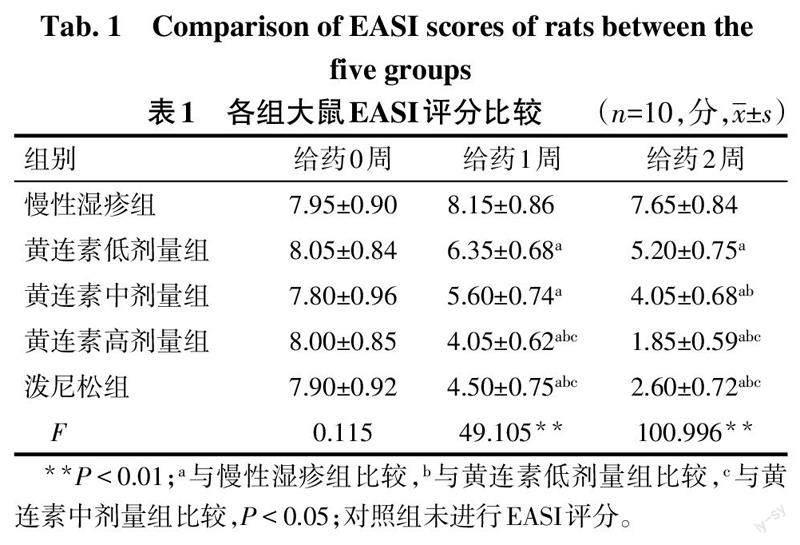
2.1 各组大鼠EASI评分比较
各组大鼠给药0周时的EASI评分比较差异无统计学意义(P>0.05)。给药1周、2周,与慢性湿疹组比较,黄连素低、中、高剂量组和泼尼松组大鼠EASI评分降低(P<0.05),且黄连素高剂量组效果更好;黄连素高剂量组和泼尼松组大鼠EASI评分比较差异无统计学意义(P>0.05)。见表1。
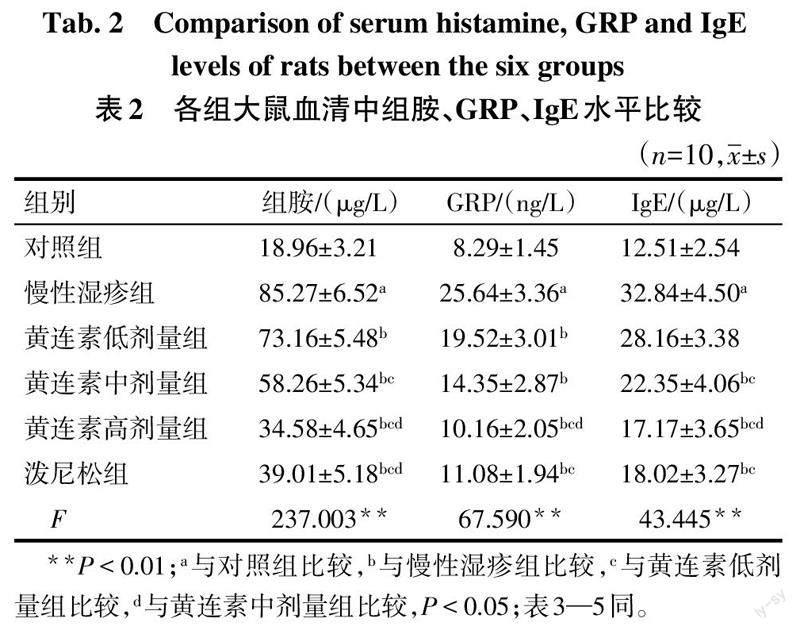
2.2 各组大鼠血清中组胺、GRP、IgE水平比较
与对照组比较,慢性湿疹组大鼠血清中组胺、GRP、IgE水平升高(P<0.05);与慢性湿疹组比较,黄连素低剂量组大鼠血清中組胺、GRP水平降低,黄连素中、高剂量组和泼尼松组大鼠血清中组胺、GRP、IgE水平降低(P<0.05),且黄连素高剂量组效果更好;黄连素高剂量组和泼尼松组大鼠血清中组胺、GRP、IgE水平比较差异无统计学意义(P>0.05)。见表2。
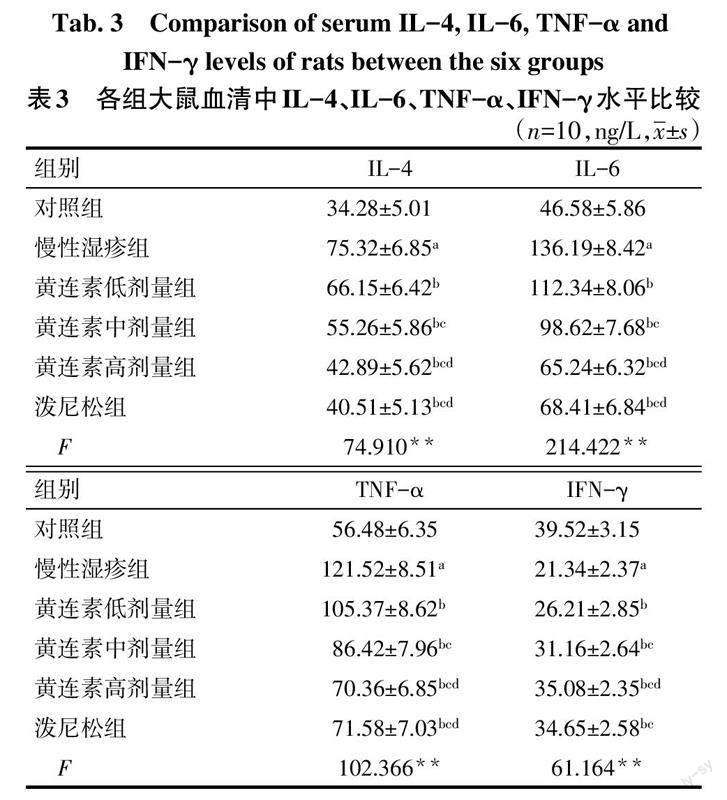
2.3 大鼠血清中IL-4、IL-6、TNF-α、IFN-γ水平比较
与对照组比较,慢性湿疹组大鼠血清中IL-4、IL-6、TNF-α水平升高,IFN-γ水平降低(P<0.05);与慢性湿疹组比较,黄连素低、中、高剂量组和泼尼松组大鼠血清中IL-4、IL-6、TNF-α水平降低,IFN-γ水平升高(P<0.05),且黄连素高剂量组效果更好;黄连素高剂量组和泼尼松组大鼠血清中IL-4、IL-6、TNF-α、IFN-γ水平比较差异无统计学意义(P>0.05)。见表3。
2.4 各组大鼠皮损组织病理学改变
对照组皮肤组织无明显异常;慢性湿疹组表皮层和棘皮层增厚,存在角化过度和大量炎性细胞浸润;黄连素低、中、高剂量组和泼尼松组大鼠上述病理损伤均有所改善,表皮层和棘皮层轻度增厚,角化过度减轻,少量炎性细胞浸润,且黄连素高剂量组和泼尼松组改善更为明显,见图1。
2.5 各组大鼠皮损组织中IL-4、IL-6、TNF-α、IFN-γ蛋白表达水平比较
与对照组比较,慢性湿疹组大鼠皮损组织中IL-4、IL-6、TNF-α蛋白表达水平升高,IFN-γ蛋白表达水平降低(P<0.05);与慢性湿疹组比较,黄连素低剂量组大鼠皮损组织中IL-6、TNF-α蛋白表达水平降低,IFN-γ蛋白表达水平升高(P<0.05),黄连素中、高剂量组和泼尼松组大鼠皮损组织中IL-4、IL-6、TNF-α蛋白表达水平降低,IFN-γ蛋白表达水平升高(P<0.05),且黄连素高剂量组效果更好;黄连素高剂量组和泼尼松组大鼠皮损组织中IL-4、IL-6、TNF-α、IFN-γ蛋白表达水平比较差异无统计学意义(P>0.05)。见图2、表4。
2.6 各组大鼠皮损组织中PI3K/AKT/NF-κB信号通路相关蛋白表达水平比较
与对照组比较,慢性湿疹组大鼠皮损组织中p-PI3K/PI3K、p-AKT/AKT、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα比值均升高(P<0.05);与慢性湿疹组比较,黄连素低、中、高剂量组和泼尼松组大鼠皮损组织中p-PI3K/PI3K、p-AKT/AKT、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα比值均降低(P<0.05),且黄连素高剂量组效果更好;黄连素高剂量组和泼尼松组大鼠皮损组织中p-PI3K/PI3K、p-AKT/AKT、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα比值比较差异无统计学意义(P>0.05)。见图3、表5。
3 讨论
慢性湿疹病因复杂,发病机制尚不明确。研究认为,免疫功能异常以及炎症反应均参与了慢性湿疹的发病过程[16]。因此,一些调节免疫失衡和抗炎的中药或其单体可能对于改善慢性湿疹皮肤损伤具有一定疗效。黄连素为一种天然存在的异喹啉类生物碱,对肠道疾病、呼吸系统疾病等多种疾病具有治疗作用,并通过NF-κB、ERK1/2和p38 MAPK通路等多种途径发挥抗炎和免疫调节特性[17-18]。本研究通过涂抹DNCB成功制备了慢性湿疹大鼠模型,并以泼尼松为阳性药物[14],结果显示经不同剂量黄连素和泼尼松治疗1周、2周后慢性湿疹大鼠EASI评分均明显降低,治疗结束后皮损组织病理损伤均有所改善,且黄连素高剂量组效果更好,提示黄连素尤其是高剂量黄连素能够改善慢性湿疹大鼠皮肤损伤,与泼尼松作用效果相似。
组胺作为一种有机含氮化合物,存在于皮肤、肠等多种组织中,当组织受损或发生炎症和过敏反应时可大量释放并入血,且抗组胺药物可治疗湿疹[19]。GRP是一种在中枢神经系统广泛存在的神经肽,其水平异常升高与皮肤瘙痒有关,且已被证明其参与慢性湿疹的发病[20]。此外,血清IgE水平升高也是慢性湿疹的一个常见表现[21]。本研究结果显示,黄连素低剂量组能够降低慢性湿疹大鼠血清中组胺、GRP水平,黄连素中、高剂量组和泼尼松组均可降低血清中组胺、GRP和IgE水平,且黄连素高剂量组和泼尼松组对血清中组胺、GRP和IgE的作用效果相近,进一步证实了黄连素对慢性湿疹的治疗作用。
IL-6、TNF-α是由炎性细胞释放的多效促炎细胞因子,在湿疹模型小鼠血清中呈高水平表达[8]。IL-4、IL-10等Th2型细胞因子和IL-2、IFN-γ等Th1型细胞因子失衡所引起的细胞因子分泌紊乱亦在湿疹的免疫炎症反应中起重要调控作用。朱雨晴等[12]研究发现,柏蛇湿疹膏可降低血清中IL-4、IL-10水平并提升IFN-γ水平,有效改善慢性、急性湿疹模型大鼠皮损。本研究发现,与对照组比较,慢性湿疹模型大鼠血清中IL-4、IL-6、TNF-α水平以及皮损组织中IL-4、IL-6、TNF-α蛋白表达水平均升高,而血清中IFN-γ水平和皮损组织中IFN-γ蛋白表达水平降低,提示慢性湿疹模型大鼠体内存在免疫失衡和炎症反应,这与皮损组织中可见大量炎性细胞浸润相一致。此外,本研究中,黄连素中、高剂量组和泼尼松组血清和皮损组织中IL-4、IL-6、TNF-α水平降低,而IFN-γ水平升高;且除皮损组织中IL-4外,黄连素低剂量组上述指标差异也有统计学意义;而黄连素高剂量组和泼尼松组大鼠血清和皮损组织中IL-4、IL-6、TNF-α、IFN-γ水平差异无统计学意义,表明黄连素能够减轻慢性湿疹中免疫失衡和炎症反应,与既往文献[17-18]报道结果相似。然而,陶文婷等[22]研究发现,小檗碱通过抑制Th1反应,恢复IFN-γ/IL-4平衡发挥对迟发型超敏反应的抑制作用,这与本研究结果相矛盾,推测可能是由于所构建疾病模型的发病机制不同导致。
PI3K/AKT/NF-κB信号通路是与炎症反应密切相关的信号转导途径,PI3K、AKT发生磷酸化激活后促使转录因子NF-κB发生磷酸化,同时诱导IκBα磷酸化,导致NF-κB通路激活,从而促进TNF-α、IL-6等促炎细胞因子的分泌,诱发炎症[23-24]。本研究中,慢性湿疹组较对照组大鼠皮损组织中p-PI3K/PI3K、p-AKT/AKT、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα比值均升高,而慢性湿疹大鼠经不同剂量黄连素和泼尼松治疗后PI3K、AKT、NF-κB p65、IκBα蛋白磷酸化水平均降低,且黄连素高剂量组效果更好,黄连素高剂量组和泼尼松组以上指标差异无统计学意义,表明黄连素减轻慢性湿疹大鼠中免疫失衡和炎症反应可能与抑制皮损组织中PI3K/AKT/NF-κB信号通路激活有关。Wang等[25]研究表明,黄连素通过调节PI3K/AKT/NF-κB信号通路抑制炎症反应和心肌细胞凋亡,可能是治疗缺血再灌注损伤的潜在药物。Wu等[26]研究也证实,黄连素改善糖尿病大鼠胰岛素抵抗和炎症的作用机制与调节NF-κB p65、PI3K p85和AKT Ser473等途徑有关。
综上所述,黄连素尤其是高剂量黄连素能够抑制PI3K/AKT/NF-κB信号通路激活,减轻免疫失衡和炎症反应,改善慢性湿疹大鼠皮肤损伤,这为临床慢性湿疹的治疗提供了一定科学依据,但仍有待进一步通过其他干预通路等进行验证。
参考文献
[1] BARRETT A,HAHN-PEDERSEN J,KRAGH N,et al. Patient-reported outcome measures in atopic dermatitis and chronic hand eczema in adults[J]. Patient,2019,12(5):445-459. doi:10.1007/s40271-019-00373-y.
[2] DUBIN C,DEL DUCA E,GUTTMAN-YASSKY E. Drugs for the treatment of chronic hand eczema: successes and key challenges[J]. Ther Clin Risk Manag,2020,16:1319-1332. doi:10.2147/TCRM.S292504.
[3] 陈兴,黄丽霞,李忻红,等. 中药外治湿疹用药规律的数据挖掘研究[J]. 辽宁中医杂志,2021,9(1):86-90. CHEN X,HUANG L X,LI Q H,et al. Data mining research on medication laws of external treatment of eczema with traditional Chinese medicine[J]. Liaoning J Tradit Chin Med,2021,9(1):86-90. doi:10.13192/j.issn.1000-1719.2021.09.023.
[4] 赖亭吉. 消银颗粒联合卤米松乳膏治疗慢性湿疹疗效观察[J]. 东南大学学报:医学版,2020,39(2):190-192. LAI T J. Curative effect of Xiaoyin granules combined with halometasone cream on chronic eczema[J]. J Southeast Univ(Med Sci Edi),2020,39(2):190-192. doi:CNKI:SUN:NJTD.0.2020-02-011.
[5] WANG J,WANG L,LOU G H,et al. Coptidis Rhizoma:a comprehensive review of its traditional uses,botany,phytochemistry,pharmacology and toxicology[J]. Pharm Biol,2019,57(1):193-225. doi:10.1080/13880209.2019.1577466.
[6] ANDOH T,YOSHIHISA Y,REHMAN M U,et al. Berberine induces anti-atopic dermatitis effects through the downregulation of cutaneous EIF3F and MALT1 in NC/Nga mice with atopy-like dermatitis[J]. Biochem Pharmacol,2021,185:114439. doi:10.1016/j.bcp.2021.114439.
[7] 郭斐斐,杜雪洋,李丹,等. 小檗碱乳膏对大鼠耳廓复合痤疮模型皮损及IGF-1,DHEA的影响[J]. 中国皮肤性病学杂志,2021,35(10):1103-1110. GUO F F,DU X Y,LI D,et al. Effects of berberine cream on skin lesions,IGF-1 and DHEA in rats with auricle acne[J]. Chin J Dermatovenereol,2021,35(10):1103-1110. doi:10.13735/j.cjdv.1001-7089.202012139.
[8] 张荣榕,李宁,邵帅,等. 基于P38MAPK信号通路探讨加味黄连膏对小鼠湿疹模型的影响[J]. 中国医院药学杂志,2020,40(16):1728-1732. ZHANG R R,LI N,SHAO S,et al. Effect of modified huanglian ointment on mouse eczema model based on p38MAPK signal pathway[J]. Chin J Hosp Pharm,2020,40(16):1728-1732. doi:10.13286/j.1001-5213.2020.16.08.
[9] 邹效. 黄连素在皮肤疾病中的应用[J]. 科学养生,2021,2(3):294. ZOU X. Application of berberine in skin diseases[J]. Regimen,2021,2(3):294.
[10] 胡志平,何绍前,王传明,等. 甘草酸抑制PI3K/AKT/NF-κB减轻胶原诱导型类风湿关节炎大鼠炎症反应[J]. 中国老年学杂志,2020,40(13):2852-2856. HU Z P,HE S Q,WANG C M,et al. Glycyrrhizic acid inhibits PI3K/AKT/NF-κB alleviates the inflammatory response in rats with collagen induced rheumatoid arthritis[J]. Chin J Gerontol,2020,40(13):2852-2856. doi:10.3969/j.issn.1005-9202.2020.13.054.
[11] 謝婷妃,袁树珍,隋晓露,等. 尿酸诱导人肾小管上皮细胞炎症损伤中PI3K/AKT/NF-κB信号通路的调控机制[J]. 中华肾脏病杂志,2021,37(1):36-42. XIE T F,YUAN S Z,SUI X L,et al. Uric acid induces inflammatory injury in HK-2 cells via PI3K/AKT/NF-κB signaling pathway[J]. Chin J Nephrol,2021,37(1):36-42. doi:10.3760/cma.j.cn441217-20200618-00006.
[12] 朱雨晴,俞彩霞,朱杰,等. 柏蛇湿疹膏对急性,慢性湿疹大鼠皮肤及炎症因子的影响[J]. 中国地方病防治杂志,2021,36(1):16-18. ZHU Y Q,YU C X,ZHU J,et al. Effect of cypress eczema cream on skin and inflammatory factors in rats with acute and chronic eczema[J]. Chin J Ctrl Endem Dis,2021,36(1):16-18.
[13] 郑琳琳,王星星,朱新景,等. 止痛消炎膏对慢性湿疹模型小鼠皮损及TEWL、SCH、湿度的影响[J]. 辽宁中医杂志,2022,49(5):192-195. ZHENG L L,WANG X X,ZHU X J,et al. Effect of Zhitong Xiaoyan Ointment on skin lesions,TEWL,SCH and humidity of chronic atopic dermatitis model mice[J]. Liaoning J Tradit Chin Med,2022,49(5):192-195.
[14] 汪园园,金明华,黄颖娟,等. 苓桂术甘汤联合热量限摄对湿疹模型大鼠皮损的影响及其机制分析[J]. 中国中西医结合杂志,2020,40(4):465-469. WANG Y Y,JIN M H,HAUNG Y J,et al. Effect of Calorie-restriction Therapy combined Linggui Zhugan Decoction on eczema model rats[J]. Chin J Integ Trad Western Med,2020,40(4):465-469. doi:10.7661/j.cjim.20190928.286.
[15] 赵辨. 湿疹面积及严重度指数评分法[J]. 中华皮肤科杂志,2004,37(1):3-4. ZHAO B. Eczema area and severity index scoring method[J]. Chin J Dermatol,2004,37(1):3-4. doi:10.3760/j.issn:0412-4030.2004.01.002.
[16] 刘影,董燕,孙道红,等. 参苓白术散联合多磺酸黏多糖封包对老年慢性湿疹血虚风燥证患者炎症因子和外周血T淋巴细胞亚群的影响[J]. 中华中医药学刊,2020,38(5):166-169. LIU Y,DONG Y,SUN D H,et al. Effect of Shenling Baizhu Powder combined with Polysulfonic Acid Mucopolysaccharide Encapsulation on inflammatory cytokines and peripheral blood T lymphocyte subsets in elderly patients with chronic eczema and blood deficiency[J]. Chin Arch Trad Chin Med,2020,38(5):166-169. doi:10.13193/j.issn.1673-7717.2020.05.039.
[17] JIANG Y,ZHAO L,CHEN Q,et al. Exploring the mechanism of berberine intervention in ulcerative colitis from the perspective of inflammation and immunity based on systemic pharmacology[J]. Evid Based Complement Alternat Med,2021,2021:9970240. doi:10.1155/2021/9970240.
[18] TEW X N,XIN LAU N J,CHELLAPPAN D K,et al. Immunological axis of berberine in managing inflammation underlying chronic respiratory inflammatory diseases[J]. Chem Biol Interact,2020,317:108947. doi:10.1016/j.cbi.2020.108947.
[19] WOLLENBERG A,BARBAROT S,BIEBER T,et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children:part Ⅱ[J]. J Eur Acad Dermatol Venereol,2018,32(6):850-878. doi:10.1111/jdv.14891.
[20] ZHOU X L,CHEN L L,WANG J F. Study on the antipruritic mechanism of Zanthoxylum bungeanum and Zanthoxylum schinifolium volatile oil on chronic eczema based on H1R and PAR-2 mediated GRPR pathway[J]. Allergol Immunopathol (Madr),2022,50(4):83-96. doi:10.15586/aei.v50i4.486.
[21] 唐學武,王文革,张俊红,等. 脐血TSLP、IgE水平对早期婴儿湿疹的预测价值[J]. 中国皮肤性病学杂志,2020,34(8):879-883. TANG X W,WANG W G,ZHANG J H,et al. Predictive value of cord blood TSLP,IgE level for early infantile eczema[J]. Chin J Dermatovenereol,2020,34(8):879-883. doi:10.13735/j.cjdv.1001-7089.201911057.
[22] 陶文婷,陈姣姣,高清华,等. 小檗碱通过抑制Th1恢复IFN-γ/IL-4平衡减轻迟发型超敏反应[J]. 中国中医基础医学杂志,2021,27(3):423-426. TAO W T,CHEN J J,GAO Q H,et al. Berberine attenuates delayed type hypersensitivity by inhibiting Th1 and restoring IFN-γ/IL-4 balance[J]. J Basic Chin Med,2021,27(3):423-426.
[23] LIU B,PIAO X,NIU W,et al. Kuijieyuan Decoction improved intestinal barrier injury of ulcerative colitis by affecting TLR4-dependent PI3K/AKT/NF-κB oxidative and inflammatory signaling and gut microbiota[J]. Front Pharmacol,2020,11:1036. doi:10.3389/fphar.2020.01036.
[24] ZHU Q,ENKHJARGAL B,HUANG L,et al. Aggf1 attenuates neuroinflammation and BBB disruption via PI3K/Akt/NF-κB pathway after subarachnoid hemorrhage in rats[J]. J Neuroinflammation,2018,15(1):178. doi:10.1186/s12974-018-1211-8.
[25] WANG L,MA H,XUE Y,et al. Berberine inhibits the ischemia-reperfusion injury induced inflammatory response and apoptosis of myocardial cells through the phosphoinositide 3-kinase/RAC-α serine/threonine-protein kinase and nuclear factor-κB signaling pathways[J]. Exp Ther Med,2018,15(2):1225-1232. doi:10.3892/etm.2017.5575.
[26] WU Y S,LI Z M,CHEN Y T,et al. Berberine improves inflammatory responses of diabetes mellitus in zucker diabetic fatty rats and insulin-resistant HepG2 cells through the PPM1B pathway[J]. J Immunol Res,2020,2020:2141508. doi:10.1155/2020/2141508.
(2022-10-09收稿 2023-01-12修回)
(本文编辑 陆荣展)

