四川省绵阳市猪细小病毒2型病原检测及遗传变异分析
尹 苗,扶星星,陈希文,王 聪,谢作杰,董鹏宇,邓永涛
(1.四川百诺吉科技有限公司,四川绵阳 621000;2.四川生猪重大疫病监测与防控工程研究中心,四川绵阳 621000)
猪细小病毒(PPV)是一种无包膜、二十面体对称病毒,其基因组大小为4.0~6.3 kb,存在多种基因型(PPV1~7)。PPV感染可导致初产母猪和经产母猪出现不孕,流产,产死胎、木乃伊胎以及重复返情等繁殖障碍[1-2],同时PPV也是造成断奶仔猪多系统衰弱综合症的病原之一[3]。此外,PPV还可与猪圆环病毒2型(PCV2)、猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)及多种细菌发生混合感染,加重对动物机体的致病程度[4-6],因此加强PPV感染监测十分必要。
猪细小病毒2型(PPV2)是新型病毒,由单股负链DNA构成,两端具有不同的发夹结构,2001年被缅甸学者首次发现[7],2006年被正式归类为PPV2。PPV2全长5 486 bp,包含两个开放阅读框(ORF),其中ORF1编码非结构蛋白,ORF2编码结构蛋白。研究[8-12]发现,PPV2普遍存在于欧洲、亚洲和北美洲。近几年,PPV2、PPV3在我国的检出率呈上升趋势[13]。绵阳市是四川省生猪养殖大市,每年可供应育肥猪数百万头,目前尚缺少该地区集约化养猪场PPV2的感染及毒株变异信息。
本研究采集了2021—2022年绵阳市三台县、梓潼县、北川县、江油市等地区10个规模化猪场的296份临床病猪血清样品,利用PCR技术进行了PPV2检测,并利用DNA MAN等软件进行了全基因组遗传变异分析,旨在了解PPV2感染及遗传变异现状。
1 材料与方法
1.1 样品来源
2021—2022年采集绵阳市三台县、梓潼县、北川县、江油市等地区10个规模化猪场中表现高烧、流产或腹泻症状的296份生猪血清样品。所有样品均由四川生猪重大疫病监测与防控工程研究中心鉴定和保存。
1.2 主要试剂
DL 2 000 DNA Maker、DNA提取试剂盒、2×TaqPCR Master Mix、ddH2O、Gene Green核酸染料,购自天根生化科技(北京)有限公司;琼脂糖,购自上海必德生物技术有限公司。
1.3 引物设计与合成
下载GenBank中已发表的PPV2基因序列,利用DAN MAN和Primer5.0软件设计引物(表1),送至擎科生物科技股份有限公司合成。

表1 引物信息
1.4 核酸提取与目的片段扩增
血清样品经12 000 r/min离心后,吸取200 μL样品上清液,按DNA提取试剂盒说明书提取病毒DNA。以提取的DNA为模板进行PCR扩增,反应体系见表2。将PCR扩增产物进行1.5%琼脂糖凝胶电泳,并置于凝胶成像仪下观察是否有目的条带。阳性样品送至擎科生物科技股份有限公司测序。

表2 PCR反应体系
1.5 PPV2全基因组序列扩增与测序
下载GenBank中已公布的PPV2全基因组序列,使用DNA MAN软件进行序列比对。按照退火温度50~70 ℃,GC含量40%~60%设计PPV2全基因组引物,利用PCR对全基因组进行分段扩增,具体引物信息见表3。将扩增产物进行琼脂糖凝胶电泳检测,并将阳性产物切胶回收、克隆后,送至擎科生物科技股份有限公司测序。
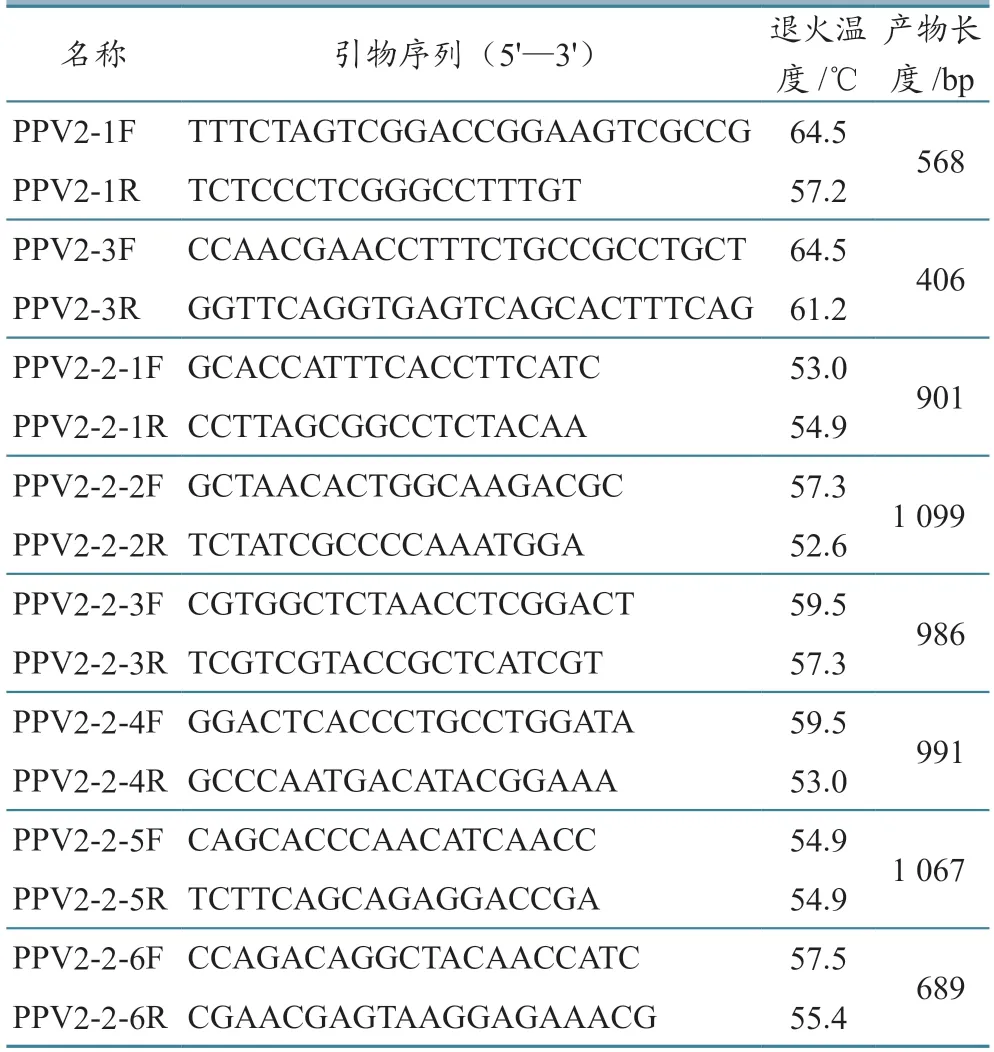
表3 全基因组引物信息
1.6 PPV2全基因组序列分析
应用DNA MAN软件将拼接序列与参考毒株序列(表4)进行核苷酸和氨基酸序列同源性比对。利用MEGA-X软件构建系统进化树(Neighbor-Joining),分析分离株的遗传特征。
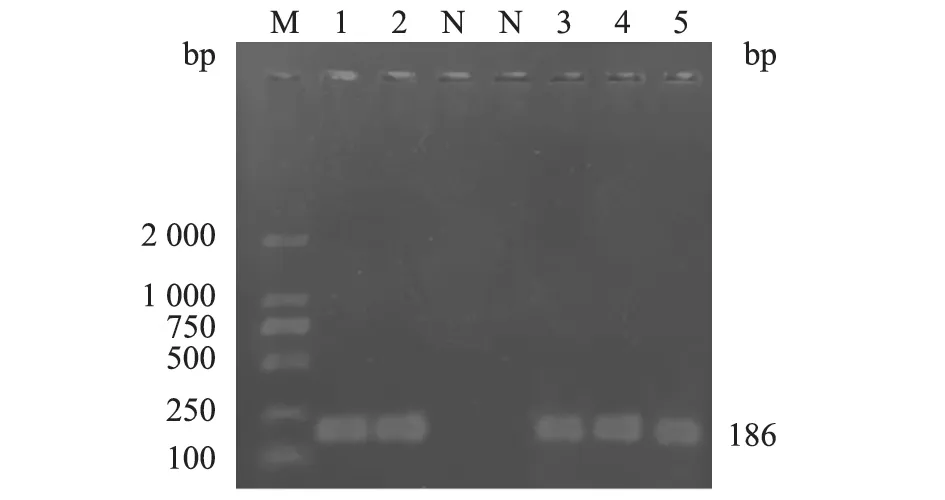
图1 PCR扩增结果
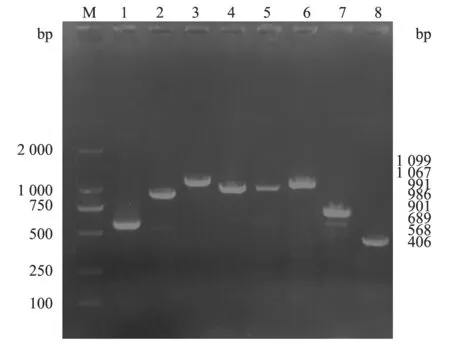
图2 PPV2-11-MY全基因组分段扩增结果

表4 参考毒株信息
2 结果
2.1 PPV2检测情况
利用PCR方法对296份临床血清样品进行检测。结果(图1、表5)显示:PPV2检出率为1.69%(5/296),其中三台县检出率为2.19%(2/91),梓潼县为1.81%(1/55),江油市为1.00%(1/100),北川县为2.00%(1/50)。

表5 不同地区PPV2检出情况
2.2 PPV2全基因组序列分析
2.2.1 PPV2全基因组扩增 选取其中1份PPV2阳性样品(命名为PPV2-11-MY)进行全基因组PCR分段扩增。结果(图2)显示,PPV2-11-MY在568、901、1 099、986、991、1 067、689、406 bp处均出现目的条带。
2.2.2 PPV2全基因组遗传变异分析 将分段基因测序、拼接后进行BLAST比对分析,利用MEGA-X软件构建系统进化树。结果(图3)显示,PPV2-11-MY与12株PPV2参考毒株的核苷酸同源性为93.96%~99.30%,氨基酸同源性为52.50%~73.80%,其中与我国江苏省毒株MW853949.1的同源性最高,二者属于同一分支。

图3 PPV2-11-MY与参考毒株系统进化树
将PPV2-11-MY株全基因组序列转换为氨基酸序列,使用DNA MAN软件与参考毒株进行氨基酸序列比对。结果(图4)显示:PPV2-11-MY全基因组序列存在两个ORF。ORF1长度1 848 bp,编码616个氨基酸;ORF2长度3 126 bp,编码1 042个氨基酸。存在3个高突变区,第一突变区(91~218 aa)有85个氨基酸突变和13个氨基酸缺失,第二突变区(513~626 aa)有81个氨基酸突变和12个氨基酸增加,第三突变区(776~1 065 aa)有189个氨基酸突变、11个氨基酸增加和19个氨基酸缺失。此外,在ORF2编码蛋白的保守区有少量氨基酸突变,包括第1 127位Lys(K)变为Gln(Q),第1 562位Gln(Q)变为Arg(R),第1 656位Thr(T)/Pro(P)变为Ala(A)以及第1 791位Ala(A)/Leu(L)变为Val(V)。

图4 PPV2-11-MY株氨基酸比对结果
3 讨论
近年来,PPV2在全球范围内的检出率逐渐增高,引起各国学者的广泛关注。虽然国外已经有部分PPV2调查研究,但其在我国特别是四川省的研究相对较少。随着PPV的传播变异,现有疫苗已无法有效防控PPV2等新型PPV。因此,了解各地PPV2遗传变异情况对于新疫苗开发至关重要。
研究显示:2010年,PPV在德国100头猪心脏和扁桃体样品中的阳性检出率分别为32%和46%[14];2011年,在泰国清迈地区80份组织样品中的阳性检出率为83%[15];2004—2014年,在我国450头家猪组织样本中的阳性检出率为22.44%[16];2015—2017年,在波兰254份猪血清中的阳性检出率为53.9%[17];2016—2020年,在我国435份猪血清中的阳性检出率为22.53%[18];2022年,在韩国268份血清样品中的阳性检出率为12.2%[19]。为了解四川省绵阳市是否存在PPV2流行,本研究对从4个地区10个规模化猪场收集的296份猪血样品进行了检测,结果PPV2检出率为1.69%,在4个地区均有检出。虽然PPV2检出率较低,但仍证明PPV2在绵阳市存在一定的传播面。
为进一步了解绵阳市PPV2与其他地区PPV2毒株之间的亲缘性和遗传变异性,将PPV2-11-MY进行分段扩增拼接后,获得全长为5 506 bp的全基因组序列。进化树结果显示:PPV2-11-MY株与我国江苏省毒株(MW853949.1)亲缘性最近且属于同一分支,与其余11条参考序列的亲缘性相对较远。PPV2 ORF1编码的非结构蛋白,主要参与病毒复制及转录过程;ORF2主要编码的结构蛋白,参与病毒的骨架构成及抗原表位形成,其中172~412 aa和713~924 aa的抗原指数和亲水性最高[20-23]。测序结果显示:PPV2-11-MY的ORF1和ORF2编码蛋白存在3个高突变区(91~218、513~626、776~1 065 aa),其中第一和第三高变区位于上述抗原指数和亲水性高的区域。结果提示,PPV2-11-MY可能在致病性和免疫原性等方面发生了较大变化,但其病原特性的具体变化还有待于进一步研究。
对绵阳市进行PPV2检测和遗传变异分析不仅丰富了PPV2感染流行病学数据,为后续疫苗研究提供理论依据,同时也为进一步研究PPV2致病机理及毒力奠定基础。虽然绵阳市PPV2感染率较低,但在当前全国猪病复杂、贸易频繁的背景下,包括PPV2感染在内的各种疫病防控压力依然很大。为了降低疫病传播风险,养殖场必须进一步提高生物安全意识,加强引种检测,强化基础免疫,优化饲养管理,定期做好免疫监测,确保猪群健康无疫。

