异功散对功能性消化不良大鼠胃肠动力和肠黏膜屏障功能的影响
李翰星,弓 鹏,庞 越,魏向东,门九章
(山西中医药大学基础医学院,山西 晋中 030619)
功能性消化不良( functional dyspepsia,FD)也称为非溃疡性消化不良,是最常见的功能性胃肠道疾病之一。FD通常表现为上腹部疼痛、持续和反复出现的上腹胀、早饱、厌食、恶心和腹部不适等[1]。FD 的危险因素包括胃肠道感染、腹泻、胃排空和胃调节受损、十二指肠炎症、黏膜通透性改变、使用抗生素或抗炎药、早期环境微生物暴露、吸烟、肥胖、社会心理因素等[2-3]。目前针对FD尚无特效治疗方法,主要是给予饮食调整、药物治疗和心理治疗,与调整饮食和心理治疗相比,药物治疗起效更快,但对症状的改善作用也有限,且不宜长期应用[4-6]。因此,寻找新的有效药物治疗FD至关重要。中医药用于功能性胃肠道疾病的治疗历史悠久[7],其中出自《小儿药证直诀》的异功散具有行气化滞、醒脾助运作用,且补而不滞,主治脾胃气虚兼气滞诸证[8]。杜晓泉教授认为FD的基本病机是脾失健运、胃气壅滞,病位在脾胃,与肝相关,病理因素以食滞、气滞、湿阻最常见,用药以异功散合香苏散为基本方,疗效显著[9]。但异功散治疗FD的机制尚不明确,故本研究通过建立FD大鼠模型,探讨了异功散对FD症状的缓解作用及可能作用机制。
1 实验材料和方法
1.1实验动物 SPF级雄性SD大鼠60只,5~6周龄,体重180~220 g,由山西医科大学迎泽校区实验动物中心提供,生产许可证号:SCXK(晋)2019-0004。大鼠饲养于山西中医药大学动物房,动物使用许可证号:SYXK(晋)2020-0006,保持温度(23±2)℃,相对湿度(55±2)%,进行12 h的光暗循环,持续7 d。本研究获山西中医药大学动物伦理委员会批准(2022017)。
1.2主要药物、试剂和仪器 异功散按《小儿药证直诀》所载原方比例:人参、茯苓、白术、炙甘草、陈皮各6 g,中药均由山西中医药大学附属医院中药房提供,制成水煎剂,并配成含生药约1 g/mL的溶液,充分搅匀,贮于4 ℃冰箱备用。多潘立酮(西安杨森制药有限公司,国药准字H10910003)。苏木素伊红(HE)染色试剂盒、二辛宁可酸(BCA)蛋白质测定试剂盒和超敏ECL化学发光试剂盒购自上海碧云天生物技术有限公司;大鼠胃动素(MTL)、大鼠胃泌素(GAS)、大鼠血管活性肠肽(VIP)和大鼠降钙素基因相关肽(CGRP)ELISA试剂盒均购自生工生物工程(上海)股份有限公司;放射免疫沉淀分析(RIPA)裂解液购自北京索莱宝科技有限公司;闭合蛋白(Occludin)、紧密连接蛋白1(ZO-1)、连接黏附分子1(JAM-1)、β-肌动蛋白(β-actin)和过氧化物酶(HRP)耦联的山羊抗兔IgG均购自英国Abcam公司。BH-2光学显微镜(日本东京奥林巴斯);凝胶成像仪、680型酶标仪(美国Bio-Rad公司)。
1.3实验方法 将60只SD大鼠随机分为对照组、模型组、多潘立酮组、异功散低剂量组、异功散中剂量组和异功散高剂量组,每组10只。对照组大鼠正常喂养,其余5组大鼠采用不规则喂食夹尾刺激法[10]建立FD模型。具体方法:单日喂养,双日禁食。在禁食日,用长海绵钳夹住大鼠尾部1/3的末端,让它们尖叫和挣扎(不损伤皮肤);刺激它们,让它们生气,并让它们与笼子里的其他大鼠打架(任何在打架中被抓伤的大鼠都用碘酒处理以防止感染)。刺激时间为10 min/次,间隔1 h后重复刺激,4 h后停止。14 d后结束造模,大鼠恢复正常喂养。多潘立酮组给予多潘立酮3.5 mg/(kg·d)灌胃,异功散低、中、高剂量组分别给予3 g/(kg·d)、6 g/(kg·d)、12 g/(kg·d)的异功散灌胃,对照组和模型组给予生理盐水10 mL/kg灌胃,均1次/d,持续14 d。在整个研究过程中,所有大鼠均自由饮水。
1.4检测指标及方法
1.4.1大鼠一般情况及体重、摄食量 实验过程中观察大鼠的外观、行为、腺体分泌和呼吸等情况,记录每只大鼠的每日食物摄入量和每周体重,计算体重增量和平均食物摄入量。
1.4.2胃排空率、小肠推进率 末次灌胃后,大鼠禁食24 h,每组随机取6只大鼠,给予5%的石墨粉与牛奶和葡萄糖水糊剂灌服(称重并记录为A1),30 min后麻醉处死。取出胃和小肠,观察胃、胃十二指肠和回肠连接处结扎后肠道内石墨粉的前缘,测量从幽门到回盲部的小肠长度和石墨粉的推进长度。计算肠道推进率:肠道推进率=石墨粉的长度/小肠的全长×100%。切取胃部,称重(记录为A2)后并将其浸入生理盐水中以清洗剩余的石墨粉,用吸水纸擦干以去除表面水分后,再次对胃进行称重(记录为A3),计算胃排空率:胃排空率=(A2- A3)/A1。
1.4.3胃窦组织HE染色病理形态 取各组大鼠的胃窦组织,固定在4%多聚甲醛溶液中48 h后脱水,石蜡包埋,制备4 μm组织切片,切片脱蜡后,苏木素染色2 min,流水冲洗5 min,伊红染色90 s,流水冲洗10 min,60 ℃烤箱烤片30 min,中性树脂封片,光学显微镜下观察。
1.4.4血清脑肠肽指标水平 取每组剩余的4只大鼠,麻醉后进行腹主动脉取血,分离血清并-80 ℃保存。使用ELISA试剂盒测定血清MTL、GAS、VIP和CGRP水平。
1.4.5十二指肠黏膜屏障功能相关蛋白表达情况用RIPA裂解液裂解大鼠十二指肠组织,在4 ℃下12 000 r/min离心15 min,取上清液,采用BCA蛋白质测定试剂盒测量蛋白质浓度。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离裂解产物,并转移到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉封闭膜2 h,然后与一抗闭合蛋白(1∶1 000)、ZO-1(1∶1 000)、JAM-1(1∶1 000)、β-actin(1∶1 000)在4 ℃下孵育过夜,洗膜后加入HRP耦联的山羊抗兔二抗(1∶3 000)在室温下孵育1 h。随后,使用ECL对蛋白条带进行显影,然后在凝胶成像系统下进行拍照。使用β-actin为内参,采用Image J软件对蛋白条带进行灰度分析。

2 结 果
2.1各组大鼠一般情况 对照组大鼠的外观、行为、呼吸等均正常;模型组大鼠出现脾气暴躁、经常扭打、四肢和头部抓挠等异常症状,且活动减少,无精打采,毛发无光,反应迟钝,粪便稀薄;多潘立酮组和异功散中、高剂量组大鼠灌胃14 d后活动量增加,毛发润泽度和反应力有所恢复,粪便正常;异功散低剂量组大鼠状态与模型组大鼠相似。
2.2各组大鼠体重和食物摄入量比较 模型组大鼠的体重增量和食物摄入量均明显低于对照组(P均<0.05)。多潘立酮组和异功散中、高剂量组大鼠的体重增量和食物摄入量均明显高于模型组和异功散低剂量组(P均<0.05),异功散低剂量组大鼠的体重增量和食物摄入量与模型组比较差异均无统计学意义(P均>0.05);多潘立酮组和异功散高剂量组大鼠的体重增量和食物摄入量均明显高于异功散中剂量组(P均<0.05),多潘立酮组和异功散高剂量组间比较差异均无统计学意义(P均>0.05)。见表1。
表1 对照组和功能性消化不良各组大鼠体重和食物摄入量比较
2.3各组大鼠胃排空率和肠道推进率比较 模型组大鼠的胃排空率和小肠推进率均明显低于对照组(P均<0.05)。多潘立酮组和异功散中、高剂量组大鼠的胃排空率和小肠推进率均明显高于模型组和异功散低剂量组(P均<0.05),异功散低剂量组大鼠的胃排空率和小肠推进率与模型组比较差异均无统计学意义(P均>0.05);多潘立酮组和异功散高剂量组大鼠的胃排空率和小肠推进率均明显高于异功散中剂量组(P均<0.05),多潘立酮组和异功散高剂量组间比较差异均无统计学意义(P均>0.05)。见表2。
表2 对照组和功能性消化不良各组大鼠胃排空率和小肠推进率比较
2.4各组大鼠胃窦病理组织形态比较 对照组大鼠胃窦组织形态正常,黏膜光滑,黏膜层和肌层清晰;模型组大鼠胃窦黏膜层可见大量炎性细胞浸润,胃黏膜变薄、破裂;多潘立酮组和异功散中、高剂量组大鼠胃窦黏膜层仅见少量炎性细胞浸润,无明显其他病理损伤;异功散低剂量组病理形态较模型组未见明显改善。见图1。

图1 对照组和功能性消化不良各组大鼠胃窦组织HE染色表现(×200)
2.5各组大鼠血清脑肠肽水平比较 与对照组比较,模型组大鼠的血清MTL和GAS水平均明显降低(P均<0.05),血清VIP和CGRP水平均明显升高(P均<0.05)。异功散低剂量组大鼠血清MTL、GAS、VIP和CGRP水平与模型组比较差异均无统计学意义(P均>0.05);多潘立酮组和异功散中、高剂量组大鼠血清MTL和GAS水平均明显高于模型组和异功散低剂量组(P均<0.05),血清VIP和CGRP水平均明显低于模型组和异功散低剂量组(P均<0.05)。与异功散中剂量组比较,多潘立酮组和异功散高剂量组大鼠血清MTL和GAS水平均更高(P均<0.05),血清VIP和CGRP水平均更低(P均<0.05),多潘立酮组和异功散高剂量组各指标比较差异均无统计学意义(P均>0.05)。见表3。

表3 对照组和功能性消化不良各组大鼠血清脑肠肽水平比较
2.6各组大鼠十二指肠黏膜屏障功能相关蛋白表达情况比较 模型组大鼠十二指肠组织中Occludin、ZO-1、JAM-1蛋白相对表达量均明显低于对照组(P均<0.05);多潘立酮组和异功散中、高剂量组大鼠十二指肠组织中Occludin、ZO-1、JAM-1蛋白相对表达量均明显高于模型组和异功散低剂量组(P均<0.05),异功散低剂量组大鼠十二指肠组织中Occludin、ZO-1、JAM-1蛋白相对表达量与模型组比较差异均无统计学意义(P均>0.05);多潘立酮组和异功散高剂量组大鼠十二指肠组织中Occludin、ZO-1、JAM-1蛋白相对表达量均明显高于异功散中剂量组(P均<0.05),多潘立酮组和异功散高剂量组间比较差异均无统计学意义(P均>0.05)。见图2。
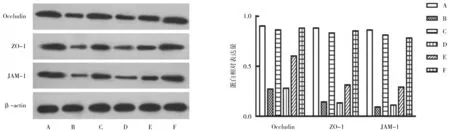
A为对照组;B为模型组;C为多潘立酮组;D为异功散低剂量组;E为异功散中剂量组;F为异功散高剂量组图2 对照组和功能性消化不良各组大鼠十二指肠组织中肠黏膜屏障功能相关蛋白表达情况
3 讨 论
目前治疗FD的常用药物包括抑酸药、促动力药和抗幽门螺杆菌药物[11]。多潘立酮是一种外周多巴胺受体阻滞剂,可增强胃运动,促进胃排空,并协调胃和十二指肠运动[12],故本研究将其作为阳性对照药物。异功散别名小儿异功散、五味异功散,其方药组成是在《太平惠民和剂局方》中补脾的四君子汤(人参、白术、炙甘草、茯苓)中增加行气化滞的陈皮,使参苓术草补而不腻,成为补运兼施之方,产生“补脾而能流动不滞”的功效,在临床应用中已显示出改善FD症状的作用[13]。然而,异功散作用的潜在机制尚不清楚,故本实验进行了相关研究。由于食物摄入减少和体重下降是FD的临床特征,因此在建立FD大鼠模型之前和之后测量并记录大鼠的体重和食物摄入。本实验结果显示,模型组大鼠体重增量和食物摄入量均明显低于对照组,且大鼠精神状态和生理行为表现异常,表明FD大鼠模型成功建立;异功散中、高剂量组大鼠的体重增量和食物摄入量均明显高于模型组,精神状态和生理行为也恢复正常,提示异功散可以改善FD症状。
胃排空是指通过胃和十二指肠的推动作用将食物从胃排空到十二指肠的过程。大多数FD患者有胃肠道运动障碍,这与胃排空延迟有关[14]。肠道运动缓慢和胃排空障碍之间存在密切联系[15]。此外,某些肠道激素如MTL、GAS、VIP、CGRP可能在FD的发病机制中起重要作用[3]。MTL主要作用是促进胃内容物排空[16];GAS存在于胃窦和十二指肠,受中枢和外周神经调节,其可刺激胃酸分泌,能加快胃电节律,促进胃排空[17];VIP广泛分布于神经组织和胃肠道,其可抑制胃肠道运动,延迟胃排空,减慢小肠运动[18];CGRP广泛分布于胃肠道神经丛中,可抑制胃酸分泌,减慢胃肠运动,调节胃肠道激素分泌[19]。基于此,本研究通过检测胃排空率、小肠推进率和上述4种胃肠激素水平来评估异功散对FD大鼠肠胃功能的影响。结果显示,模型组大鼠存在明显胃排空延迟和肠道运动缓慢,血清GAS和MTL水平明显降低,血清VIP和CGRP水平明显增高;与模型组比较,异功散中、高剂量组大鼠的胃排空延迟和肠道运动缓慢明显改善,血清GAS和MTL水平均明显升高,血清VIP和CGRP水平均明显降低。提示异功散可能通过上调GAS和MTL水平、下调VIP和CGRP水平来改善FD大鼠胃肠运动,用量在6~12 g/(kg·d)效果更好。
研究发现FD患者十二指肠内分泌细胞的数量显著减少,导致黏膜屏障功能受损,当黏膜屏障发生功能障碍时,病原体或过敏原会引起免疫反应,这些病原体或过敏原会穿过十二指肠的肠上皮;此外,这种局部反应可能引发肠屏障损伤、肠外症状,甚至全身免疫反应[3,20]。作为上皮机械屏障的重要组成部分,紧密连接相关蛋白如Occludin、ZO-1、JAM-1参与保护肠黏膜,维持黏膜免疫稳态[21]。本实验结果显示,模型组大鼠十二指肠组织中Occludin、ZO-1、JAM-1蛋白相对表达量明显降低,异功散中、高剂量组Occludin、ZO-1、JAM-1蛋白相对表达量均明显高于模型组。提示异功散可能通过上调紧密连接相关蛋白的表达来保护肠黏膜屏障。
综上所述,异功散可以通过调节脑肠肽的分泌促进FD大鼠的胃肠运动,可通过上调紧密连接相关蛋白的表达来保护肠黏膜屏障,为异功散治疗FD提供了一定理论依据。
利益冲突:所有作者均声明不存在利益冲突。

