基于AMPK信号通路介导的自噬流探讨电针结合运动预处理对大鼠心肌缺血再灌注损伤的影响
尹 侠,李宏玉,,朱路文,唐 强
(1. 黑龙江中医药大学, 黑龙江 哈尔滨 150040;2. 黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
冠心病和急性心肌梗死(AMI)是人类死亡的主要原因,经皮冠状动脉介入治疗(PCI)、溶栓治疗是目前最有效的治疗措施,但在恢复心肌血氧供应的同时,可能会引起心肌缺血再灌注损伤[1]。目前研究认为,缺血再灌注损伤的发生机制包括活性氧产生增加、钙超载、炎症反应、线粒体损伤、细胞凋亡、内皮细胞激活和损伤以及自噬等,这些有害影响导致心肌细胞死亡、心肌梗死范围扩大、心律失常和血流动力学受损[2-5]。既往研究证实,缺血预适应在再灌注早期可激活自噬并促进受损的自噬流,发挥抗心肌缺血再灌注损伤的作用,而腺苷酸活化蛋白激酶(AMPK) 作为调节细胞内自噬/溶酶体途径的上游信号通路,一直以来都是人们关注的热点[6-7]。课题组前期研究证实,运动预处理和电针预处理均可通过调节自噬发挥心肌保护作用[8-9],但联合应用对心肌缺血再灌注损伤的影响及机制尚未阐明。本研究基于AMPK信号通路及通路下游的相关自噬蛋白的表达变化,探讨了电针结合运动预处理对大鼠离体心肌缺血再灌注损伤的保护机制。
1 实验材料与方法
1.1实验动物 60只SPF级SD雄性大鼠,体重250~300 g,购自辽宁长生生物技术有限公司,动物许可证号:SCXK(辽)2020-0001。饲养于黑龙江中医药大学动物实验中心,保持室内湿度(50±10)%,温度控制在(22±2)℃,自然昼夜节律,标准饲料喂养,自由饮食、饮水。
1.2实验仪器与试剂 -80 ℃超低温冰箱和-4 ℃冰箱(青岛海尔特种电器有限公司);Langendorff离体心脏灌流实验系统(江苏赛昂斯生物技术有限公司); WB凝胶成像系统(BIO-RAD公司);石蜡切片机[赛默飞世尔(上海)仪器有限公司];荧光正置显微镜(Carl Zeiss)。 Compound C(AMPK抑制剂,ABMOLE中国,M2238);山羊抗兔IgG-HRP、DAB显色液(北京中杉金桥生物技术有限公司);内参GAPDH (Affinity);RIPA裂解液(碧云天生物技术有限公司);多聚甲醛(天津光科密欧有限公司); 肝素钠注射液(天津生物化学制药有限公司,规格:1万IU/mL);LC3Ⅱ抗体(武汉三鹰,14600-1-AP)、p62(武汉三鹰,18420-1-AP)、AMPK(Antibody-AF6423)、哺乳动物雷帕霉素靶蛋白(mTOR,武汉三鹰,66888-1-Ig)。
1.3实验方法 适应性饲养1周后,随机将90只SD大鼠分为对照组、模型组、电针+运动组、电针+运动+生理盐水组、电针+运动+ Compound C组,每组18只。各预处理组先接受3周电针干预及运动干预,然后采用Langendorff灌流系统对除对照组外的其他4组大鼠进行心肌缺血再灌注损伤造模,其中电针+运动+生理盐水组、电针+运动+ Compound C组分别在造模前1~2 h腹腔注射生理盐水和 Compound C 2 mmol/L(3.0 mg/200 g)。
1.3.1预处理方法 ①电针方案:参照《实验针灸学》[10]取双侧心俞穴(第5胸椎棘突下,双侧各旁开约7 mm)、神门穴(前肢内侧腕部横纹尺骨边缘);用华佗牌0.25 mm×25 mm毫针直刺,连接G6805-1电针仪(苏州医疗用品有限公司)。电针参数:频率2 Hz,电压3 V,连续波。每日1次,每次20 min/10 min,每周连续干预6 d。取双侧心俞穴,并在穴位下方2 cm各刺一针作为参考电极、神门穴(在大鼠尾部针刺一处作为参考电极)。负极连接心俞穴、神门穴,正极接参考电极处。②运动方案:进行电动跑台梯度运动训练,跑台起始速度为20 m/min,第1天运动时间为20min,每2d运动时间增加5 min,直至运动时间60 min/d,每周连续干预6 d。
1.3.2心肌缺血再灌注造模方法 腹腔注射1%戊巴比妥钠溶液40~50 mg/kg麻醉大鼠,同时给予肝素钠注射液100 IU/100 g腹腔注射抗凝。固定大鼠,开胸后快速取出心脏,将其放入4 ℃ K-H营养液中并充分挤压心脏内血液,然后用动脉夹将心脏固定在装置上,用1号线结扎,采用KH液(含95%O2和5% CO2)于37 ℃下恒温恒压灌流。 对照组大鼠心脏灌注180 min;各造模组大鼠灌注20 min后,在无氧和无灌流液的条件下,于37 ℃下缺血40 min,后复灌120 min。
1.4检测指标及方法
1.4.1线粒体ATP含量 实验结束后,用PBS对心脏进行冲洗,滤纸吸干水分,放在玻璃皿内置于冰上。用手术刀切取0.1 g心肌组织,用镊子移至离心管中,加入PBS进行清洗;弃掉PBS溶液,将盛有组织的离心管置于冰上,用小研磨棒进行均匀研磨,加入1 mL PBS,冰浴3 min,离心、弃上清;加入800 μL 4 ℃胰酶消化液,置于冰上20 min,离心、弃上清;加入20 μL线粒体分离试剂,移液枪混匀;离心、弃上清,加入80 μL 4 ℃线粒体分离试剂,在冰上进行研磨,离心后小心把上清转移至新的离心管中,离心、弃上清,余下的沉淀即为分离得到的心肌线粒体;用40 μL相应的线粒体储存液重悬线粒体,置于冰上,根据ATP ELISA试剂盒说明进行测定,计算出ATP含量。
1.4.2心肌组织超微结构 切取约1 mm×1 mm×1 mm大小心肌组织,放入4 ℃的2.5%戊二醛磷酸缓冲液中固定24~48 h,然后进行漂洗、梯度丙酮脱水、浸透、包埋、切片(厚度50~70 nm)、染色,透射电镜下观察心肌细胞内自噬小体和自噬溶酶体等结构。
1.4.3心肌组织中转录因子EB(TFEB)表达情况切片常规脱蜡至水,进行抗原修复,将柠檬酸抗原修复液(100×)稀释至1×,将切片放入塑料染色缸,倒入配好的抗原修复液(九分满,盖子放在上面不要盖严),微波炉中火加热15 min,冷却至室温。PBS洗3 min×5次;加入适量的内源性过氧化物酶阻断剂,室温孵育10 min; PBS缓冲液冲洗3 min×5次;滴加山羊血清,37 ℃孵育40 min以封闭非特异性的背景染色;甩掉山羊血清,滴加一抗工作液(可以PBS稀释抗体或PBS配制的3%BSA稀释抗体), 37 ℃孵育1 h或4 ℃过夜;PBS缓冲液冲洗3 min×5次;滴加酶标兔抗山羊IgG聚合物(二抗),在室温下孵育20 min;PBS缓冲液冲洗3 min×5次;加入适量新鲜配制的DAB显色液,室温孵育5~8 min;自来水充分冲洗,苏木素染色液复染20 s,分化、冲洗返蓝;脱水、透明、封片,镜下观察。
1.4.4心肌组织中p-AMPK、AMPK、p-mTOR、mTOR、p62、LC3蛋白表达情况 采用Western blot法检测:取各组液氮速冻后的相同位置心肌组织,每0.1 g组织中加入1 mL裂解液,研磨后低温匀浆,离心取上清,BCA法进行蛋白定量,采用酶标记法进行检测。样本中的蛋白质含量由标准曲线计算。按照先前所算出的溶酶体溶液中蛋白质的含量进行制样;根据蛋白分子量制备分离胶(6%,8%)、浓缩胶(5%),上样,在恒定电压100 V的条件下进行电泳,电泳器调节到恒流200 mA,薄膜旋转120 min进行转膜,使用5%脱脂奶封闭液在室温条件下封闭1 h,加入一抗摇床孵育过夜,弃掉一抗稀释液,用TBST缓冲液冲洗,加入兔二抗稀释液(1∶5 000稀释于含5%脱脂奶粉的TBST中)室温孵育1 h,弃掉二抗稀释液,在TBST中冲洗。ECL反应显色、曝光成像,用凝胶处理系统进行灰度值计算。
1.5统计学方法 采用SPSS 26.0软件对研究数据进行处理,所有数据行正态性检验后均符合正态分布,多组间比较采用ANOVA单因素方差分析,若方差齐,两两差异比较采用LSD-t检验;若方差不齐,则采用塔姆黑尼T2检验。以P<0.05表示差异有统计学意义。
2 结 果
2.1各组大鼠心肌线粒体中ATP含量 模型组大鼠心肌线粒体中ATP含量明显低于对照组(P<0.05);电针+运动组、电针+运动+生理盐水组大鼠心肌线粒体中ATP含量均明显高于模型组和电针+运动+Compound C组(P均<0.05),电针+运动组与电针+运动+生理盐水组比较差异无统计学意义(P>0.05)。见图1。
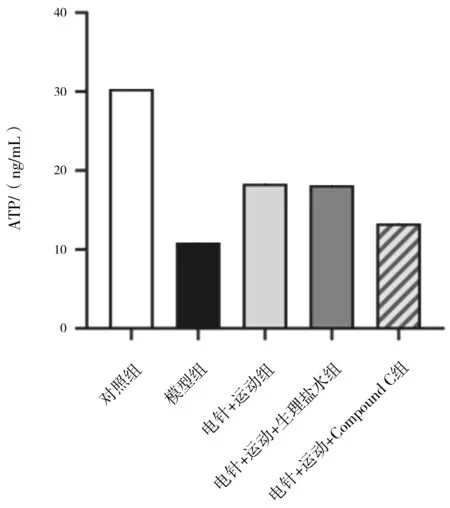
图1 对照组和心肌缺血再灌注各组大鼠心肌线粒体中ATP含量
2.2各组大鼠心肌组织透射电镜下表现 对照组大鼠心肌组织超微结构正常,肌节排列整齐,线粒体结构完整,散在分布于肌纤维之间,心肌间质未见明显异常改变;模型组大鼠心肌细胞中肌丝模糊,部分溶解变性,胞质中度水肿,线粒体肿胀呈圆形,基质间隙变宽;电针+运动组、电针+运动+生理盐水组大鼠心肌细胞中见自噬小体与散在分布的溶酶体,胞质轻度水肿,线粒体轻度肿胀;电针+运动+ Compound C组大鼠心肌肌原纤维排列稍整齐,少部分肌丝间隙发生水肿,肌丝断裂,线粒体轻度水肿,嵴密度降低。见图2。
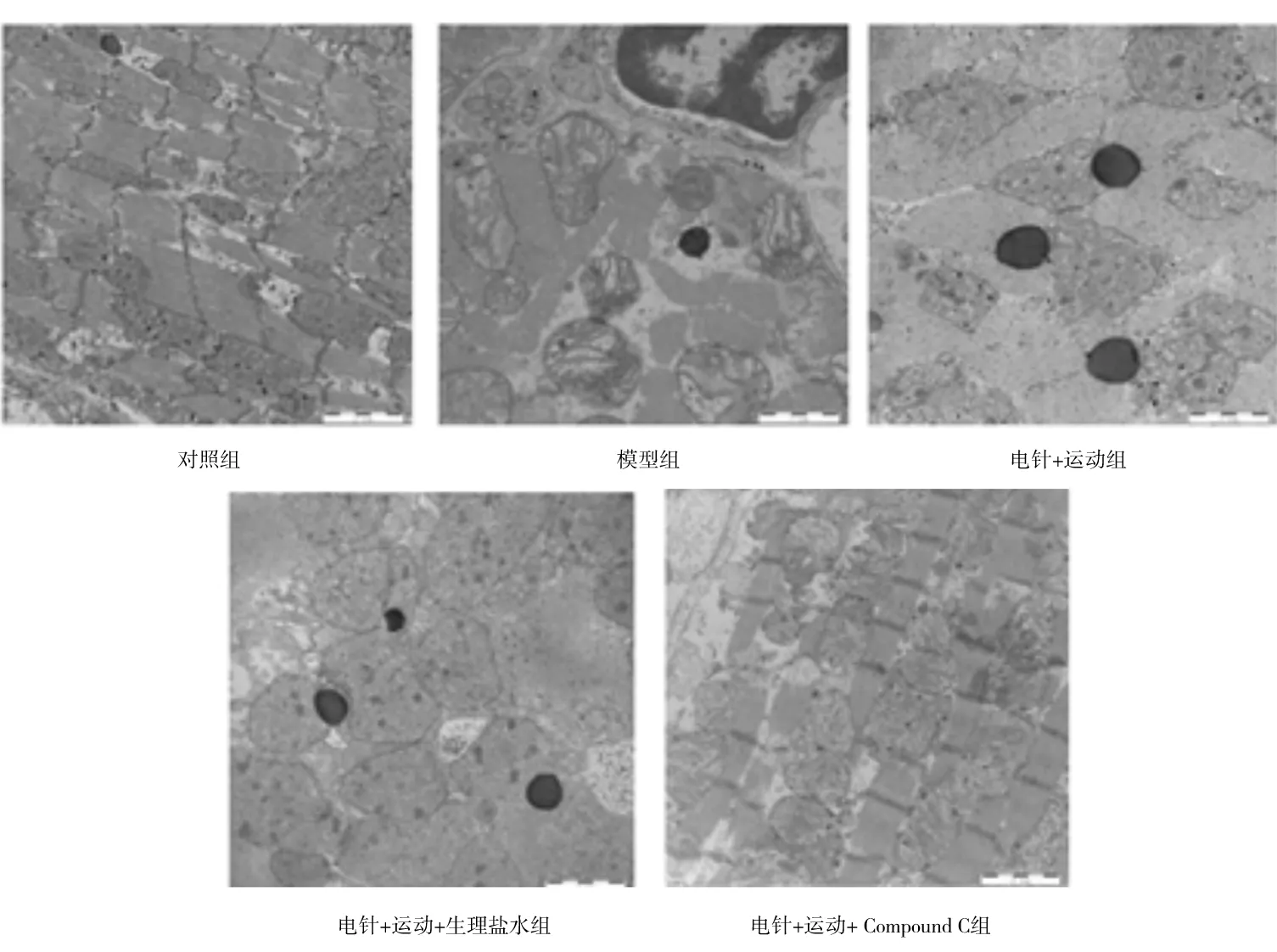
图2 对照组和心肌缺血再灌注各组大鼠透射电镜下心肌组织超微结构(2 μm)
2.3各组大鼠心肌组织中TFEB阳性表达情况
TFEB被染成棕黄色,与对照组比较,模型组TFEB阳性表达显著增多;与模型组比较,电针+运动组、电针+运动+生理盐水组TFEB阳性表达明显减少;与电针+运动组、电针+运动+生理盐水组比较,电针+运动+ Compound C组TFEB阳性表达明显增多。见图3。
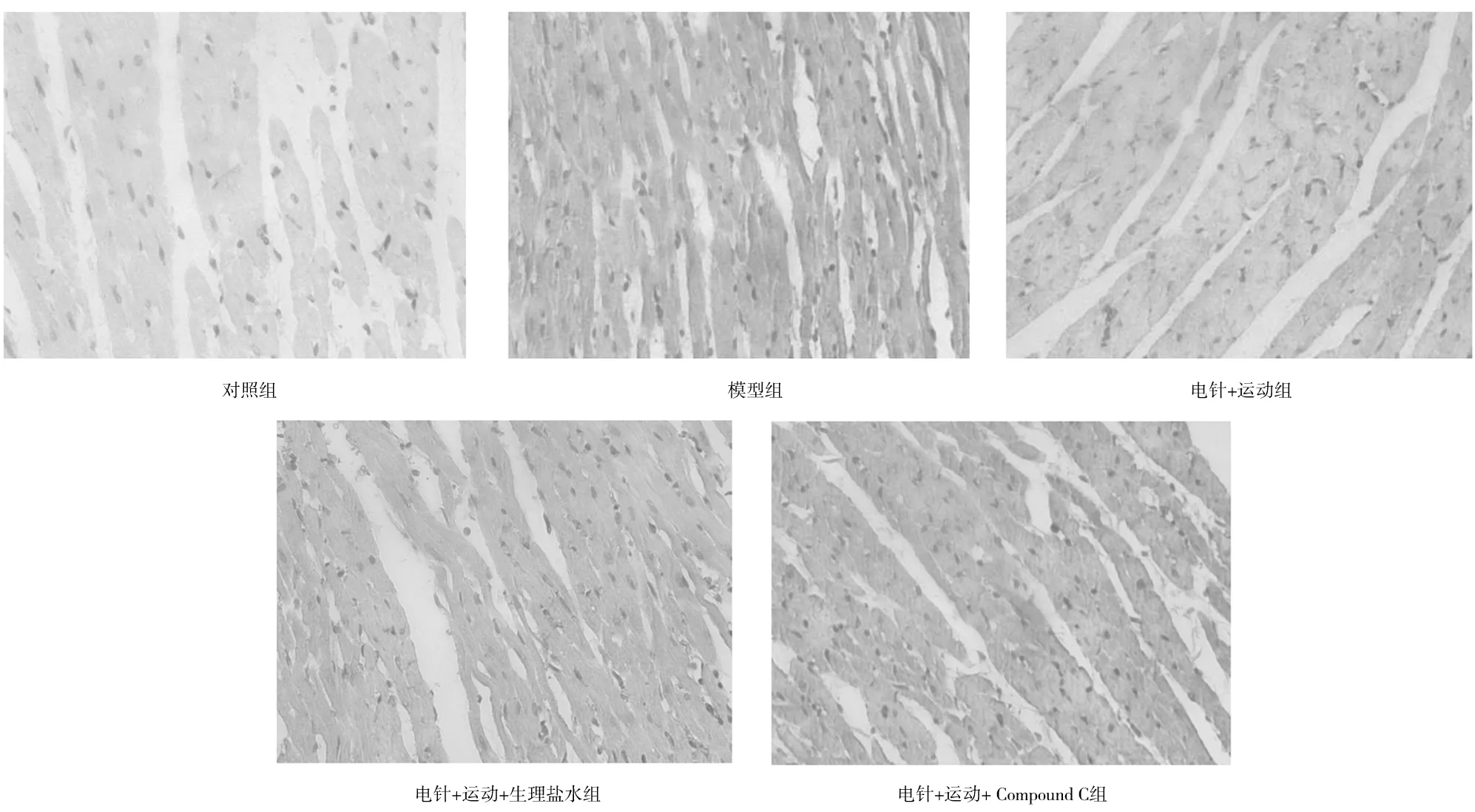
图3 对照组和心肌缺血再灌注各组大鼠心肌组织中转录因子EB阳性表达情况(免疫组化染色,×400)
2.4各组大鼠心肌组织中p-AMPK、AMPK、p-mTOR、mTOR、p62、LC3蛋白表达情况 与模型组比较,电针+运动组、电针+运动+生理盐水组p-AMPK/AMPK比值与LC3Ⅱ蛋白表达量均明显增高(P均<0.05),p-mTOR/mTOR比值与p62蛋白表达量均明显降低(P均<0.05);与电针+运动组、电针+运动+生理盐水组比较,电针+运动+ Compound C组p-AMPK/AMPK比值与LC3Ⅱ蛋白表达量均明显降低(P均<0.05),p-mTOR/mTOR比值与p62蛋白表达量均明显增高(P均<0.05);电针+运动组各指标与电针+运动+生理盐水组比较差异均无统计学意义(P均>0.05)。见图4及图5。
3 讨 论
目前预处理已成为防治心肌缺血再灌注损伤的重要手段,其中缺血预适应的心肌保护作用已得到证实[11-12],但由于缺血是一个不可预测的因素,这限制了其在临床实践中的应用。因此,探索一种安全、有效、低不良反应的治疗方法已成为该领域的研究热点。
既往研究表明,电针预处理对冠心病、心律失常和心肌缺血再灌注损伤有保护作用[13-16]。本课题组前期研究证实,单独电针和运动预处理可通过调控自噬以及炎性通路来减轻心肌缺血再灌注损伤[8-9,17]。但单纯从自噬体的数量以及标志性自噬蛋白的表达来评价自噬变化,严格意义上是不准确的,因为自噬本身是一个动态发生的过程,自噬流是否通畅能够更加准确地评价自噬的发生发展[18]。故本实验基于AMPK介导的自噬流,探讨了电针和运动联合预处理对心肌缺血再灌注损伤的影响。
在调控自噬的过程中,AMPK作为细胞内调控能量稳态的重要激酶和细胞能量感受器,其可以对低 ATP水平作出应答,并且被激活之后,能够正向调控信号转导途径,从而来补充细胞的ATP供给,是经典的自噬途径蛋白。mTOR是AMPK下游的一个底物,活化的AMPK能够通过抑制mTOR来调控细胞内自噬水平,当AMPK信号通路受到抑制时,细胞内的自噬水平随之下降[19]。TFEB作为自噬和溶酶体生物合成的主要转录调节因子,能够被mTORC1直接进行磷酸化修饰,其被认为是自噬-溶酶体基因转录的主要激活剂。LC3作为自噬标志性的蛋白定位于自噬体膜[20],分为Ⅰ型和Ⅱ型。当自噬受激活启动时,泛素化的LC3Ⅰ与自噬膜上的磷脂酰乙醇胺结合,形成 LC3Ⅱ。LC3Ⅱ的早期积聚预示自噬体的形成增加,成为自噬体的标志物[21]。但是单纯的自噬水平升高究竟是上游自噬通量的增加引起,还是下游自噬体与溶酶体融合或溶酶体的降解受阻导致的,需要进行验证明确。p62作为一种自噬特异性底物,它能够与 LC3相互作用,在自噬溶酶体的促进下渗透入自噬细胞,并对其发生过程进行进一步的监测。当LC3Ⅱ升高而p62降低时,表明自噬流通畅;如果LC3Ⅱ和p62均升高,表明自噬起始正常,但下游不通,自噬体和溶酶体不能融合,自噬流受阻。
本实验结果显示,电针+运动组、电针+运动+生理盐水组p-AMPK/AMPK比值与LC3Ⅱ蛋白表达量均明显高于模型组,p-mTOR/mTOR比值与p62蛋白表达量均明显低于模型组,TFEB阳性表达明显少于模型组,提示电针结合运动预处理可激活 AMPK 的磷酸化并抑制mTOR,mTOR的下调使TFEB 启动,TFEB可以促使自噬体的数量增加,并促进了溶酶体的产生,说明自噬体与溶酶体融合通畅,这与透射电镜的观察结果是相一致的。为了进一步证实电针联合运动预处理可调控AMPK所在通路,本实验加入了AMPK抑制剂来进行对照,结果显示与电针+运动组、电针+运动+生理盐水组比较,电针+运动+ Compound C组p-AMPK/AMPK比值与LC3Ⅱ蛋白表达量均明显降低,p-mTOR/mTOR比值与p62蛋白表达量均明显增高,提示Compound C可能通过AMPK-mTOR 途径部分抵消掉电针结合运动预处理对AMPK通路调控自噬的促进作用。因此本研究认为电针结合运动预处理可通过调控AMPK信号通路促进自噬流发挥了对心肌缺血再灌注损伤大鼠的心肌保护作用,其更深入的关系有待继续进行研究。
利益冲突:所有作者均声明不存在利益冲突。

