不同消毒方式供水管网中消毒副产物的分布特征
王虹, 於文萱, 胡宇星, 蔡栩丞, 庞维海
(同济大学 环境科学与工程学院,上海 200092)
消毒剂的使用可抑制水中微生物尤其是病原菌的生长,保障居民饮用水安全。然而,消毒剂的投加会引起消毒副产物(DBPs)的生成,对人类健康具有潜在危害,长期暴露存在致癌等风险。DBPs的种类繁多,常见的DBPs有三卤甲烷(THMs)、卤乙酸(HAAs)、卤乙腈(HANs)等等,包括我国在内的多个国家已经将THMs和HAAs列入饮用水卫生标准,常规指标中对4种常见THMs和2种常见HAAs 有明确浓度限值要求(GB5749-2022)。
近年来,HANs等含氮DBPs(N-DBPs)也引起公众的关注,一般而言,N-DBPs在饮用水中的浓度较低,但具有更高的细胞毒性和遗传毒性[1-2]。
目前,氯消毒是我国饮用水系统应用最为广泛的消毒策略[3],氯胺消毒、二氧化氯消毒[4-5]等消毒方式在局部地区也有一定范围的应用。一般认为, 常用的氯消毒会生成较多THMs和HAAs等标准内DBPs,选择氯胺、二氧化氯消毒可一定程度上降低THMs和HAAs生成,但可能导致卤代氰、氯酸盐以及亚氯酸盐等特定的DBPs的生成[6]。除消毒剂外,供水管网中DBPs的生成也受水化学性质、管网条件等因素影响[7]。
杭州某水厂将水源从钱塘江切换为千岛湖外调水源后,饮用水中消毒副产物的构成特征明显变化,DBPs总量削减32.02%[8]。相似地,一项针对克罗地亚地区的研究揭示,相较于地表水水源,使用地下水作为水源的供水管网中DBPs的总量显著减少[9]。
此外,供水管网的使用年限[10],管网腐蚀程度[11]以及管道内壁生物膜生长情况[12]均会影响饮用水中消毒副产物的浓度,然而,针对不同消毒剂影响下实际供水管网中DBPs的发生规律的对比研究仍较少。明晰不同消毒剂影响下实际供水管网DBPs生成和浓度水平的关键因素,对保障用户用水安全具有重要意义。
本文以我国东南沿海3座城市的供水管网为研究对象,考察采用不同类型二次消毒剂(secondary disinfectant)的管网水中3类典型DBPs(THMs、HAAs、HANs)的发生规律和分布特征,探索消毒剂残余量、输配距离、停滞时间、水化学组分等因素与DBPs发生规律的关联性。研究结果可为不同水质地区DBPs的风险评估和管控提供数据参考。
1 材料与方法
1.1 采样点选择
选取位于WJ(氯,以下简称WJ-Cl2)、SZ(氯,SZ-Cl2;二氧化氯,SZ-ClO2)和SH(氯胺,SHNH₂Cl)三座城市采用不同类型二次消毒剂的四个局部管网为研究对象,分别于2019年7月、9月和2020年8月进行水样采集。根据采样点到给水厂距离远近对主干管网沿程进行水样采集,共获取水样117份,其中主管网水样44份,龙头水73份。
1.2 水样采集方法
根据《生活饮用水标准检验方法:水样的采集与保存》(GB/T 5750.2-2006)进行水样采集。主管网水样通过两种方式采集:①消防栓:冲水10 min,余氯稳定后采样[13];②主管网附近水龙头:仅WJ-Cl2系统无法通过消防栓采样,故选择主管网附近由市政管网直接供水的水龙头,放水10 min以上待出水余氯稳定后采集水样。该采样法获取的水样可代表市政管网水质[14]。室内供水管道样品取自用户端水龙头,采样前采用酒精擦拭龙头表面,放水1—2s后去除残余酒精后进行采集[15-16]。采用1 000 ml玻璃瓶采集用于DBPs、硝酸盐和亚硝酸盐分析,并在冷藏条件下尽快运往实验室。采样当场进行消毒剂浓度、浊度、电导率、pH、温度的测定。
1.3 分析方法
利用SevenGo Duo便携式多参数测试仪对水样的温度、pH和电导率进行测定,利用浊度仪(哈希HACH 2100Q)测定浊度。采用分光光度法(HACH DR1900)检测余氯、总氯和二氧化氯的浓度,采用HACH法测定氨氮浓度(NO.8155),采用离子色谱法(883 Basic IC plus 1)测定硝酸盐和亚硝酸盐浓度。
测定的DBPs包括三氯甲烷(TCM)、一溴二氯甲烷(BDCM)、二溴一氯甲烷(DBCM)和三溴甲烷(TBM);二氯乙腈(DCAN)、溴氯乙腈(BCAN)、二溴乙腈(DBAN)和三氯乙腈(TCAN);以及氯乙酸(MCAA)、一溴乙酸(MBAA)、二氯乙酸(DCAA)、三氯乙酸(TCAA)、溴氯乙酸(BCAA)、一溴二氯乙酸(BDCAA)、二溴乙酸(DBAA)、二溴一氯乙酸(CDBAA)、三溴乙酸(TBAA)。参照《生活饮用水标准检验方法:消毒副产物指标》(GB/T 5750.10-2006)利用气相色谱质谱联用仪(Atomx 7890B+5977B)对DBPs进行定量。吹扫捕集仪结合GCMS进行THMs浓度测定,实验采用60m×0.25mm DB-VRX熔融石英毛细柱,柱温程序:40℃保持1 min;以20℃·min-1的速度升至200℃,保持1 min;以10℃·min-1的速度升至250℃,保持2min。用液液萃取气相色谱法结合GC-ECD进行HANs浓度测定,调整气化室温度为180 ℃,柱箱温度为100 ℃,检测器温度180 ℃,气体流量为氮气32 ml·min-1,氢气45 ml·min-1,空气450 ml·min-1。采用液液萃取衍生气相色谱法结合GC-ECD进行HAAs含量的测定,柱温程序:35 ℃保持7 min;以5℃·min-1的速度升至70 ℃;以30℃·min-1的速度升至250 ℃,保持5 min。
1.4 数据处理和统计学分析
所有统计分析使用R 4.1.3进行,显著性水平设置为0.05。采用Shapiro-Wilk检验判断数据是否符合正态分布,根据正态性检验和方差分析的结果,选择合适的统计方法进行组间差异分析。采用ANOVA检验或Kruskal-Wallis检验进行多组数据比较。采用Wilcoxon检验或Student's t检验判断两组数据之间是否存在显著性差异。采用Spearman相关性分析评估不同消毒副产物与理化指标之间的相关性。
2 结果与讨论
2.1 常规理化指标
4个供水系统管网共采集117个水样,其常规理化指标如表1所示。样品水温在27~35 ℃之间,其中SH-NH₂Cl系统中水温的平均值为31.78℃,略高于其他3个系统(显著性水平P<0.05)。绝大部分水样pH在6.57~8.07之间,WJ-Cl2、SZ-Cl2、SZClO2三系统中各有1~3个水样pH超过国标限值8.5。WJ- Cl2水样的浊度均值为1.16±3.84 NTU,远高于其他3个系统(P<0.05)。WJ- Cl2水样中总有机碳平均浓度为4.60±6.75 mg·L-1(0~26.42 mg·L-1),是其他3个系统均值的2~9倍(P<0.05)。高TOC均值可能与源水水质有关,WJ- Cl2系统以太湖为水源,水质略差于以水库为水源的其他地区[17-19]。根据《饮用水卫生标准》(GB 5749-2022)中的要求,饮用水中浊度应低于1 NTU,总有机碳的限值为5 mg·L-1。12个水样浊度超过现行国标限定范围,15个水样TOC超标,超标点位多为龙头水,和该部分龙头长时间未使用有关(具体见后文讨论)。

表1 4个供水系统水样的理化特征(平均浓度±标准差)Tab.1 Physicochemical index of water samples from four drinking water distribution systems(mean concentration ± standard deviation)
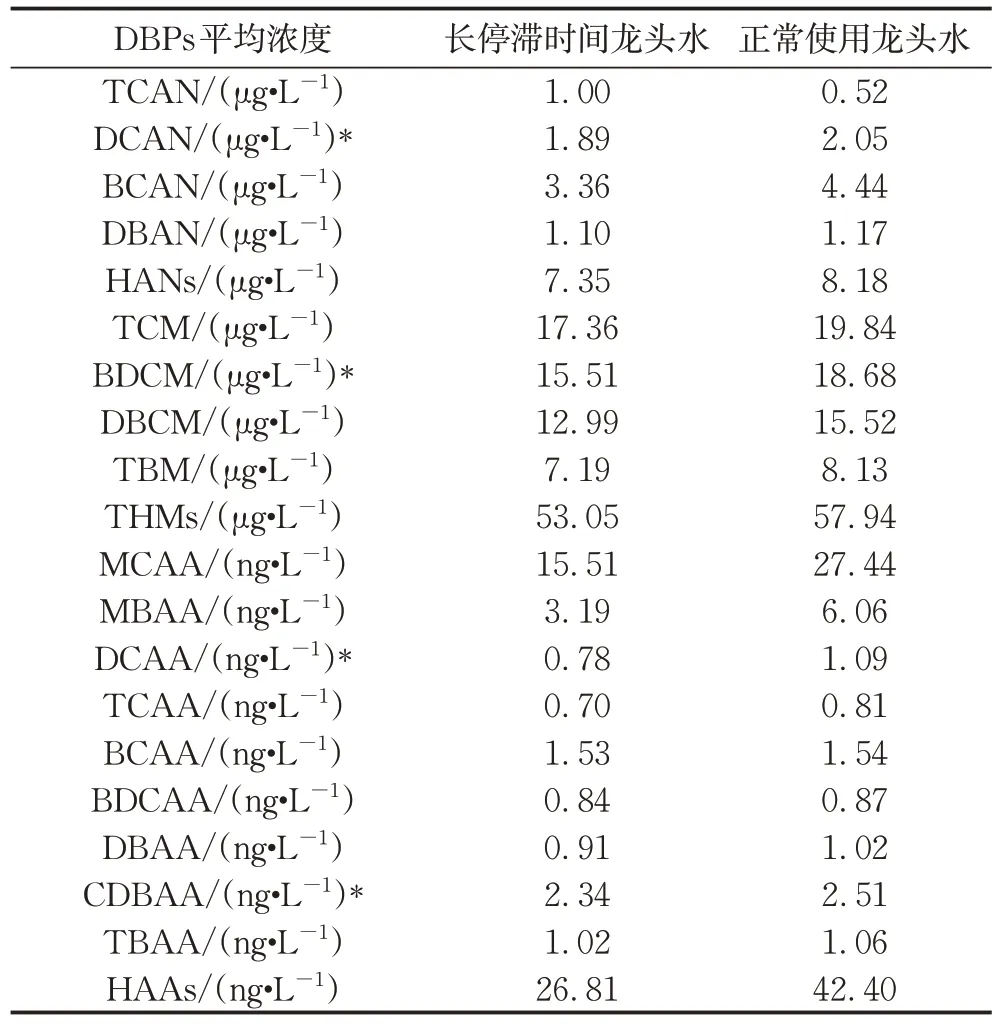
表2 WJ-Cl2系统中不同使用频率龙头水中DBPs浓度水平Tab. 2 The levels of DBPs in tap water with different usage frequencies in WJ-Cl2 system
2.2 不同消毒方式供水管网DBPs的分布特征
(1)THMs
图1展示了4个不同供水管网THMs的检出水平,图中a、b、c用于标注组间差异的显著性,同字母组之间差异不显著,不同字母组表示组间存在显著性差异(P<0.05)。THMs中TCM浓度最高,占THMs总量的31.1%~84.6%,这与佛山管网水调查中TCM浓度的占比接近(47.9%~84.3%)[20]。SZ-Cl2系统水样中TCM含量最高,平均浓度为38.53±13.89 μg·L-1(P<0.05)。WJ-Cl2系统BDCM、DBCM、TBM平均浓度最高,分别为16.89±5.66 μg·L-1、14.23±6.98μg·L-1、7.53±4.01 μg·L-1(P<0.05)。SZ-ClO2系统水样的THMs浓度平均值为0.33 ± 1.40 μg·L-1,仅为SZ-Cl2、WJ-Cl2系统的0.7 %左右(P<0.05)。该结果印证了氯与水中有机物反应生成THMs和其他卤化副产物[21],二氧化氯与水中有机物几乎不生成THMs这一观点[22]。二氧化氯消毒可有效控制水中TCM等有DBPs的生成[22]。
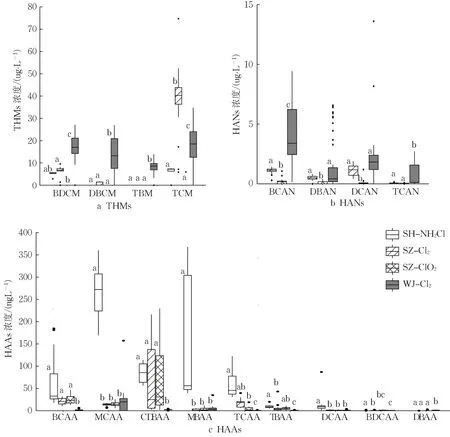
图1 4个供水管网饮用水中DBPs的分布特征Fig 1. Characteristics of DBPs in four drinkingwater distribution systems
现行国标中规定,各种THMs浓度与标准的比值之和不超过1,如下:
式中: BDCM为一溴二氯甲烷浓度、DBCM为二溴一氯甲烷浓度、TBM为三溴甲烷浓度、TCM为三氯甲烷浓度,分母为国标中对应THMs限值,μg·L-1。
本文中10个水样超过国标限值,其中8个水样来自WJ-Cl2系统,2个来自SZ-Cl2系统。这一结果与2010—2011年深圳市饮用水消毒副产物评估中THMs的合格率87.5%水平接近[23]。以上数据表明,使用氯消毒剂的管网中THMs处于较高污染水平。
(2)HANs
图1b为4个供水系统水样HANs的浓度分布特征。HANs的总含量为0.09~17.29 μg·L-1,与美国饮用水HANs 水平(3.0~14.0 μg·L-1)[24]以及英国饮用水HANs浓度(ND~12.1 μg·L-1)[25]接近。不同供水系统中HANs平均浓度从高到低依次为WJ-Cl2> SZCl2> SZ-ClO2,平均值分别为8.13 ± 4.04 μg·L-1、2.79 ± 0.71 μg·L-1、0.50 ± 0.48 μg·L-1(SH-NH₂Cl系统因仪器故障未进行HANs分析)。我国现行国标未对HANs的含量进行限定,世界卫生组织颁布的现行《饮用水水质准则》中DCAN、DBAN的指导值分别为20 μg·L-1和70 μg·L-1,所研究水样HANs浓度未超过相关规定。
(3)HAAs
4个供水系统水样中HAAs的总含量在7.65~965.95 ng·L-1之间,其中MCAA的占比最高,其次为CDBAA,分别为34.9%和24.3%。本文HAAs的总含量低于英国中部和北部某地区的饮用水平均值(35 100~94 600 ng·L-1),但具体组分组成不同,英国中部和北部某地区饮用水中HAAs占比最高的为TCAA和DCAA[26]。SH-NH₂Cl系统HAAs浓度最高,均值为628.81±203.47 ng·L-1,是其他3个系统的5~19倍(P<0.05)。
多个研究表明,以氯胺为消毒剂可以有效降低HAAs的生成[27-29]。例如,在对浙江金华某地水源水的小试中观察到和氯相比一氯胺通常导致较低的HAAs浓度[30]。本文氯胺消毒系统(SH-NH4Cl)中高HAAs浓度可能与原水中HAAs前体物含量较高相关[28]。现行国标仅对两种HAAs 进行最高限制要求: DCAA≤50 μg·L-1,TCAA≤100 μg·L-1。本文采集的水样中HAAs浓度均符合要求。
3.2 消毒剂浓度和DBPs在供水管网沿程的变化规律
如图2所示,在SH-NH₂Cl系统中,消毒剂浓度、理化指标随输配距离变化最为明显。其中,消毒剂浓度与输配距离成反比(相关系数r=-0.57,P<0.05),表明饮用水在管网输送过程中余氯被逐渐消耗[31]。氨氮浓度沿程减少,硝酸盐和亚硝酸盐沿程增加(rNO₃-= 0.37,rNO₂-= 0.60,rNH₃= -0.60,P<0.05),说明管网中发生了硝化反应,氨氮被氧化为亚硝酸盐和硝酸盐[32-33]。前人研究表明,氯胺消毒管网中存在硝化微生物,可以介导管网中硝化反应,加剧消毒剂的分解[34]。
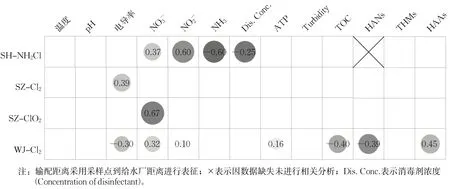
图2 4个供水系统中理化指标、DBPs和输配距离的相关性分析Fig.2 Correlation analysis of physicochemical parameters, DPBS and distribution distance in four drinking water distribution systems
只有WJ-Cl2系统中DBPs与输配距离有显著相关性(P<0.05),这可能是因为WJ地区采样点较多,输配距离较长。WJ-Cl2系统中HAAs浓度沿程增加(r= 0.45,P<0.05),这表明水力停留时间的增加会导致HAAs生成的增多,与前人对管网中HAAs浓度调查的研究结果一致[29-30]。HAAs在4-50℃范围内不易自分解[35]。相反,HANs浓度随输配距离增加而减少(r=-0.49,P<0.05)。这一趋势与佛山市某供水管网的研究结论相反,HANs在随输配距离的增加而增加[20]。土耳其某地的研究中同样发现管网末梢的HANs浓度最高[36]。本文中HANs的降低可能与HANs的分解能力有关。Zhang等人研究表明,中等水温(25℃)下,HANs浓度在氯化反应后的6d内呈先迅速上升,后随时间逐渐下降的趋势[35]。
3.3 主管网水和龙头水中DBPs的含量差异
龙头水的平均消毒剂浓度为0.12 mg·L-1,显著低于管网水消毒剂浓度0.43 mg·L-1(P<0.05)。且本文共有34个水样低于《饮用水卫生标准》(GB 5749-2022)的限值0.05 mg·L-1,管网水不合格率为13.7%,龙头水不合格率高达54.5%,说明供水管网末梢确保消毒剂残余仍存在较大挑战。其中,79%的不合格水样来自WJ-Cl2系统,这可能与该系统采样点包含较多长低频用水建筑有关。
龙头水的平均浊度为1.43 NTU,显著高于管网水(0.31 NTU,P<0.05),约22.7%龙头水浊度超过现行国标的限制(1 NTU)。其中,WJ-Cl2系统某龙头水浊度高达29.2 NTU,但经过最大流速放水5min后可降至合格范围内。对浙江省绍兴市某小区的水质监测中同样存在龙头水浊度水质较管网略有下降的情况[37]。然而,对比龙头水和主管网水中的DBPs分布特征,发现DBPs在两类水样中浓度水平无显著区别(P>0.05)。
3.4 长期管道滞留饮用水中DBPs的分布特征
因假期、疫情封控等原因,饮用水可能在管道中滞留较长时间,本文对比分析了WJ-Cl2系统中存在较长停滞时间的用水建筑龙头水(主要为暑假中的中、小学,样品数n=32)和正常用水建筑中龙头水DBPs的浓度水平(n=15)。
结果表明长停滞时间龙头水(龙头未使用时间>50 d)样品余氯浓度为0.04 ± 0.03 mg·L-1,低于正常使用龙头的平均浓度(0.11 ± 0.08 mg·L-1,P<0.05)。有研究比较了滞留24 h前后龙头水中余氯,发现滞留前余氯为0.42 mg·L-1,滞留后降至0.28 mg·L-1,与本文消毒剂变化趋势一致[38]。就DBPs分布特征,大部分DBPs在长停滞时间龙头和正常使用龙头两组样品中浓度水平相当。但长停滞时间龙头水中BDCM、DCAN以及 DCAA和CDBAA浓度分别显著低于正常使用龙头水(P<0.05)。这可能与长停滞时间龙头水中余氯浓度较低,以及生成的DBPs发生分解有关。
在合肥市科学岛自来水的检测中发现,自来水在水管内存储时间越长,卤代烃类DBPs浓度越低[39]。对上海市二供系统的调研中也发现,二供水BDCM平均值为6.43μg·L-1,低于管网水平均值[40]。理论上,HANs的稳定性随着分子中溴原子数量的增加而增加,因此DCAN比其他溴代HANs更容易分解[41];且本文中DCAN浓度较高,其浓度明显下降过程更容易显现。相反,HAAs不易自分解[35],DCAA和CDBAA的降低可能与管网微生物引发的生物降解过程有关[42]。
3.5 DBPs浓度的影响因素
在SH-NH₂Cl系统中,HAAs与消毒剂浓度成正相关(P<0.05)。Hong等人的研究也发现,在反应温度为20℃、反应时间为24 h的情况下,HAAs浓度随消毒剂剂量增加呈上升趋势[43]。WJ-Cl2和SZ-ClO2系统中消毒剂浓度与HANs存在相关性(rWJ-Cl₂= 0.29,rSZ-ClO₂= 0.47,P<0.05)。前人在以氯为消毒剂的长三角地区HAAs形成因子的多元回归模型研究中也发现氯消毒剂与HAAs的正相关性,相关系数为0.800[29]。
DBPs和其他理化参数的相关性分析见图3。
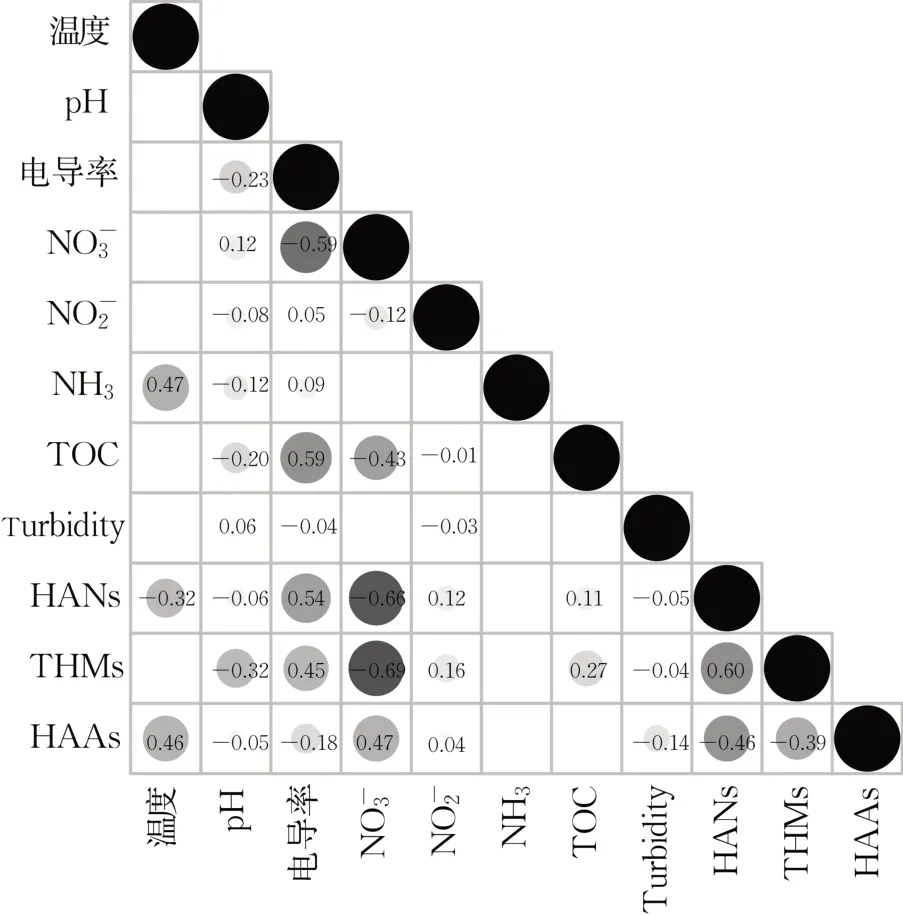
图3 供水管网中水质参数与DBPs的相关性分析(P<0.05)Fig.3 Correlation analysis of water quality index and DBPs in drinking water distribution systems(P<0.05)
结果表明: HAAs的形成与温度成正相关(r=0.46)。温度升高,分子运动加快反应速率提升,一定程度有利于DPBs的生成。对长三角部分水源水消毒后HAAs形成影响因素研究也表明,HAAs的形成与温度成正相关[44]。然而,温度高的情况下DPBs的分解速率也可能加快,尤其是对于热不稳定的DPBs。
例如,研究发现HANs与温度成负相关(r=-0.32,P<0.05),可能与较高的温度下HANs的分解有关[45]。研究中THMs与pH成负相关(r=-0.32,P<0.05)。pH对THMs的影响是一个复杂的过程,pH可决定主要的反应途径和各种消毒剂的形态,从而影响THMs生成量和种类[46]。THMs、HANs和电导率成正相关性(r=0.45~0.54,P<0.05),高电导率的水可能含有更多的溶解性无机盐类[47],尤其是氯化物等含有氯离子的盐类,从而增加了THMs和HANs的形成潜力。
4 结论
本文调查了采用不同类型二次消毒剂的4个供水管网(SH-NH₂Cl、SZ-Cl2、SZ-ClO2和WJCl2)中的4种THMs、9种HAAs、4种HANs的分布特征和影响因素。结果表明,以氯为消毒剂的供水系统水样中THMs浓度远高于使用氯胺和二氧化氯的系统;WJ- Cl2系统HANs浓度较高;而HAAs在以氯胺为消毒剂的SH- NH₂Cl 系统最高。
结果表明,不同供水管网DPBs的发生规律存在差异,不同类型二次消毒剂的使用以及原水水质可能带来不同的DPBs生成风险。
在SH-NH₂Cl系统中,消毒剂浓度与距离成反比,氨氮浓度沿程减少,硝酸盐和亚硝酸盐沿程增加,这可能与管网中硝化反应有关。WJ-Cl2系统中HANs浓度随输配距离的增加而减少,而HAAs浓度沿程增加,这可能与管网中余氯降解、微生物活性以及DBPs本身稳定性有关。此外,龙头水和长停滞时间水样中易出现浊度超标消毒剂浓度不足的情况。为保证管网末梢余氯达标,应考虑提高消毒剂投加或管网水补氯。
相关性分析表明,DBPs浓度受温度、pH、硝酸盐浓度、消毒剂种类和浓度等多种因素影响。为了确保饮用水安全,需要进一步解析DBPs生成的机制和影响因素。同时,采取切实有效的措施,包括提升源头水水质、选择合适的消毒剂、控制消毒剂投加量、关注管网的运行状况、并定期监测管网末梢以及长时间不使用建筑的水质,有效减少DBPs的生成和暴露风险,保障公众健康。
作者贡献声明:
王虹:论文的构思者与负责人,指导实验开展、论文修改。
於文萱:负责试验设计与实施,完成数据分析与初稿写作;
胡宇星:负责试验设计与实施;
蔡栩丞:参与试验结果分析与论文修改;
庞维海:参与试验设计与论文修改。

