人工合成多肽cSN50.1对肝癌细胞HepG2恶性行为的影响及其机制
辛华, 单洪超, 栾海艳, 阮洋, 杨鑫妍
1 佳木斯大学附属第一医院, 黑龙江 佳木斯 154007; 2 佳木斯大学基础医学院, 黑龙江 佳木斯 154007; 3 佳木斯中心医院, 黑龙江 佳木斯 154002
肝癌是全球第六大最常见的恶性肿瘤,每年新发病人数超过85万,其发生率逐年升高,呈增长态势,且在癌症相关死因中排名第二位[1-3]。肝癌的发病是一个多因素多阶段的过程,虽然目前关于肝癌发生发展的研究较多,但对于理解其机制仍是冰山一角。炎症是癌症的危险因素之一。越来越多的流行病学和实验证据表明,炎症在促进肝癌恶性进展和转移方面起着重要作用[4]。肿瘤微环境中产生的促炎细胞因子在癌症相关炎症中也起着关键作用,并促进癌症的侵袭和迁移[5]。
cSN50.1是一种人工合成的多肽,能够通过抑制核转录因子的入核转运来调节下游靶基因的表达,与癌症、病毒性疾病和神经退行性疾病的发病机制有关[6-7]。研究发现,cSN50.1能够减少肝脏中应激反应转录因子(SRTF)、激活蛋白-1(AP-1)、核转录因子-κB(NF-κB)和转录激活因子-1(STAT-1)的入核转运,抑制败血症相关代谢对肝脏的损伤,cSN50.1还能改善血液、脾脏和肺的细菌清除率,抑制血浆中促炎细胞因子和趋化因子的产生[8]。本文旨在研究cSN50.1通过AP-1和NF-κB信号通路来影响趋化因子5(CXCL5)和肿瘤坏死因子α(TNF-α)的表达,进而影响肝癌细胞HepG2的恶性行为。
1 材料与方法
1.1 细胞与材料 肝癌细胞HepG2来源于中国启达生物有限公司;细胞培养所用相关试剂均来源于美国HyClone有限公司、大连美仑生物技术有限公司和中国碧云天生物技术有限公司;电化学发光显影液、兔抗人β-actin多克隆抗体、兔抗人Histone3多克隆抗体、兔抗人CXCL5多克隆抗体、兔抗人c-Jun多克隆抗体和兔抗人NF-κB多克隆抗体均来源于美国Affinity Biosciences有限公司;鼠抗人TNF-α单克隆抗体来源于美国Proteintech Group,Inc有限公司;辣根过氧化物酶(HRP)标记山羊抗兔二抗和HRP标记山羊抗鼠二抗均来源于中国博士德生物工程有限公司;蛋白免疫印迹及蛋白提取所用相关试剂均来源于中国碧云天生物技术有限公司和中国博士德生物工程有限公司;反转录-聚合酶链反应(RT-PCR)所用相关试剂以及CXCL5和TNF-α引物均来源于中国生工生物工程有限公司;SP600125(AP-1信号通路抑制剂)来源于大连美仑生物技术有限公司;PDTC(NF-κB信号通路抑制剂)来源于中国碧云天生物技术有限公司;cSN50.1多肽由中国吉尔生化有限公司合成。
1.2 方法
1.2.1 细胞培养 肝癌细胞HepG2采用含10%胎牛血清和1%青-链霉素双抗(100×)的RPMI1640培养液并置于37 ℃、5% CO2的培养箱中进行培养,当细胞生长至密度70%~80%时,用胰蛋白酶消化,按1∶3进行传代培养。
1.2.2 CCK-8实验 将处于对数生长期的肝癌细胞HepG2用胰蛋白酶消化,培养液重悬,按照每孔100 µL接种于96孔细胞培养板中,细胞数控制在104个/孔。在恒温培养箱中培养6 h,使细胞完全贴壁,将细胞随机分为6组,分别为0、10、30、50、70、90 µmol/L cSN50.1组,每组各6个复孔。丢弃旧液,在每个孔内加入不同浓度cSN50.1的培养液,培养至24 h后。在每个孔中加入10 µL CCK-8溶液,轻轻混匀,然后将孔板放入恒温培养箱中培养4 h,用全自动酶标仪测定每个孔在450 nm波长处的光密度值(OD值)。根据OD值计算各组细胞存活率和抑制率。增殖抑制率达50%的浓度为IC50浓度,并选取低于IC50的浓度为工作浓度。计算公式:细胞存活率=[(As-Ab)/(Ac-Ab)]×100%,抑制率=[(Ac-As)/(Ac-Ab)]×100%。As:实验孔吸光度(含细胞、培养基、CCK-8溶液和药物溶液),Ab:空白孔吸光度(含细胞、培养基、CCK-8溶液,不含药物),Ac:对照孔吸光度(含培养基、CCK-8溶液,不含细胞、药物)。
1.2.3 划痕实验 将对数生长期肝癌细胞HepG2接种在6孔细胞培养板中,细胞数控制在5×105个/孔。培养至细胞紧密贴壁,将细胞随机分为4组:0、10、30、50 µmol/L组,每组各3个复孔。10 µL液移枪头经高压灭菌处理后,在6孔细胞培养板内制作划痕,PBS将脱落细胞冲洗干净,在倒置显微镜下拍照记录。细胞划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/24 h划痕宽度×100%。
1.2.4 Transwell实验 将Matrigel按1∶8的比例用不含FBS的RPMI 1640培养液稀释,取50 µL铺满Transwell小室上室的底部膜,并在培养箱中孵育5 h,形成基质屏障膜。选取生长状态良好的HepG2细胞,经消化离心后,接种于Transwell小室上室,上室为200 µL含不同浓度cSN50.1(0、10、30、50 µmol/L)无FBS的培养液,细胞数控制在2×104个/孔,每组3个复孔,下室为600 µL含20% FBS的完全培养液,培养24 h,取出Transwell小室,用PBS清洗2次,加入4%多聚甲醛固定30 min,再用1%结晶紫染色20 min,用棉签仔细擦除上室未过膜的细胞,在倒置显微镜下拍照,计数过膜细胞的数量。
1.2.5 细胞克隆实验 选取生长状态良好的HepG2细胞,消化离心后,接种于6孔细胞培养板中,细胞数控制在800个/孔,分别采用含0、10、30、50 µmol/L cSN50.1的完全培养液进行培养,在含5%CO2、37 ℃培养箱中培养10天,定期观察细胞状态,及时更换新鲜培养液保证细胞营养。观察到细胞成团后,PBS清洗两次,每次于摇床匀速清洗5 min,然后用4%多聚甲醛固定30 min后,再用1%的结晶紫染色20 min,清洗后扣干,取图计数。
1.2.6 RT-PCR实验 (1)AP-1信号通路在cSN50.1对肝癌细胞HepG2作用中的影响:将肝癌细胞HepG2分为Control组、SP600125组和cSN50.1组。Control组采用正常的完全培养液进行培养,SP600125组采用含20 µmol/L的SP600125的完全培养液进行培养,cSN50.1组采用含50 µmol/L的cSN50.1的完全培养液进行培养(剂量由前述实验结果确定),培养24 h后,采用RTPCR实验检测各组HepG2细胞中CXCL5和TNF-α mRNA的表达情况。(2)NF-κB信号通路在cSN50.1对肝癌细胞HepG2作用中的影响:将肝癌细胞HepG2分为Control组、PDTC组和cSN50.1组。Control组和cSN50.1组培养条件同上,PDTC组采用含100 µmol/L的PDTC的完全培养液进行培养,培养24 h后,采用RTPCR实验检测各组HepG2细胞中CXCL5和TNF-α mRNA的表达情况。用Trizol试剂提取各组细胞中总RNA。将细胞中RNA均逆转录为cDNA,进行扩增。引物序列:CXCL5上游5'-TCCTTCGAGCTCCTTGTGCG-3',下游5'-TCCTTGTTTCCACCGTCCAAAATTT-3';TNF上游5'-TGCTCCTCACCCACACCATCAG-3',下游5'-TCCCAAAGTAGACCTGCCCAGAC-3';βactin上游5'-CCTGGCACCCAGCACAAT-3',下游5'-GGGCCGGACTCGTCATAC-3'。取5 µL PCR扩增产物进行琼脂糖凝胶电泳;电泳结束后将凝胶置于0.5 µg/mL溴化乙锭水溶液中,室温环境下染色20 min;用自来水冲洗后,于凝胶成像分析系统下拍摄并分析,采用image J软件进行灰度值分析。结果以目的基因与β-actin灰度值的比值来表示其相对含量。
1.2.7 Western Blot实验 (1)AP-1信号通路在cSN50.1对肝癌细胞HepG2作用中的影响:分组以及培养条件同RT-PCR,采用Western Blot实验检测各组HepG2细胞中CXCL5和TNF-α蛋白表达情况以及细胞质和细胞核中c-Jun蛋白的表达情况。(2)NF-κB信号通路在cSN50.1对肝癌细胞HepG2作用中的影响:分组以及培养条件同RT-PCR,采用Western Blot印迹实验检测各组HepG2细胞中CXCL5和TNF-α蛋白表达情况以及细胞质和细胞核中NF-κB蛋白的表达情况。采用含1 mmol/L PMSF的RIPA裂解液分别提取各组HepG2细胞总蛋白后用于检测CXCL5和TNF-α蛋白表达情况;采用亚细胞结构细胞核与细胞质蛋白抽提试剂盒,分别提取各组HepG2细胞的细胞质和细胞核蛋白用于检测c-Jun和NF-κB蛋白的表达情况。用BCA法测定提取的蛋白质浓度,95 ℃加热5 min使蛋白质变性。采用12%分离胶进行十二烷基硫酸钠和聚丙烯酰胺凝胶电泳,按照每孔蛋白质20 µg上样,200 mA恒流湿旋转,4 ℃孵育过夜。次日用TBST洗液洗膜3次,用相应的二抗在室温下孵育1 h,然后再用TBST洗膜3次,电化学发光显影,采用凝胶成像分析系统曝光、拍摄和分析,采用Tanon Gel Image System软件进行灰度值分析。细胞中CXCL5、TNF-α蛋白和细胞质c-Jun、NF-κB蛋白的表达结果以目的蛋白与β-actin灰度值的比值来表示其相对含量,细胞核c-Jun、NF-κB蛋白的表达结果以目的蛋白与Histone灰度值比值来表示其相对含量。
1.2.8 统计学方法 采用 Graphpad Prism 8.0对所有数据进行整理和绘制分析,采用统计软件SPSS 26.0进行数据分析,计量资料采用表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 cSN50.1对肝癌细胞HepG2增殖的影响 与0 µmol/L组相比,10和30 µmol/L组对HepG2细胞无明显抑制作用(P>0.05),50、70和90 µmol/L组对HepG2细胞有显著的抑制作用(P<0.01),但70和90 µmol/L组的细胞存活率低于50%(图1)。
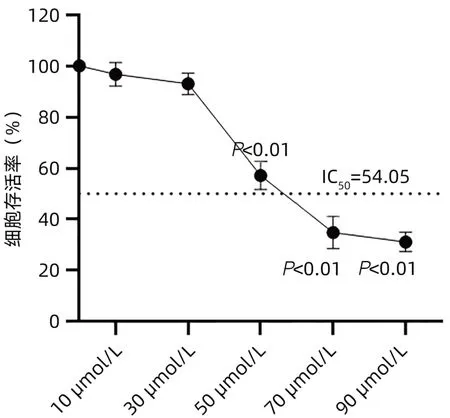
图1 cSN50.1对肝癌细胞HepG2增殖的影响Figure 1 Effect of cSN50.1 on hepatoma cell HepG2 proliferation
2.2 cSN50.1对肝癌细胞HepG2迁移能力的影响与0 µmol/L组相比,10 µmol/L组的划痕愈合率无明显变化(P>0.05),30、50 µmol/L组的划痕愈合率明显降低(P值均<0.05)(图2)。
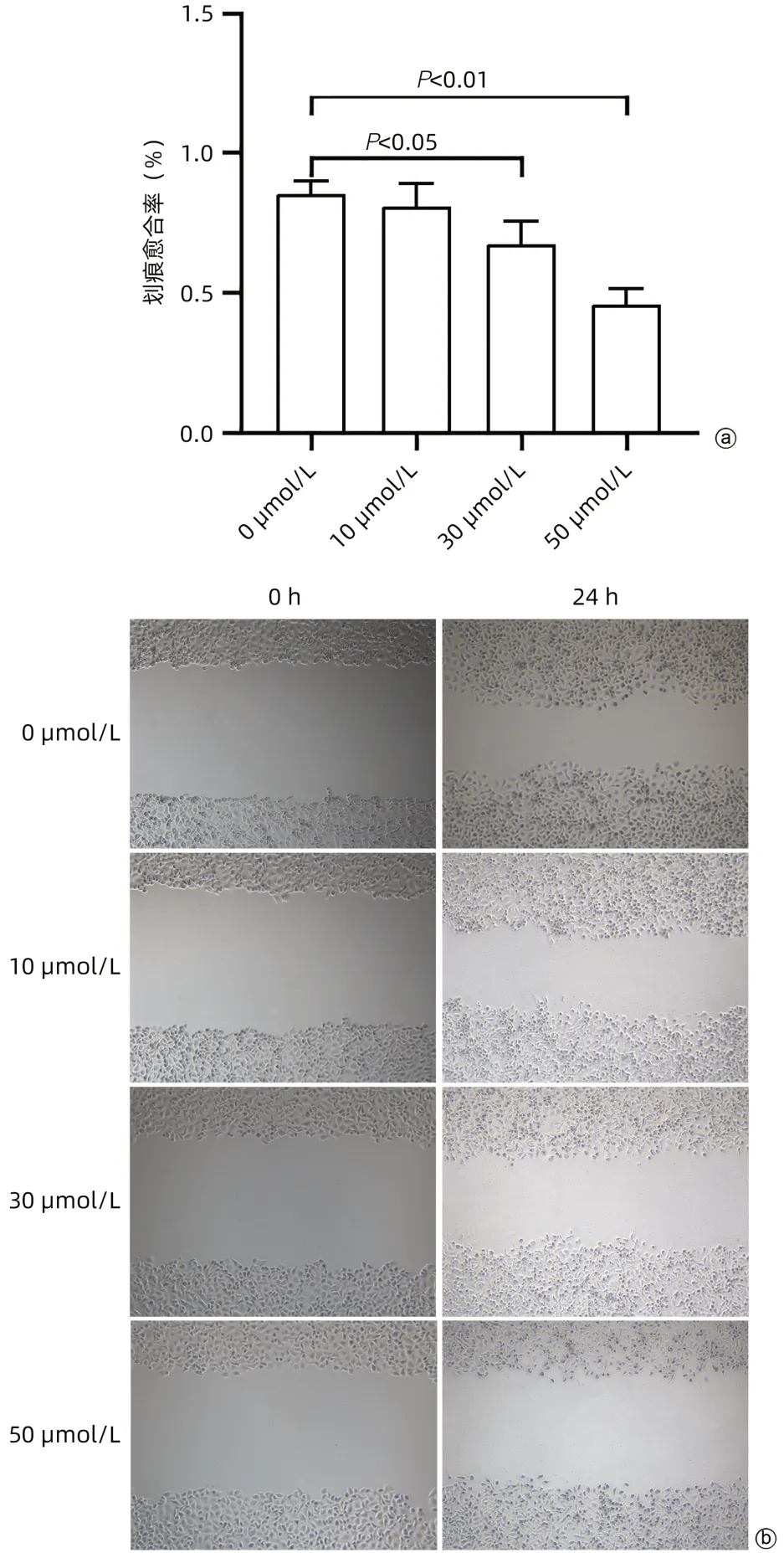
图2 cSN50.1对肝癌细胞HepG2迁移能力的影响Figure 2 Effects of cSN50.1 on the migration ability of hepatocellular carcinoma cells HepG2
2.3 cSN50.1对肝癌细胞HepG2侵袭能力的影响与0 µmol/L组相比,10 µmol/L组的下室侵袭细胞数量无明显变化(P>0.05),而30、50 µmol/L组的下室侵袭细胞数量均显著减少(P值均<0.01)(图3)。
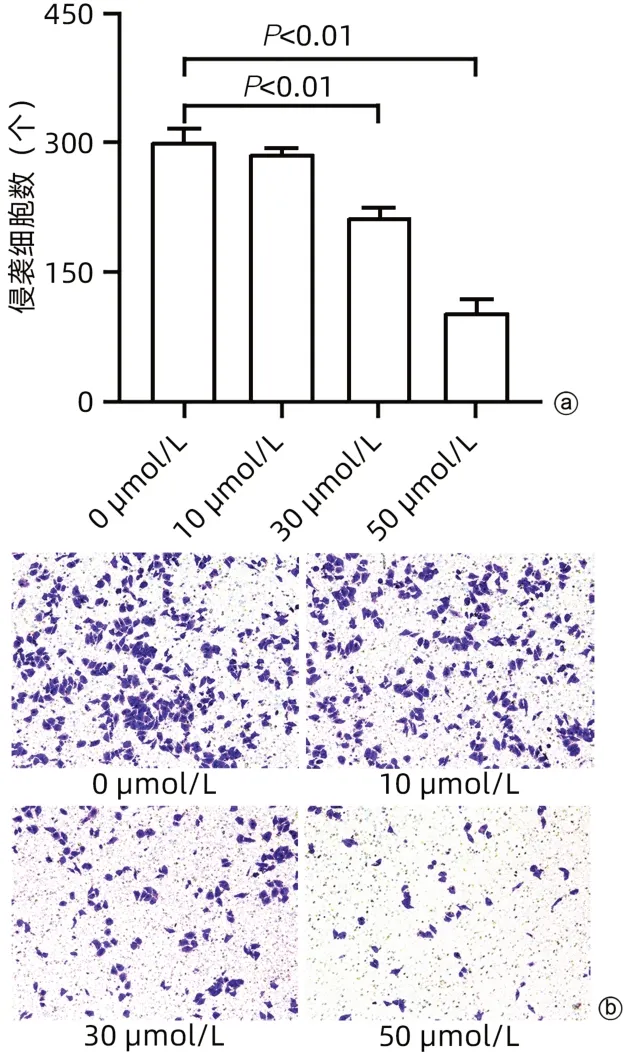
图3 cSN50.1对肝癌细胞HepG2侵袭能力的影响Figure 3 Effect of cSN50.1 on invasion ability of hepatoma cells HepG2
2.4 cSN50.1对肝癌细胞HepG2集落形成能力的影响 与0 µmol/L组相比,10 µmol/L组的细胞集落形成能力无明显变化(P>0.05),而30、50 µmol/L组的细胞集落形成能力均显著减弱(P值均<0.01)(图4)。
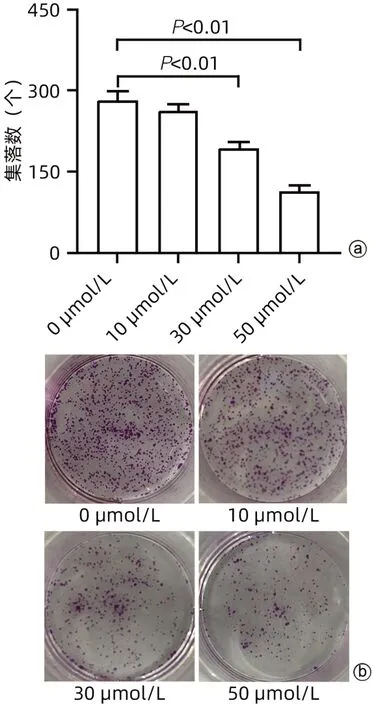
图4 cSN50.1对肝癌细胞HepG2集落形成能力的影响Figure 4 Effect of cSN50.1 on colony formation ability of hepatocellular carcinoma cells HepG2
2.5 AP-1信号通路在cSN50.1对肝癌细胞HepG2作用中的影响
2.5.1 cSN50.1对肝癌细胞HepG2中炎症因子CXCL5和TNF-α表达的影响 与Control组相比,SP600125组和cSN50.1组中CXCL5和TNF-α mRNA的表达均明显降低(P值均<0.05)(图5a、b)。与Control组相比,SP600125组和cSN50.1组中CXCL5和TNF-α蛋白的表达均明显降低(P值均<0.05)(图5c、d)。
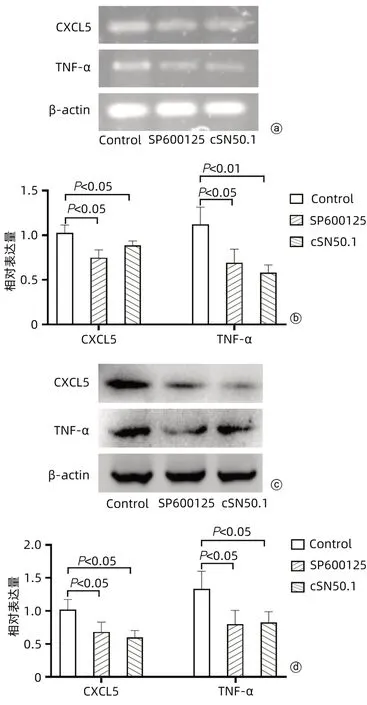
图5 cSN50.1对各组细胞中CXCL5和TNF-α表达的影响Figure 5 Effects of cSN50.1 on the expression of CXCL5 and TNF-α in each group
2.5.2 cSN50.1对肝癌细胞HepG2中通路蛋白c-Jun表达的影响 与Control组相比,SP600125组细胞质中c-Jun蛋白的表达明显降低(P<0.05),cSN50.1组细胞质中c-Jun蛋白的表达则明显增高(P<0.05)(图6a、b);与Control组相比,SP600125组和cSN50.1组细胞核中c-Jun蛋白的表达均明显降低(P值均<0.01)(图6c、d)。
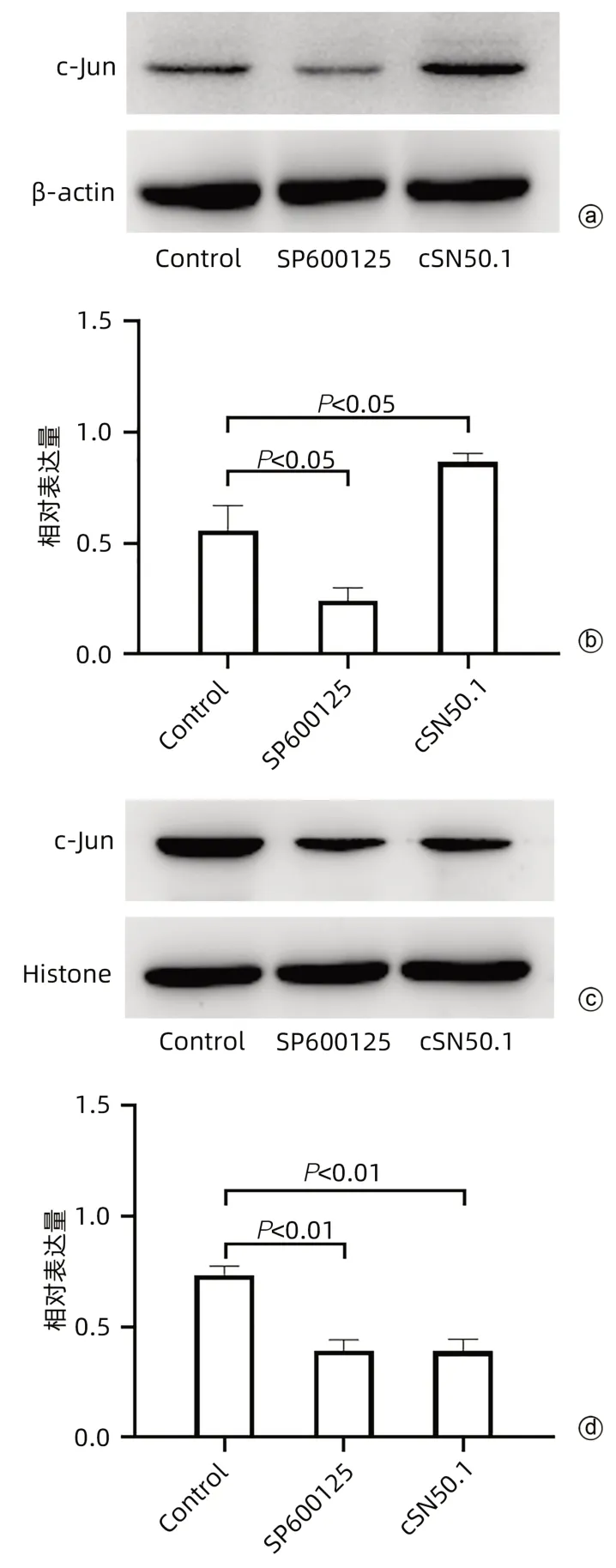
图6 cSN50.1对各组细胞质和细胞核中c-Jun蛋白表达的影响Figure 6 Effects of cSN50.1 on the expression of c-Jun protein in cytoplasm and nucleus of each group of cells
2.6 NF-κB信号通路在cSN50.1对肝癌细胞HepG2作用中的影响
2.6.1 cSN50.1对肝癌细胞HepG2中炎症因子CXCL5和TNF-α表达的影响 与Control组相比,PDTC组和cSN50.1组的CXCL5和TNF-α mRNA的表达均明显降低(P值均<0.05)(图7a、b)。与Control组相比,PDTC组和cSN50.1组中CXCL5和TNF-α蛋白的表达均明显降低(P值均<0.05)(图7c、d)。
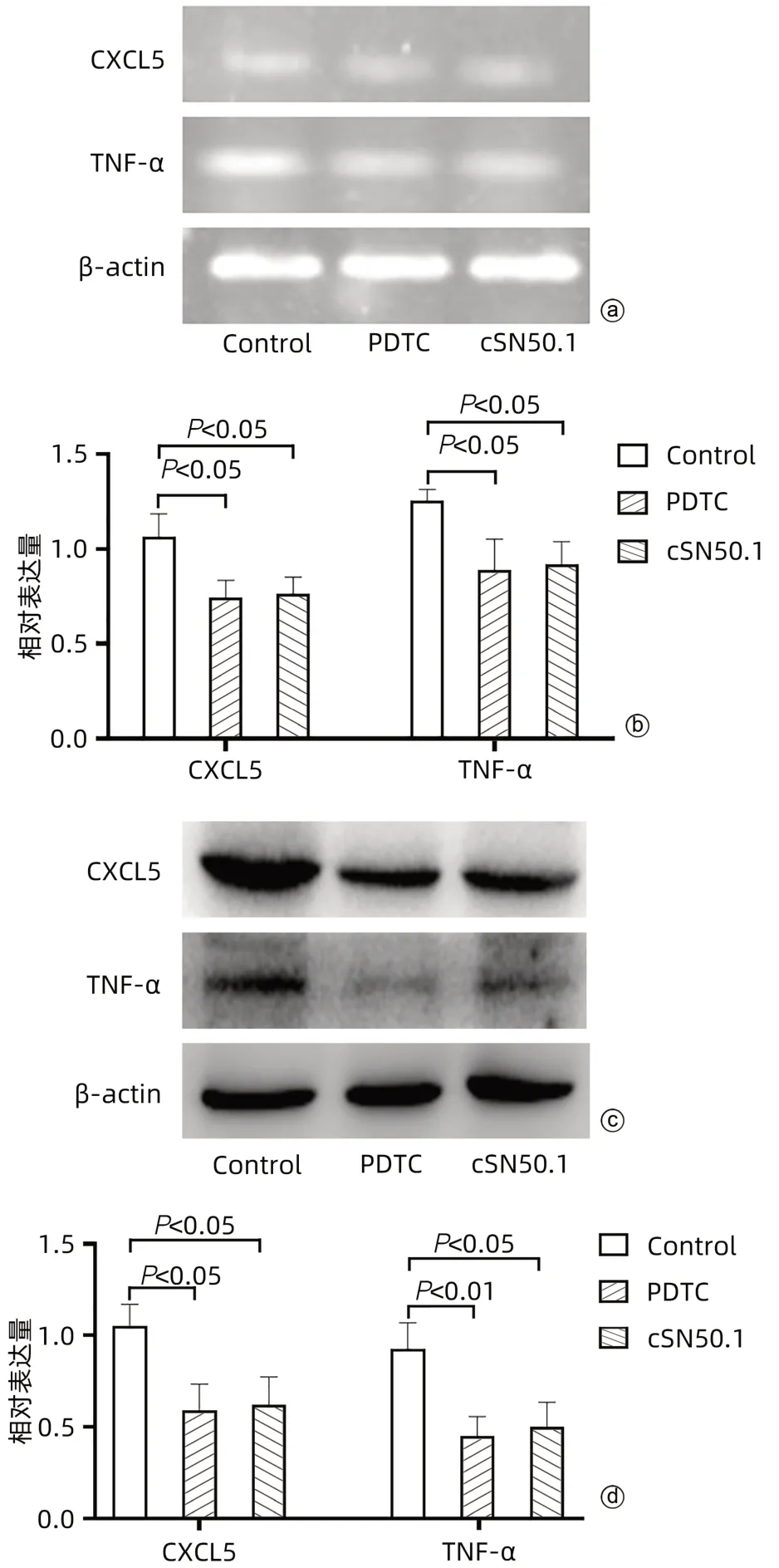
图7 cSN50.1对各组细胞中CXCL5和TNF-α表达的影响Figure 7 Effects of cSN50.1 on the expression of CXCL5 and TNF-α in each group
2.6.2 cSN50.1对肝癌细胞HepG2中通路NF-κB蛋白表达的影响 与Control组相比,PDTC组细胞质中NF-κB蛋白的表达明显降低(P<0.05),而cSN50.1组细胞质中NF-κB蛋白的表达明显增高(P<0.05)(图8a、b);与Control组相比,PDTC组和cSN50.1组细胞核中NF-κB蛋白的表达均明显降低(P值均<0.05)(图8c、d)。
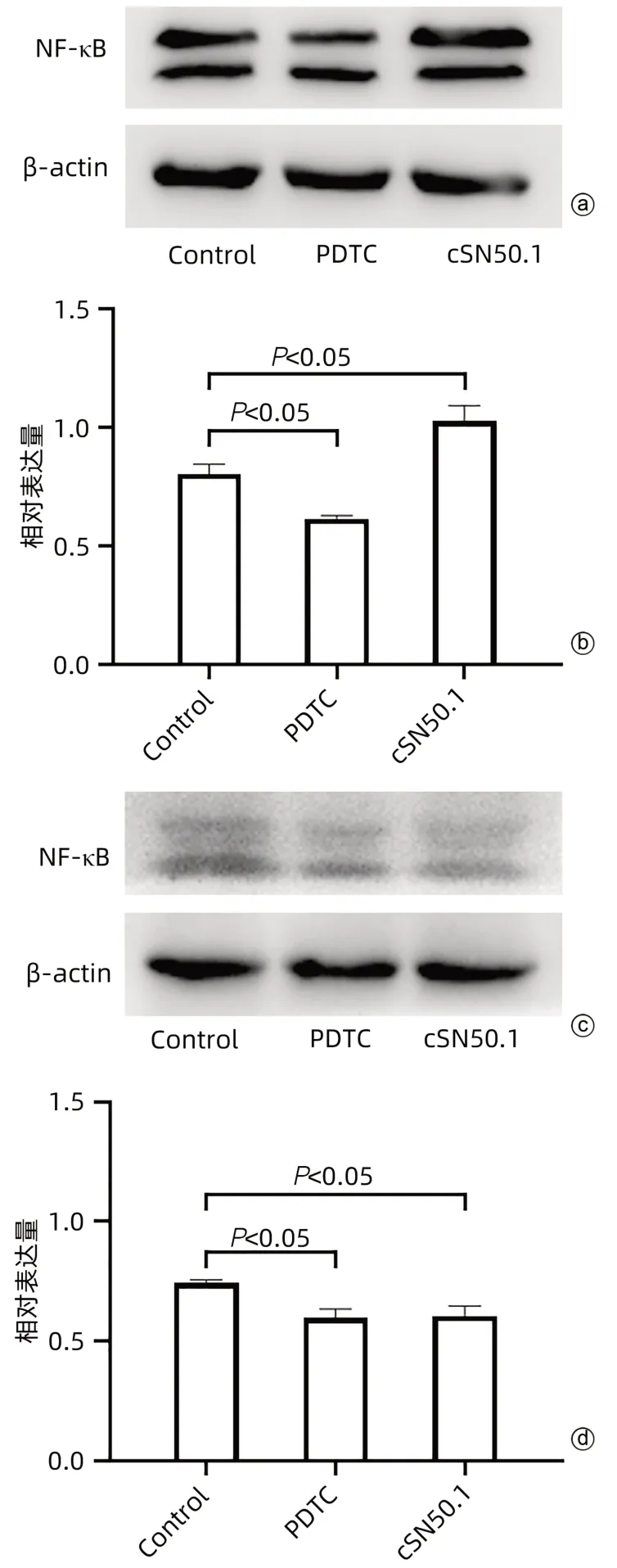
图8 cSN50.1对各组细胞质和细胞核中NF-κB蛋白表达的影响Figure 8 Effect of cSN50.1 on the expression of NF-κB protein in cytoplasm and nucleus of cells of each group
3 讨论
慢性炎症是肿瘤微环境特征的核心因素。炎症因子是肿瘤组织局部微环境的重要组成,它们在炎症与肿瘤相互关系中起着重要作用[9]。炎性因子的长期产生和积累可在肿瘤微环境中发挥局部和全身免疫抑制作用[10-11]。随着肿瘤相关性炎症方面的深入研究,以药物治疗肿瘤相关炎症已经成为癌症的可行性治疗策略。因此,需要进行进一步的研究,以提高对肿瘤相关性炎症的理解,制订个性化治疗策略,使肝癌不同阶段患者的疗效达到最佳,副作用降至最低[11-15]。
研究表明,cSN50.1可以抑制多种促炎mRNA的表达,维持正常的血小板计数,减少微血管损伤的血浆标志物以及肝脏的中性粒细胞浸润。并且cSN50.1能够减少肝脏中SRTF、AP-1、NF-κB和STAT-1的入核转运,抑制败血症相关代谢对肝脏的损伤,并改善动脉粥样硬化和脂肪性肝炎[16-17]。鉴于cSN50.1具有较好的抗炎作用,且其对肝癌的影响尚未见报道。因此,本文分别采用了CCK-8、细胞划痕、Transwell实验和细胞克隆实验检测了不同浓度cSN50.1对肝癌细胞HepG2的增殖、迁移、侵袭和集落形成能力的影响。结果表明,一定水平的cSN50.1可以抑制HepG2细胞的增殖、迁移、侵袭和集落形成能力,认为cSN50.1具有抑制肝癌细胞HepG2恶性行为的作用。
CXCL5是一种主要在上皮细胞上表达的CXC趋化因子[18-20]。它对CXCR2受体具有特异性,并参与中性粒细胞的募集和活化。CXCL5被认为是肝癌的治疗靶点,CXCL5可促进肝癌的肿瘤增殖、生长、迁移、侵袭、转移和肿瘤内中性粒细胞浸润[21-23]。研究[24-25]表明,使用抑制剂SCH772984和SP600125分别抑制ERK和AP-1信号通路后,肝癌细胞增殖、迁移和侵袭能力也受到了抑制。有学者[26-27]发现,乌司他丁联合索拉非尼可以通过抑制NF-κB信号通路,降低TNF-α在肝癌细胞中的表达。因此,通过抑制AP-1和NF-κB活性来降低CXCL5和TNF-α已被考虑用于寻找有效治疗癌症的药物。
鉴于炎症因子CXCL5和TNF-α在慢性炎症诱导的肿瘤发生和发展中起着非常重要的作用,本文又采用RT-PCR和Western Blot技术研究了cSN50.1对肝癌细胞HepG2中CXCL5和TNF-α的影响作用,以及这种影响是否是通过调控NF-κB和AP-1信号转导途径实现的。研究结果表明,cSN50.1能够下调肝癌细胞HepG2中CXCL5和TNF-α mRNA和蛋白的表达,并能够增加细胞质中c-Jun和NF-κB的表达,减少细胞核中c-Jun和NF-κB的表达,因此,认为cSN50.1可以通过抑制肝癌细胞HepG2中c-Jun和NF-κB的入核转运来降低CXCL5和TNF-α的表达,进而抑制肝癌细胞HepG2的恶性行为。cSN50.1多肽的靶向治疗作为一种新型的抗癌药物具有开发潜力,值得进一步研究,为临床治疗肝癌的指导用药提供了理论和实验依据。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:辛华、栾海艳负责课题设计,资料分析,撰写论文;单洪超参与收集数据,修改论文;阮洋、杨鑫妍负责拟定写作思路,指导撰写文章并最后定稿。

