基于胆汁酸代谢组学探讨复方大黄煎剂保留灌肠对轻微型肝性脑病大鼠模型的治疗作用
杜沅沁, 王萌, 黄国初, 姚春, 钟瑞熙, 黄良江, 徐健, 黄晶晶, 谭钦文,毛德文
1 广西中医药大学研究生院, 南宁 530000; 2 广西中医药大学第一附属医院脾胃科, 南宁 530023
肝性脑病(HE)是一种常见且公认的肝病神经精神综合征,其特征是在没有其他已知脑部疾病的情况下出现一系列神经精神症状[1]。临床上,患有肝病且出现上述严重症状的患者可诊断为显性HE。然而,30%~70%的肝硬化患者没有表现出任何临床上明显的脑功能障碍症状,但在神经心理、生理测试或脑电图中取得了异常结果[2]。仅表现为轻度症状包括认知和注意力缺陷、反应迟钝、记忆减退以及视觉运动协调障碍,这种情况定义为轻微型肝性脑病(MHE)[3],是进展为显性HE的高危风险因素,无疑将增加此类患者的救治难度与死亡风险[4]。因此,通过对MHE发病机制的深入了解,MHE的诊断和预防对于降低HE的发病率和病死率变得越来越重要。MHE发病机制迄今尚未阐明。一般认为MHE是显性HE的特殊类型,属HE的早期阶段,其机制与显性HE一致,只在程度存在差别。氨中毒学说是最早提出且证据最多的发病机制假说,氨代谢紊乱引起氨中毒可触发神经元凋亡级联反应[5]。损害颅内血流的自动调节功能[6],直接影响脑部神经生理功能。除此之外尚有γ-氨基丁酸神经递质与假性神经递质学说,二者均可产生中枢抑制效应,表现出神经功能异常变化[7-8]。最近一项研究[9]表明,脑内胆固醇蓄积是通过胆汁酸(bile acid,BA)介导的法尼醇X受体(farnesoid X receptor,FXR)作用促进MHE进展的一个因素。
中医药由于其独特的理论体系、指导方针和用药方法,在治疗和预防疾病中发挥着重要的作用[10]。肠道微生物群通过生物转化或与中药的某些生物活性成分发生反应,以促进药物吸收[11]。而肠道菌群的改变对BA代谢至关重要。大黄煎剂被列入《慢加急性肝衰竭中西医结合诊疗专家共识》1A级别证据,强烈推荐用于肝硬化并发HE[12]。大黄煎剂保留灌肠治疗MHE可有效降低内毒素及血氨水平,改善肝功能[13]。有研究指出在MHE患者血液中发现多种BA升高[14],但是经过大黄煎剂保留灌肠治疗后的MHE患者血清中多种BA发生了变化[15]。然而,大黄煎剂调控血清中BA的机制尚未清楚,所以本研究旨在研究大黄煎剂保留灌肠对MHE大鼠BA代谢物的影响。利用代谢组学方法进一步探索防止MHE进展为HE的潜在治疗机制。
1 材料和方法
1.1 化学品和试剂 大黄(产地:甘肃,批号20211103)和乌梅(产地:福建,批号20210914)由广西南宁万宝堂药业提供。CCl4(批号:1601168)购自合肥工业大学化学试剂厂;硫代乙酰胺(TAA)(批号:T70013)购自普西唐生物科技有限公司;甲酸(批号:94318)购自霍尼韦尔公司;甲醇(批号:A452-4)、异丙醇(批号:A461-4)购自费希尔化学公司;38种BA标准品购自Sigma-Aldrich(美国)和Steraloids公司(美国);苏木素-伊红(HE)染色液(批号:DH0006)购自北京雷根生物技术有限公司。
1.2 仪器 Morris水迷宫视频分析系统(北京智鼠多宝生物科技有限责任公司);NX10N快速血氨测定仪(日本Fujifilm公司);7020型全自动生化分析仪(日本Hitach公司);Agilent 2100生物分析仪(美国安捷伦科技公司);5500 QTRAP质谱仪(上海SCIEX分析仪器贸易有限公司);Waters ACQUITY UPLC I-Class系统(美国Waters公司);低温高速离心机(德国eppendorf公司);ACQUITY UPLC BEH C18 1.7 µm,2.1 mm×100 mm column色谱柱(美国Waters公司);FE28型FiveEasy Plus台式pH计(上海屹利科学仪器有限公司)
1.3 实验动物 无特定病原体(SPF)级SD雄性大鼠55只,体质量(180±20) g,购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证编号:SYXK(湘)2019-0001,实验动物使用许可证编号:SCXK(桂)2019-0004。饲养于广西中医药大学SPF级动物实验室内,室温20~24 ℃,相对湿度控制在50%~70%,12 h光照昼夜循环,空气流通,适应性喂养7 d,期间自由饮食饮水。
1.4 分组及干预 55只大鼠运用简单随机分组法分为空白组(NC组)、HE组、MHE组和MHE大黄煎剂治疗组(MHEY组)。各组大鼠进行5 d的水迷宫寻台训练,测试2次后,进行HE及MHE模型大鼠制备。观察各组大鼠体质量、存活率、一般状态,水迷宫检测评估是否成模,成模后各组取10只大鼠。MHEY组给予大黄煎剂溶液连续灌肠14 d,其余各组予同体积蒸馏水灌肠。大黄煎剂的制备:将30 g大黄和30 g乌梅煎制成100 mL溶液,根据“人和动物间按体表面积折算的等效剂量比值表”计算200 g大鼠用量约为70 kg人的0.018,遂计算出每只大鼠的灌胃量为9 mL·kg-1·d-1。
1.5 HE及MHE模型制备 本实验采用CCl4和乙醇构建大鼠肝硬化模型[16]:将CCl4、橄榄油按2∶3比例混合配置成40% CCl4油溶液后于模型大鼠皮下注射,每周2次,持续9周。首周每次注射5 mL/kg,而后每次注射3 mL/kg,期间搭配5%乙醇溶液自饮,NC组普通饮水,每周腹下注射生理盐水2次。之后采用TAA法构建HE大鼠模型、MHE大鼠模型[17-18],用生理盐水配成40 mg/mL TAA溶液。HE组腹腔注射TAA(300 mg/kg),MHE、MHEY组腹腔注射TAA(200 mg/kg),NC组腹腔注射生理盐水(5 mL/kg),每隔48 h腹腔注射,连续注射3次。TAA注射期间动物均饮用生理盐水葡萄糖液(内含100 g/L葡萄糖,0.9 g/L氯化钠,20 mmol/L氯化钾)。根据大鼠HE诊断标准,若大鼠出现嗜睡、反应迟缓,自主性活动减少、共济失调、昏迷等症状之一,即可诊断HE[19]。若出现少许或未出现上述症状,但是血氨及肝功能均明显高于正常组,病理组织学检测提示肝衰竭,且水迷宫检测显示大鼠寻台时间明显延长,穿台次数减少即可诊断MHE。
1.6 Morris水迷宫实验检测大鼠学习记忆能力 将直径为1.5 m的黑色圆形水池[水深30 cm,水温(26±1) ℃]均等分为4个象限,在某一象限设置1个直径10 cm的平台隐匿于水下2 cm处,并在水中添加黑色颜料混匀,水池上方悬挂摄像机。定位巡航训练:共历时5 d,每天定于固定时间段训练4次。训练开始时,从池壁四个起始点的任一点将大鼠面向池壁放入水池。自由录像记录系统记录大鼠找到平台的时间和游泳路径,4次训练将大鼠分别从4个象限放入水中。大鼠找到平台后或60 s内找不到平台(潜伏期记为60 s),则由实验者将其引导到平台,在平台上休息10 s,再进行下一次试验。每日以大鼠4次训练潜伏期的平均值作为大鼠当日的学习成绩。空间探索实验:定位航行实验结束后撤去平台,在原平台相对象限入水点将大鼠放入水中,记录其120 s内游泳路径并统计穿越平台次数。定位巡航实验在造模后及给药后各进行1次,空间探索实验在给药后进行1次。
1.7 样品采集和制备 末次给药后再次进行Morris水迷宫实验。之后按照体质量比给予大鼠腹腔注射等比例的2%戊巴比妥钠(0.03 mL/kg)深度麻醉,开腹在肝脏背面寻得胆管后置管引流胆汁至无菌EP管储存在-80 ℃冰箱用于BA代谢组学分析,在腹主动脉采血行血氨及生化检测;然后对各组大鼠实施安乐死,剪取肝左叶至无菌EP管储存在-80 ℃冰箱用于Western Blot、PCR检测,剪取肝右叶并取脑组织置于4%多聚甲醛中固定用于组织病理学分析,最后收集结肠和肠道内容物至无菌EP管储存在-80 ℃冰箱,用于随后的pH检测。
1.8 血氨、肝生化指标及结肠内容物pH测定 取血后应用快速血氨测定仪检测大鼠全血中氨的含量,应用全自动生化仪检测血清中AST、ALT、ALP、TBil及总胆汁酸(TBA)水平。取大鼠回盲肠后端结肠大约10 cm,采用pH计法检测结肠内容物pH值。
1.9 HE染色 取于4%多聚甲醛中固定24 h后的大鼠肝脏和脑,流水冲洗30 min,然后剪成组织大小约3 mm×2 mm×3 mm,各级酒精梯度脱水,二甲苯三级透明,浸蜡包埋,石蜡切片机切片、黏片及烤片后HE染色并成像。
1.10 BA靶向代谢组学 首先每个胆汁样本稀释100倍,接着各取液体样本100 µL,加入500 µL预冷甲醇及10 µL内标,涡旋混合,-20 ℃孵育20 min沉淀蛋白;4 ℃条件下,14 000×g离心15 min,取上清真空干燥;质谱检测时加入甲醇-水(1∶1,50 µL/50 µL)复溶,4 ℃条件下,14 000×g离心15 min,取上清进样分析。
样品采用Waters ACQUITY UPLC I-Class系统进行分离。流动相:A相为0.1%甲醛水溶液,B相为甲醇。样品置于8 ℃自动进样器中,柱温45 ℃,流速为300 µL/min,进样量2 µL。相关液相梯度如下:0~6 min,B相从60%线性变化到65%;6~13 min,B相从65%线性变化至80%;13~13.5 min,B相从80%线性变化至90%;13.5~15 min,B相维持在90%。样本队列中每间隔一定数量的实验样本设置一个质量控制(quality control,QC)样本,用于检测和评价系统的稳定性及重复性。
采用5500 QTRAP质谱仪(AB SCIEX)在负离子模式下进行质谱分析。5500 QTRAP ESI源条件如下:source temperature: 550 ℃; ion Source Gas1(Gas1):55; Ion Source Gas2 (Gas2): 55; Curtain gas (CUR):40; ionSapary Voltage Floating(ISVF): -4 500 V;采用MRM模式检测待测离子对。采用Multiquant软件提取色谱峰面积及保留时间。采用BA的标准品矫正保留时间,进行代谢物鉴定。为进一步定量筛选差异BA,应用R软件包“mixOmics”建立OPLS-DA模型以提取组间的差异信息。
1.11 统计学方法 使用SPSS 25.0统计软件进行数据分析。计量资料采用表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 大黄煎剂减弱CCl4及TAA诱导的MHE
2.1.1 对大鼠一般状态的影响 HE组大鼠先后出现体质量下降、嗜睡、反应迟缓、各种反射逐渐消失、共济失调、个别出现昏迷现象等。MHE组大鼠部分出现反应迟缓和自主性活动减少,未出现嗜睡、共济失调、昏迷等HE症状。MHEY组大鼠均未见上述症状。
2.1.2 对大鼠寻台潜伏期与穿台次数的影响 大黄煎剂干预后,定位航行训练及空间探索试验检测结果表明,与NC组比较,HE组、MHE组寻台潜伏期(造模后、用药后)显著增加,穿台次数显著减少(P值均<0.05);与MHE组相比,MHEY组寻台潜伏期(用药后)显著降低而穿台次数显著增加,HE组寻台潜伏期显著增加而穿台次数显著减少(P值均<0.05)(表1)。
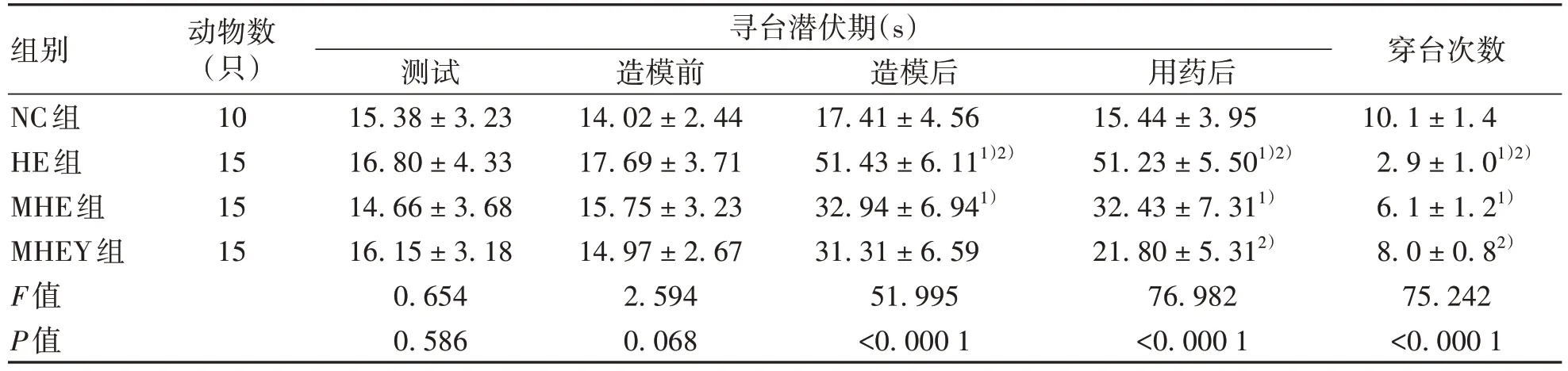
表1 水迷宫数据Table 1 Water maze data
2.1.3 对血氨、肝生化指标及结肠内容物pH值的影响 与NC组比较,HE组和MHE组AST、ALT、ALP、TBil、TBA、血氨及结肠pH值显著增加(P值均<0.05);与MHE组相比,MHEY组AST、ALT、ALP、TBil、TBA及血氨及结肠pH值减少(P值均<0.05),HE组AST、ALT、ALP、TBil、TBA、血氨及结肠pH值增加(P值均<0.05)(表2)。
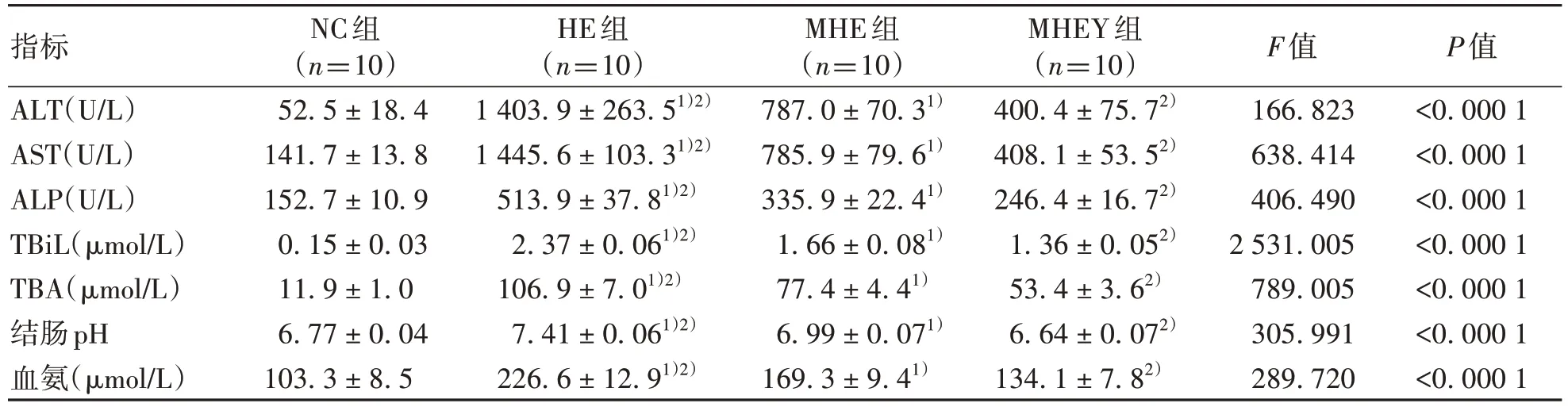
表2 四组间各指标比较Table 2 Comparison of indicators among four groups
2.1.4 大鼠肝组织病理变化 光学显微镜下观察各组大鼠肝组织病理切片(图1)。NC组肝组织中肝小叶结构清晰正常,未见肝细胞炎性细胞浸润、细胞坏死等现象,肝索以中央静脉为中心呈放射状排列。HE组假小叶形成,细胞紊乱,肝细胞水肿变性坏死明显,重度炎症细胞浸润伴纤维组织增生,胆管数量明显增多。MHE组中央静脉周围肝细胞排列紊乱,假小叶形成,肝细胞水肿变性减轻,轻度炎症细胞浸润,胆管数量较HE组减少。MHEY组中央静脉周围肝细胞较整齐,有假小叶形成;肝细胞水肿变性较MHE组明显减轻,重度炎细胞浸润,胆管数量较MHE组减少;整体损伤水平较MHE组减少。
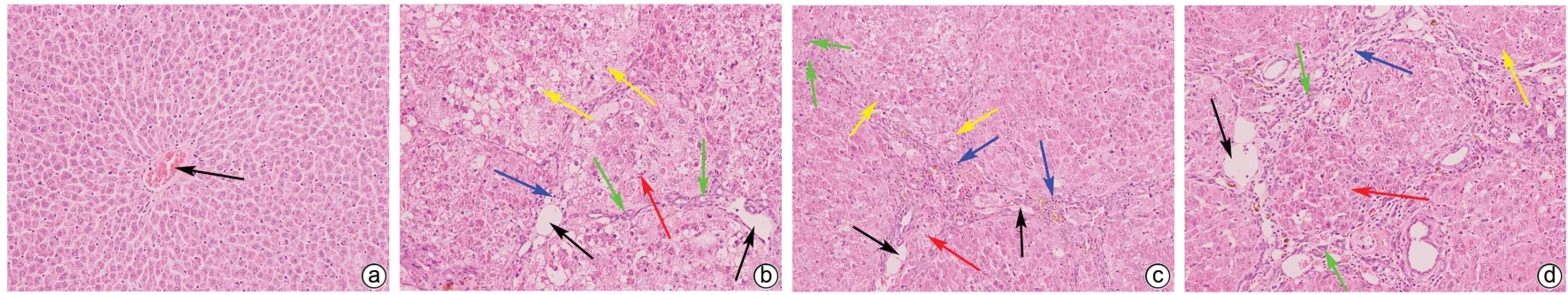
图1 肝组织HE染色(×200)Figure 1 Liver tissue HE staining image(×200)
2.1.5 大鼠脑组织病理变化 NC组脑组织结构正常,排列整齐;HE组神经元坏死严重、结构不完整、排列紊乱、细胞核固缩、胞质减少;与HE组相比,MHE组神经元坏死较轻,MHEY组细胞坏死、排列紊乱、细胞核固缩现象减轻,结构逐渐完整(图2)。
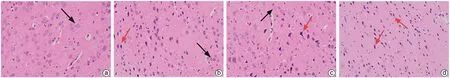
图2 脑组织HE染色(×200)Figure 2 HE staining image of brain tissue (×200)
2.2 BA靶向代谢组学分析
2.2.1 靶向测序结果 对胆汁样本的混样QC样本进行BA靶向代谢组学的质谱定性定量检测分析,共测得BA代谢物23个。对数据的稳定性和重复性进行评价,待测物在QC样本中的RSD结果显示(图3),代谢物RSD均小于30%,说明样本中的分析数据结果稳定可靠。
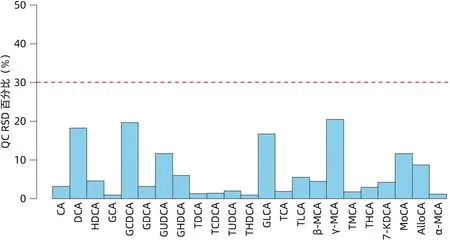
图3 QC RSD百分比图Figure 3 Percentage chart of QC RSD
分别比较各组间大鼠胆汁中BA含量的差异(图4),MHE组TBA、初级BA和次级BA均低于NC组(P值均<0.05);HE组TBA和初级BA低于MHE组(P值均<0.05);MHEY组TBA、初级BA高于MHE组(P值均<0.05)。
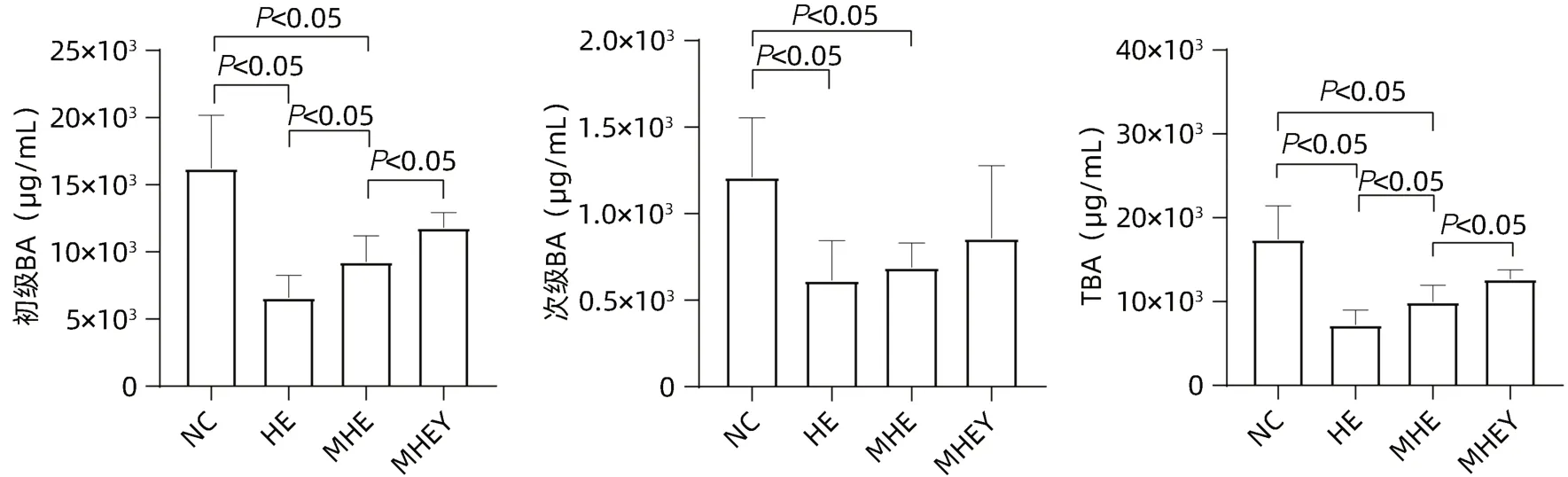
图4 BA统计分析图Figure 4 Statistical analysis of bile acids
2.2.2 PCA分析 PCA显示MHE成模前后大鼠胆汁的BA分别聚集成2个簇集,且经过大黄煎剂治疗前后的MHE大鼠胆汁的BA也分别聚集成2个簇集,提示健康大鼠发生MHE时,其胆汁中的BA发生了明显变化,但经过大黄煎剂治疗后胆汁中的BA也发生了变化。而MHE和HE组大鼠的簇集重合率较高,说明这两组的BA谱相似(图5)。
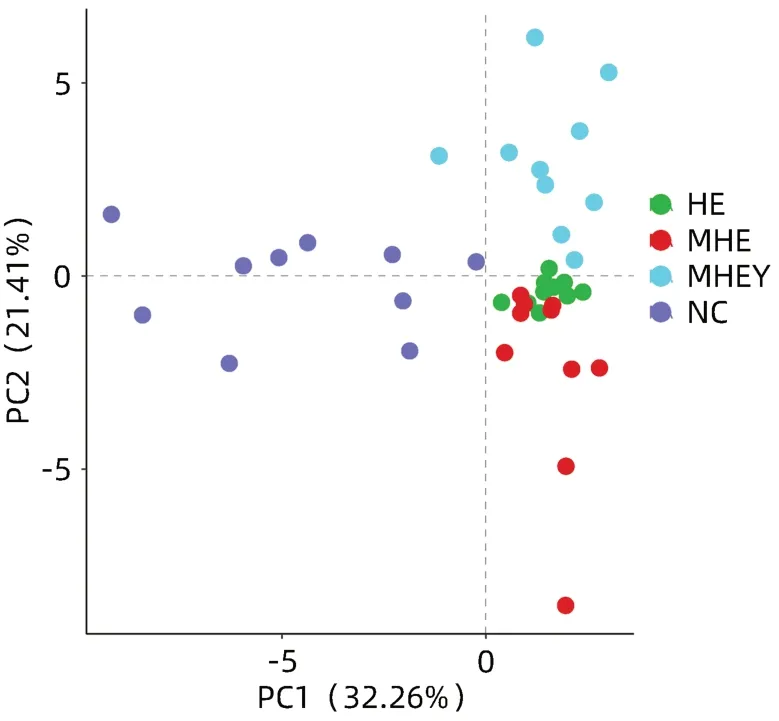
图5 PCA散点图Figure 5 PCA scatter plot
2.2.3 OPLS-DA分析 Scores plot中横坐标表示OSC过程中主成分的得分,代表两组样本间的差异;纵坐标表示OSC过程中正交成分的得分,代表各组内样本间的差异(图6)。MHE组和NC组间分离趋势明显,代表两组间代谢产物差异明显;MHE组和MHEY组存在组间分离趋势,代表两组间代谢产物存在差异;而MHE组和HE组趋势较近,代表两组间代谢产物差异不明显;但四组内数据均不集中,代表组内样本代谢产物均存在一定的差异。
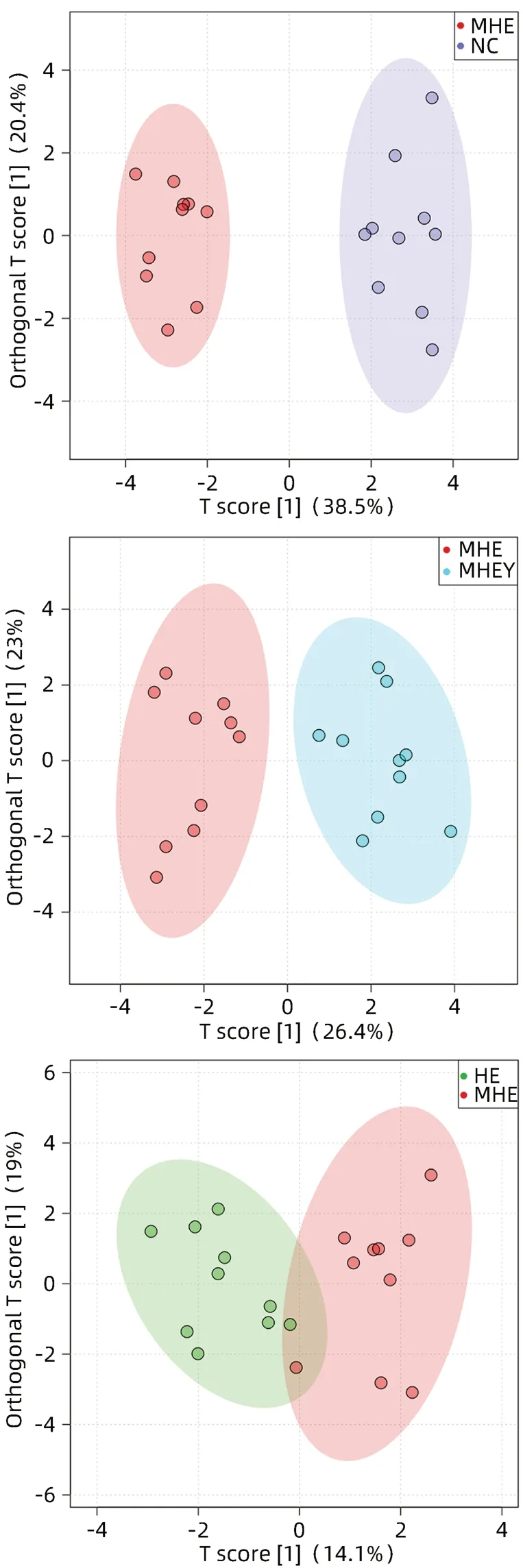
图6 OSC散点图Figure 6 OSC scores plot
对OPLS-DA模型进行Permutation检测,对数据进行200次随机排列组合实验。MHE组与NC组对比模型、MHE组与MHEY组对比模型的Q2和R2均>0.5,P值均<0.05,说明具有较高的解释力和预测能力,可以进行下一步的数据分析;而MHE组与HE组对比模型的R2<0.4,说明此模型不适用于下一步的数据分析。
成功建立OPLS-DA模型后,结合P-value和变量重要性投影(variable importance in projection,VIP)值筛选差异显著的BA,VIP值>1时,差异显著,P<0.05。MHE组与NC组对比,差异显著的BA有12个,GCDCA、GUDCA、GHDCA、TCDCA、TUDCA、GLCA和TLCA减少,γ-MCA、THCA、7-KDCA、AlloLCA、α-MCA增加。MHEY组与MHE组对比,差异显著的BA有5个,THDCA、TMCA、TCDCA、TUDCA和TLCA增加(附录A和表3)。
3 讨论
实验数据显示,结合大鼠一般状态观察及Morris水迷宫检测,MHE组大鼠部分出现反应迟缓和自主性活动减少,认知功能下降,HE组大鼠先后出现嗜睡、反应迟缓、共济失调甚至昏迷,学习和记忆能力严重下降,MHEY组大鼠均未见上述症状。此外,血清中AST、ALT、ALP、TBil、TBA、血氨及结肠pH值生化指标的变化表明,HE组比MHE组肝衰竭程度更严重,而大黄煎剂干预MHE大鼠后各项指标均好转。另外,结合肝组织和脑组织病理切片,说明大黄煎剂有较好的保护肝细胞、改善肝功能的作用,并可以降低大鼠结肠内容物的pH值,降低血氨,恢复MHE大鼠认知功能。
有研究[20-21]表明,肠道和大脑之间的双向串扰对于维持宿主体内平衡至关重要,并在神经、激素和免疫学水平上受到调节,肠道菌群在肠-肝-脑相互作用中起着重要作用,BA对肠道菌群的扰动会影响肠-肝-脑轴以改变行为反应[22]。结合和非结合BA先前已在非认知受损的人类及啮齿动物的大脑中被检测到,并且相同的BA主要存在于循环中[23-24]。尽管在低活性的大鼠脑提取物中观察到鹅去氧胆酸(CDCA)由24-羟基胆固醇合成[25],但据推测,大部分脑BA是从外周循环运输的[26]。BA是FXR、G蛋白偶联受体5、肝X受体、孕烷X受体和维生素D受体等多种核受体的天然配体,在脑和外周器官均有表达[25,27]。脑中的BA在认知功能、记忆和学习中的作用与这些核受体及几种神经递质受体的激活有关,包括M2和M3毒蕈碱乙酰胆碱受体、γ-氨基丁酸和N-甲基-D-天冬氨酸受体[28]。研究[29]表明,未结合BA和次级BA的缺失会导致回肠中FXR的激活,这可能会损害抗炎途径和肠道屏障功能,最终诱导MHE的发生。此外,回肠中的FXR先前也被证明可以激活FGF15的表达,FGF15进入肝肠循环,激活肝中的FXR调节肝脏SHP/LRH-1途径,进而下调CYP7A1的表达,减少BA合成,而合成BA的原料胆固醇肝内蓄积也可进一步加重肝损伤[30]。而且,BA浓度的降低可升高肠道pH值和无法控制具有脲酶的菌种生长引起血氨升高[31]。有研究[32]显示,喂食富含BA抑制剂消胆胺饲料的小鼠血清和脑BA含量降低,从而减轻了与MHE相关的神经功能损害。在急性肝衰竭大鼠中,FXR及其辅助因子小异二聚体伴侣在额叶皮层中的表达增加。直接向额叶皮质注入FXR特异性抑制剂对急性HE相关的神经系统并发症具有保护作用[33]。
本研究结果显示大鼠发生MHE时,肝FXR表达增加,初级BA浓度降低,大黄煎剂干预后可能通过调节菌群,影响肠内BA池,通过抑制回肠FXR-FGFR4使肝FXR表达降低,BA浓度回调。MHE大鼠GCDCA、GUDCA、GHDCA、TCDCA、TUDCA、GLCA和TLCA减少,γ-MCA、THCA、7-KDCA、AlloLCA、α-MCA增加,大黄煎剂干预后,THDCA、TMCA、TCDCA、TUDCA和TLCA回调;MHE组与HE组组成相似。据报道[34],TUDCA在防止肝细胞凋亡和保护线粒体免受干扰能量产生的不利细胞因素的影响方面发挥作用。BA进入大脑的机制以及它们如何存在于脑脊液中是未知的。最近的研究[35]显示,脑中疏水性BA通过涉及紧密连接蛋白闭塞的Rac1-dependent磷酸化的机制增加了血脑屏障(blood brain barrier,BBB)的通透性,而非结合BA疏水性强于结合BA。随着BBB通透性增加,血清中非结合BA被动扩散到大脑中加重MHE[33]。有研究[35]显示,肠道微生物组调节失调导致细胞毒性次级BA如脱氧胆酸及其衍生物的产生增加,这些细胞毒性次级BA可以调节BBB并在大脑中积累,从而导致其受体和靶标介导的代谢功能受损引起认知功能障。虽然本研究不是检测血清中BA代谢谱,但是检测胆汁中BA能更直观地反应肠道菌群与BA代谢的关系。当大鼠发生MHE时,胆汁中非结合BA是升高的。课题组推测胆汁中BA的变化引起了血清中非结合BA的升高,进而增加BBB的通透性诱发MHE。而且可以推测当MHE发生时,肝内如TUGDA一类保护肝细胞的BA浓度下降,毒性BA升高,进一步加重肝损伤。大黄煎剂可以逆转此现象。而且HE组和MHE组的BA组成相似,说明HE是MHE进展而来,发病机制类似。
BA与肠道菌群两者本身就是相互调节,本研究发现了BA肠肝循环在MHE发病中的重要性,加强肝病与肠-肝-脑轴之间的关系,并且进一步探讨了大黄煎剂保留灌肠治疗MHE的机制。虽然本实验未直接证实胆汁中Ras的变化可导致MHE,但是可以推测得出与MHE发病密切相关,并且其与肠道菌群密切相关,相互调控,为接下来深层次的研究奠定了基础。由于资金和时间限制,本研究存在以下缺点:未研究脑、血液和肠道中的BA代谢谱。
伦理学声明:本研究方案于2022年8月28日经由广西中医药大学实验动物伦理委员会审批,批号:DW20220826-162,符合实验室动物管理与使用准则。所有实验操作严格按照《关于善待实验动物的指导性意见》进行。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:王萌、毛德文负责课题设计;杜沅沁负责资料分析,撰写论文并最后定稿;钟瑞熙、徐健、黄国初、黄良江负责实验实施,分析数据;黄晶晶、谭钦文负责数据整理;姚春负责实验指导。

