细胞毒性T淋巴细胞来源外泌体抑制肝星状细胞活化的机制
覃川福, 赵雅丽, 龙丽娟, 邱华
1 广西医科大学附属肿瘤医院中医科, 南宁 530021; 2 广西医科大学第一临床医学院, 南宁 530021
肝纤维化是一种以肝组织中胞外基质(ECM)过多为特征的慢性肝损伤,由多种因素引起,包括病毒性肝炎、药物和自身免疫性疾病[1]。目前在我国其主要病因仍是HBV感染。最新流行病学调查显示,我国慢性HBV感染者约存7 000万例,其中慢性乙型肝炎(CHB)患者为2 000万~3 000万例。如未得到有效治疗由CHB进展至肝纤维化、肝硬化的5年累积发生率可达12%~25%,肝硬化进展至肝衰竭或肝细胞癌(HCC)的5年累积发生率分别达20%~30%和6%~15%[2-3]。因此,深入探索乙型肝炎肝纤维化的机制,寻找有效的防治方法,具有重大意义。HBV感染并不能直接导致肝细胞病变,研究者们普遍认为机体的病理损伤和病程转归主要与病毒入侵后引发的机体免疫应答有关,针对HBV抗原的免疫应答强度决定了疾病最终的转归[4],其中细胞毒性T淋巴细胞(CTL)是清除HBV的决定性力量,并发挥着对HBV长期免疫监视,抑制乙型肝炎肝纤维化激活的功能[5]。而HBx蛋白在慢性乙型肝炎发生、发展中发挥着重要调控作用[6]。有研究[7]发现将转染了HBx的肝细胞与肝星状细胞(HSC)共培养,α-SMA、胶原和TGF-β1的表达明显增高。但CTL是否通过调控HBx蛋白表达而影响HBV复制及抑制肝纤维化未见报道。近年来,对外泌体作为细胞间物质和信息的传递工具的研究越来越受关注。有研究表明,感染HBV肝细胞、HSC及CTL细胞均可分泌外泌体,并在不同层面参与了肝纤维化的调控。本研究前期已经成功构建含HBV全基因组1.3倍体的HepG2稳转细胞模型,并命名为HepGA14[8]。据此,本研究将CTL-exo加入HepGA14培养体系,同时将CTL-exo和HBV-exo按照不同比例进行混合后,与LX-2细胞共孵育,拟明确CTL能否通过外泌体途径跨细胞靶向HBx抑制HSC活化,以期为乙型肝炎肝纤维化的防治提供新途径。
1 材料和方法
1.1 材料
1.1.1 细胞系 HepG2、HepGA14、HSC-LX2和CTL细胞(上海诺百生物科技有限公司)。
1.1.2 主要试剂及药物 DMEM培养液、1640培养液、FBS(美国Thermo Fisher Scientific公司);抗体:Anti-CD63 antibody、Anti-TSG101 antibody、Anti-Hepatitis B Virus X antigen antibody(英国Abcam公司);Anti-GAPDH(北京博奥森生物技术有限公司);HRP-conjugated Goat Anti-Mouse IgG、HRP-conjugated Goat Anti-Rabbit IgG(上海生工生物工程有限公司);氟硼二吡咯染料(美国Sigma公司);磷钨酸(德国Merck公司);RIPA裂解液、BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)。
1.1.3 主要仪器设备 荧光定量PCR仪(美国Bio-Rad公司);荧光显微镜(日本Olympus公司);离心机(美国Beckman Coulter公司);透射电镜(美国Thermo Fisher Scientific公司);共聚焦显微镜(德国Leica公司)。
1.2 方法
本研究严格遵循《中华人民共和国生物安全法》中“病原微生物实验室生物安全”的相关法律规定进行管理与操作。
1.2.1 细胞培养 (1)HepG2、HepGA14和LX-2细胞分别在含有10%胎牛血清、100 U/mL青霉素和100 µg/mL链霉素的高糖DMEM培养基中,在37 ℃、5% CO2恒温恒湿培养箱中培养。(2)CTL系TALL-04培养:培养基为1640基础培养基,加10%FBS和1%双抗。传代时采用1 000 r/min离心5 min,用新鲜培养基重悬,再按照比例(1∶2~1∶4)传到新皿中,培养至1×108个细胞量。
1.2.2 HepG2、HepGA14及CTL细胞外泌体提取与鉴定 (1)外泌体提取:培养HepG2及HepGA14细胞,准备80%左右密度的细胞各50皿,换成无血清培养液继续培养48 h,分别收集细胞上清。超速离心法提取外泌体,具体步骤如下:取50 mL细胞上清,以1 000 r/min离心10 min,取上清。以3 000 r/min离心10 min,取上清。10 000×g离心30 min,取上清。在4 ℃下以100 000×g持续离心90 min,去掉上清,留下的沉淀PBS重悬后,再次以100 000×g离心90 min,取上清,同法提取CTL细胞外泌体,将获取的外泌体分别保存备用。(2)外泌体鉴定:①透射电镜观察外泌体形态。分别取NC-exo、HBV-exo及CTL-exo 10 µL滴于透射电镜专用的载样铜网上,常温静置2 min,滤纸吸去浮液,用1%(W/V)磷钨酸溶液染色5 min后,滤纸吸去多余染色液,晾干,透射电镜观察外泌体结构。②Western Blot检测外泌体的标志物CD63和TSG101表达(以细胞裂解物为对照)。取HepGA14细胞上清,以100 000×g离心90 min后,弃上清,加入100 µL RIPA裂解液,吹打使裂解液和HBV-exo充分混合,冰上裂解30 min。4 ℃、12 000 ×g离心30 min,吸取上清液置于1.5 mL EP管中,-80 ℃冻存。BCA法检测蛋白浓度,加入5×Loading Buffer,99 ℃变性10 min。取20 µg/孔上样至10% SDS-PAGE胶,80 V电泳30 min,120 V电泳1 h,采用湿法转膜,220 mA转膜1 h,5%牛血清白蛋白室温封闭1 h,5%牛血清白蛋白稀释一抗CD63,4 ℃孵育一抗过夜。TBST漂洗10 min,洗涤3次,加入二抗室温孵育1 h,加入显影液,上机曝光。同法检测HepG2、CTL细胞外泌体的标志物CD63和TSG101表达,以细胞裂解液为对照。
1.2.3 观察HBV-exo能否进入且影响HSC (1)外泌体荧光标记:用工作浓度为1 µg/mL氟硼二吡咯染料(BODIPY)避光染色30 min标记肝细胞HepG2及HepGA14细胞;换成无血清细胞培养基继续培养48 h后,收集细胞培养上清液,采用超速离心法提取纯化外泌体(方法同1.2.2),保存备用。(2)共聚焦荧光显微镜观察:取LX-2细胞重悬于无血清培养基中,置于37 ℃、5% CO2培养箱中,待细胞贴壁后加入上述荧光标记的HBV-exo,孵育48 h后采用PBS洗涤细胞2次,4%多聚甲醛固定、DAPI染色。共聚焦荧光显微镜下观察HBV-exo是否进入细胞。同法检测NC-exo能否进入HSC,不加外泌体为对照(简写为Con)。(3)检测HBV-exo能否影响LX-2细胞活性:①倒置显微镜观察LX-2细胞形态学改变;②将NC-exo、HBV-exo分别加入到LX-2细胞培养体系中,同时设置两种外泌体1∶1混合组(简写为NC-exo+HBV-exo),以不加外泌体为对照(简写为Con),37 ℃孵育48 h后,收集HSC,提取总RNA。采用实时荧光定量PCR(qPCR)检测LX-2细胞中TGF-β1、α-SMA、Collagen1等活化生物标志物的表达水平,以actin为内参,qPCR反应条件:95 ℃ 2 min,95 ℃ 10 s,60 ℃ 30 s,70 ℃ 30 s,40个循环,引物见表1。

表1 qPCR引物序列Table 1 Real-time PCR primer sequences
1.2.4 分析CTL细胞外泌体对HepGA14细胞的影响 (1)将CTL-exo加入到HepGA14的培养体系中,以不加外泌体为对照。孵育48 h分别收集HepGA14细胞(细胞依次简写为CTL-exo和Con)和培养上清(上清外泌体依次简写为CTL+HBV-exo和HBV-exo);用qPCR检测HepGA14细胞内HBV DNA和cccDNA水平,上清液提取外泌体中HBx mRNA的水平,qPCR反应条件:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,70 ℃ 30 s,40个循环;Western Blot检测外泌体HBx蛋白水平,方法同1.2.2。(2)将CTL-exo和HBV-exo按照不同比例(2∶1、5∶1、10∶1)进行混合后,加入到LX-2细胞培养体系中,以单加HBV-exo为阳性对照,以不加外泌体为阴性对照(简写为Con),37 ℃孵育48 h后收集LX-2细胞;qPCR检测LX-2细胞中TGF-β1、α-SMA、Collagen1等活化生物标志物的表达,方法同1.2.3。
1.3 统计学方法 应用软件SPSS 23.0进行统计分析,所有实验均重复3次,符合正态分布的计量资料以表示,两组间比较采用成组t检验。多组间比较用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 外泌体鉴定 透射电镜观察可见具有双层膜结构的微囊,呈圆形或椭圆形,囊泡的直径为50~100 nm,符合外泌体粒径范围;Western Blot检测显示,与相应对照组比较,NC-exo组、HBV-exo组及CTL-exo组高表达标志蛋白CD63和TSG101(图1)。
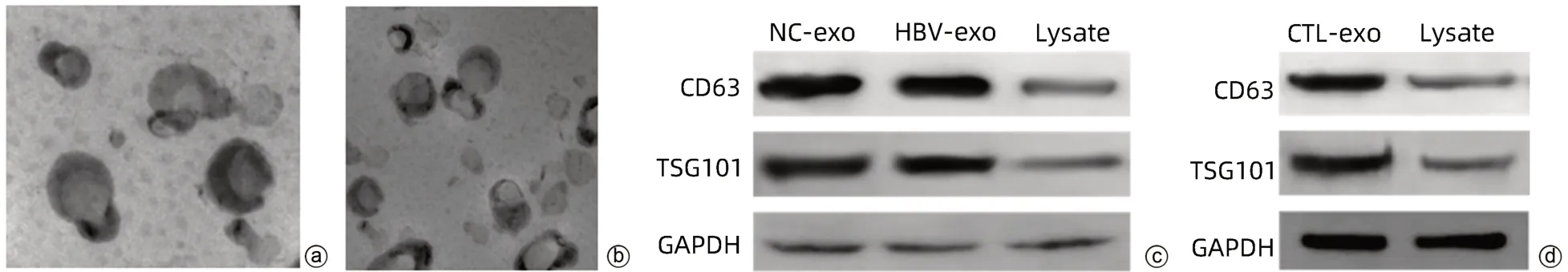
图1 外泌体鉴定Figure 1 Exosome identification
2.2 观察外泌体能否进入HSC及活化HSC
2.2.1 外泌体与LX-2细胞共培养观察 共聚焦荧光显微镜下可见NC-exo、HBV-exo被HSC摄取(图2)。
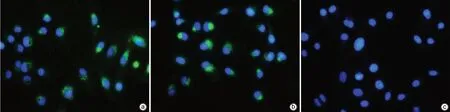
图2 荧光显微镜下观察外泌体进入LX-2细胞情况(×200)Figure 2 Observation of exosomes entering LX-2 cells under fluorescence microscopy(×200)
2.2.2 HBV-exo能否活化HSC-LX2 (1)倒置显微镜下可见HBV-exo进入LX-2细胞后HSC胞体增大、胞突伸展(图3)。(2)qPCR结果示NC-exo组、NC-exo+HBV-exo组、HBV-exo组及Con组LX-2细胞中TGF-β1、α-SMA和Collagen1基因相对表达量不同,差异均有统计学意义(P值均<0.05)。与NC-exo组相比,NC-exo+HBV-exo组和HBV-exo组LX-2细胞中TGFβ-1、α-SMA及Collagen1基因相对表达量均显著升高(P值均<0.05),与HBV-exo组相比,NC-exo+HBV-exo组LX-2细胞中TGFβ-1、α-SMA及Collagen1基因相对表达量均显著降低(P值均<0.05)(表2)。
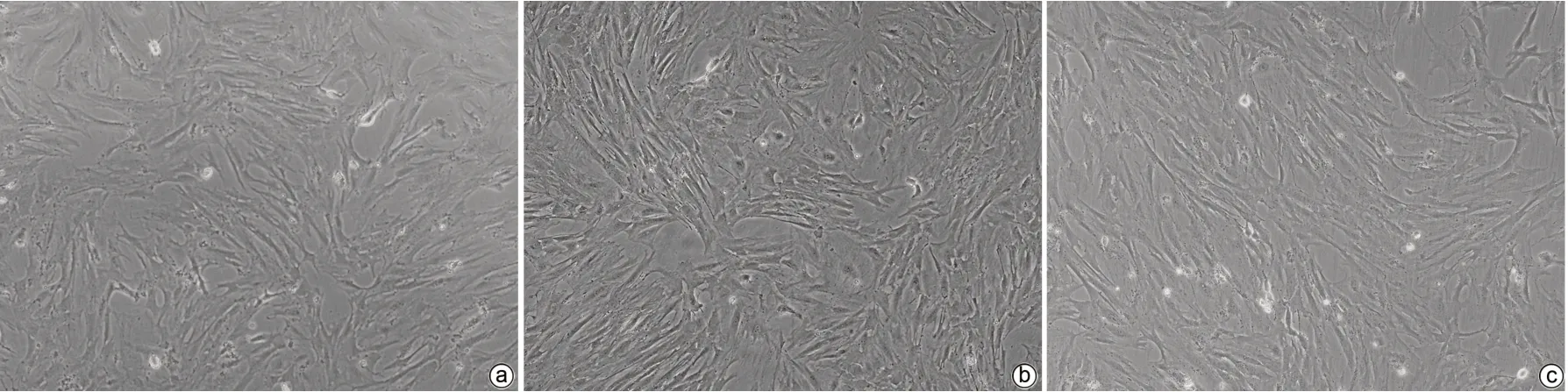
图3 相差显微镜下观察LX-2细胞形态学改变(×100)Figure 3 Observe the morphological changes of LX-2 cells by phase-contrast microscope(×100)
2.3 分析CTL细胞外泌体对HepGA14细胞的影响
2.3.1 CTL细胞外泌体对HepGA14细胞的影响qPCR检测显示:与对照组相比较,CTL-exo组HepGA14细胞中HBV DNA(0.30±0.01 vs 1.00±0.01,t=-85.732,P<0.05)及cccDNA(0.25±0.01 vs 1.00±0.01,t=-113.000,P<0.05)表达量均明显下降;与HBV-exo组相比,CTL+HBV-exo组外泌体中HBx mRNA相对表达量明显下降(0.20±0.01 vs 1.00±0.03,t=-38.105,P<0.05)。Western Blot检测显示:与HBV-exo组比较,CTL+HBV-exo组外泌体中HBx蛋白相对表达量明显降低,差异有统计学意义(t=-13.093,P<0.05)(图4)。
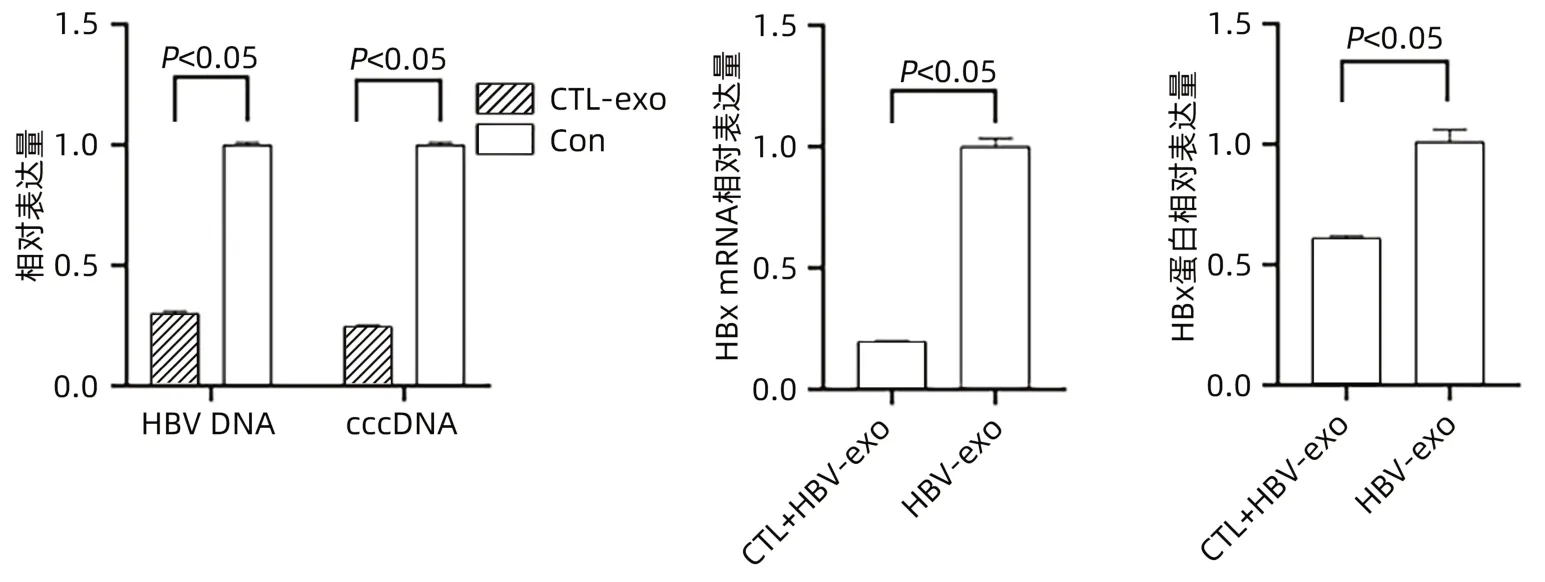
图4 CTL-exo对HBV感染肝细胞的影响Figure 4 Effect of CTL-exo on HBV-infected hepatocytes
2.3.2 CTL细胞外泌体对HepGA14细胞外泌体活化HSC的影响 qPCR检测显示:HBV-exo组、CTL-exo∶HBV-exo=2∶1组、CTL-exo∶HBV-exo=5∶1组、CTL-exo∶HBV-exo=10∶1组、Con组LX-2细胞中TGF-β1、α-SMA、Collagen1基因相对表达量不同,差异均有统计学意义(P值均<0.05);与Con组相比,HBV-exo组、CTL-exo∶HBV-exo=2∶1组、CTL-exo∶HBV-exo=5∶1组中α-SMA、Collagen1基因表达上调,差异有统计学意义(P值均<0.05);并且LX-2细胞中TGF-β1、α-SMA、Collagen1基因相对表达量随着CTL-exo比例的增加而逐渐减弱(表3)。
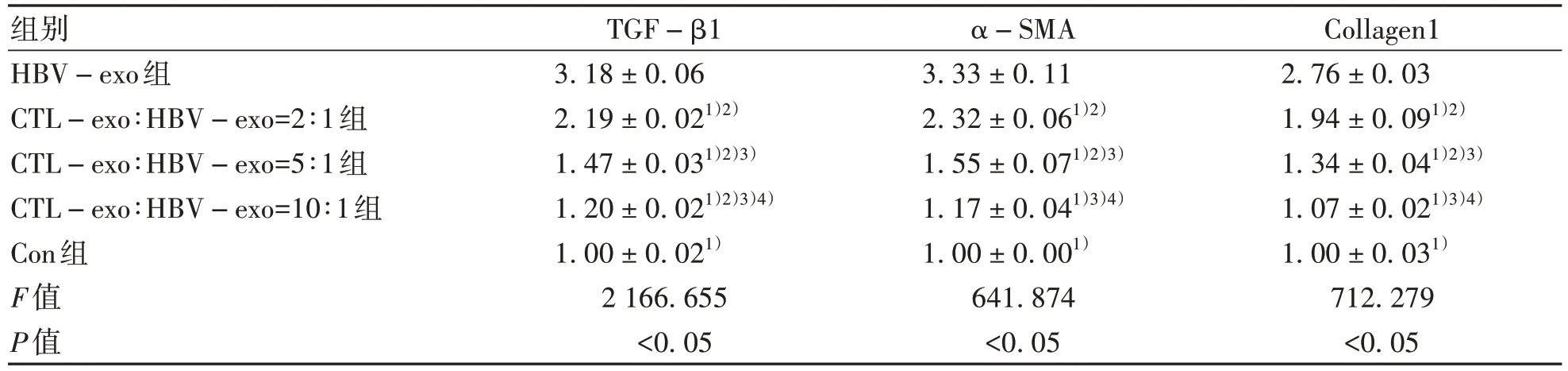
表3 不同HBV-exo、CTL-exo浓度比例干预后HSC-LX2细胞中TGF-β1、α-SMA、Collagen1的相对表达量Table 3 Relative expressions of TGF-β1, α-SMA and Collagen1 in HSC-LX2 cells after different HBV-exo and CTL-exo concentration ratios
3 讨论
HBV感染呈世界性流行,是影响全球的严重公共卫生问题。现我国由于乙型肝炎疫苗和乙型肝炎预防知识的普及,乙型肝炎新发人数有逐步下降的趋势,但在2009—2018年的10年期间,年新发人数仍维持在100万左右[9]。目前抗病毒病因治疗是乙型肝炎的主要治疗手段,主要包括核苷(酸)类似物及干扰素两大类,通过有效抑制HBV复制使肝纤维化能获得不同程度的改善,但不能彻底清除HBV,有部分患者仍出现肝纤维化及进展[10-11]。有研究[12]发现对于仅取得病毒学和生化学应答的部分患者,其肝纤维化依然存在,甚至持续进展,可最终发展为肝硬化或肝癌;而对于获得HBeAg、HBsAg血清学应答者,肝脏炎症及纤维化进程能获得明显改善,发生肝硬化和HCC的风险显著减少。陈博武等[13]在一项随访长达5年包含542例患者的接受抗病毒治疗的代偿期乙型肝炎肝硬化患者队列研究中,比较持续病毒学应答队列患者和非持续病毒学应答队列患者的肝癌发生率,发现非持续病毒学应答队列患者5年肝癌发生率为34.8%,持续病毒学应答队列患者5年肝癌发生率为20.6%,发生率明显下降。由HBV的生命周期可知HBeAg、HBsAg血清学转换的本质就是获得对cccDNA的抑制、沉默及清除[14]。这表明了免疫对HBV控制力的强弱,才是决定乙型肝炎肝纤维化是否激活与进展的关键因素。目前关于CTL对HBV的清除机制研究较为深入,已有研究发现3种抑制或清除HBV的主要途径。其一,Fas配体(FasL)途径[15]:CTL可表达与Fas相结合的细胞表面蛋白FasL。当FasL与靶细胞上的Fas相互作用,通过死亡信号转导而活化凋亡途径,然而这种机制在清除胞浆内HBV核衣壳和复制的HBV DNA中间体方面作用较小。其二,穿孔素和颗粒酶途径[16]:CTL通过穿孔素和颗粒酶系统诱导感染HBV的肝细胞直接裂解,减少感染HBV的肝细胞数量。其三,细胞因子途径[17]:CTL可通过释放细胞因子TNF-α、IFN-γ等清除HBV核衣壳颗粒、复制中间体,甚至是降解转录模板cccDNA。这种“非杀细胞”模式不会引起细胞坏死及炎症,是CTL清除cccDNA,实现乙型肝炎“治愈”,抑制肝纤维化的最主要途径。但其调控机制尚不清楚。
外泌体是一种能被机体内大多数细胞分泌的微小膜泡,具有脂质双层膜,直径为30~150 nm,几乎所有细胞均可分泌,并广泛存在于各种体液中[18-20],外泌体可将参与生理或病理过程的生物分子从母体细胞转移到受体细胞,是细胞间通讯的有效方式[21]。有研究[22]发现T淋巴细胞、巨噬细胞、树突状细胞等免疫细胞分泌的外泌体含有免疫调节成分,如IFN-α、IFN-β、ILs等,使外泌体具有抗病毒的活性。并且有研究者[23]发现从HBV感染者外周血血清分离出的外泌体中含有大量的病毒成分,包括HBV DNA、HBV RNA、HBsAg、HBeAg、HBx蛋白等。本研究将BODIPY标记的HBV-exo,加入HSC-LX2培养体系中,显微镜下发现HBV-exo能进入LX2细胞,并活化LX-2细胞,也证实了外泌体的载体作用。由此推测CTL可能通过外泌体途径干预HBx表达、抑制HBV表达及HSC活化。
为此本研究将CTL-exo加入到HepGA14培养体系中,发现HepGA14细胞内HBV DNA、cccDNA表达水平下降,并下调外泌体中HBx mRNA及蛋白的水平,差异具有统计学意义(P<0.05),表明CTL-exo可能靶向HBx抑制HBV复制。再将CTL-exo和HBV-exo按照不同比例进行混合后干预LX-2细胞,TGF-β1、α-SMA、Collagen1的表达水平也随着CTL-exo比例的增加而逐渐减弱,由此可见,CTL-exo可能通过抑制HBx的表达,从而抑制HSC活化。由此,本课题组在原肝纤维化“炎症致病”学说的基础上,进一步追溯到炎症产生的源头,提出了外泌体介导的跨细胞竞争机制假说:即感染HBV的肝细胞通过外泌体途径跨细胞传输HBx等致病因子引起HSC活化,而CTL等免疫细胞亦可通过外泌体途径传输抗cccDNA的免疫防御因子,抑制HSC活化。乙型肝炎肝纤维化是否启动或进展决定于上述两股力量“综合竞争”的结果。本研究表明CTL可通过外泌体途径下调HBx表达从而抑制HSC活化,为乙型肝炎肝纤维治疗新途径提供参考。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:覃川福负责实验研究、数据分析、论文撰写;赵雅丽负责实验研究和数据分析;龙丽娟负责实验研究及论文撰写;邱华负责课题设计,数据分析,指导实验和写作。

