妊娠合并HBV感染患者TRFIA与qPCR检测结果相关性研究
成君俐 黄丽芳 陈建斌 邓常春 吴丽娜
(韶关市第一人民医院检验科,广东 韶关 512000)
乙型肝炎感染(HBV)是一种严重威胁人类健康的病毒。孕妇一旦感染了乙型肝炎病毒,就会发生垂直传播,对胎儿造成很大的危害,因此,及时、准确地检测出HBV病毒,对其进行有效的控制和治疗是十分重要的[1-2]。目前临床上常用的检测方法有荧光qPCR法、TRFIA法等。其中,qPCR方法是检测乙型肝炎病毒的金标准[3]。TRFIA法主要用于初步评估机体是否存在感染,但是不能准确判断病毒传染性的强弱;qPCR方法灵敏度较高,但检测时易受其他因素影响[4-5]。目前关于qPCR与TRFIA两种方法检测结果的关联性研究较少,本研究拟对妊娠合并HBV患者进行两种方法检测结果的关联性进行评估,其将有助于对乙型肝炎患者病情进行有效性的诊断与针对性治疗。
1 资料与方法
1.1 一般资料 研究对象是2022年1月至2022年12月我院产科住院部及产科门诊收治的妊娠合并乙型肝炎患者100例,并收集保存患者血清样本。
纳入标准:年龄>20岁;妊娠1~38周;没有使用过治疗乙型肝炎药物。排除标准:合并其他严重疾病。
患者样本的研究经申请单位伦理审查会批准,并告知所有患者研究内容,患者及家属签署知情同意书。
1.2 方法 所有患者入组后均空腹抽取静脉血5 mL,室温凝固后离心,吸取上层血清,置于-85 ℃冰箱,直到检测。
1.2.1 乙型肝炎病毒脱氧核糖核酸(HBV-DNA)定量检测 患者的血清样品中的HBV-DNA的浓度都采用了圣湘生物科技有限公司生产的HBV核酸定量检测试剂盒(PCR-荧光探针法),该试剂盒包含了核酸提取试剂和扩增反应试剂。操作方法简述如下。
试剂准备:以待测样本、阴性对照、阳性对照以及定量参照物A~D数量为依据,按照比例(HBVPCR反应液38 μL/人份+HBV酶混合液2 μL/人份+内标0.2 μL/人份)取对应量的反应液、酶混合液及内标于离心管中,将它们充分混匀成PCR-mix,瞬间离心后备用。将以上制备好的试剂移至样品处理区,等待使用。
样本核酸抽提(在样本处理区进行):从抽屉中取出0.2 mL反应管(八联管)、反应管架、离心管架、吸头以及手套。从试剂盒中取出核酸释放剂、定量参考品和阴、阳性对照。待上述试剂成分溶解后,使用微型离心机将核酸释放剂、定量参考品、阴性对照、阳性对照,瞬时离心,备用。取出n个0.2 mL反应管,使用10 μL移液器向每个反应管中先加入核酸释放剂5 μL(建议深吸浅打,避免出现气泡),然后分别加待测样本、阴性对照、阳性对照以及定量参考品A~D各5 μL,用移液器吸打3~5次混匀。放置10 min,然后用100 μL移液器,向每管中靠壁加入PCR-mix 40 μL,无须混匀,盖上管盖。使用微型离心机,瞬时离心后取出(可用手指轻弹,去除气泡),置于反应管架上,转移到扩增检测区。
PCR扩增:将PCR反应管放入ABI7500实时荧光定量PCR仪样品槽,按对应顺序设置阴性对照、阳性对照、定量参考品及待检未知样本。荧光检测通道选择:①选择FAM通道检测HBV-DNA。②选择VIC通道检测HBV。③参比荧光设置ROX。循环参数设定:50 ℃ 2 min;94 ℃ 2 min;94 ℃ 15 s,57 ℃ 30 s,45个循环。
结果分析:反应结束后自动保存,根据分析后图像调节Baseline的Star值、End值以及Threshold(Star值可以在3~15,End值可设置在5~20,调整阴性对照的扩增曲线平直或低于阈值线),点击Analyze进行分析,使各项参数符合质量控制中要求。试剂盒有效检测下限为100 IU/mL。
1.2.2 乙型肝炎病毒标志物(HBV-M)定量检测 时间分辨荧光免疫分析法(TRFIA)检测:乙型肝炎两对半标志物使用TRFIA方法进行。检测对血清标本中的乙型肝炎病毒血清标志物进行测定。使用Perkin ELmer Easy cuta 1260全自动时间分辨荧光分析系统及其配套试剂对患者血清样本进行检测。检测结果阳性的判定标准是:①HBsAg>0.05 ng/mL。②HBs>10 IU/mL。③HBeAg>0.1 NCU/mL。④抗-HBe>0.2 NCU/mL。⑤抗-HBc>0.9 NCU/mL。
按照实验室SOP的要求进行操作。
1.3 统计学方法 根据TRFIA检测结果,将乙型肝炎两对半五项指标阳性一致的归为一类,如检出HBsAg、HBeAg、HBcAb均阳性(大三阳)的样本归为一类,有n份,在这n份样本中qPCR检测结果为阳性的为m份,将这两项结果进行比对。采用PEMS统计软件对数据进行分析,计数资料用[n(%)]表示,用χ2检验,计量资料()进行,用t检验,P<0.05为差异有统计学意义。
2 结果
在100份血清中使用TRFIA法检出HBsAg、HBeAg、HBcAb均阳性(大三阳)29份[29.00%(29/100)],其中使用qPCR法检测HBV-DNA的含量阳性27份[93.10%(27/29)];HBsAg、HBeAb、HBcAb均阳性36例[36.00%(36/100)],其中使用qPCR法检测HBV-DNA的含量阳性30份[83.33%(30/36)]。TRFIA法检测HBV-M阳性者(Ⅰ组)71份,使用qPCR法检测HBV-DNA的含量阳性63份[88.73%(63/71)];TRFIA法检测HBV-M阴性者(Ⅱ组)29份,使用qPCR法检测HBV-DNA的含量阳性4份[13.79%(4/29)],其中Ⅰ组HBV-DNA阳性率与Ⅱ组进行比较,Ⅰ组HBV-DNA阳性率高于Ⅱ组(P<0.05)。见表1。
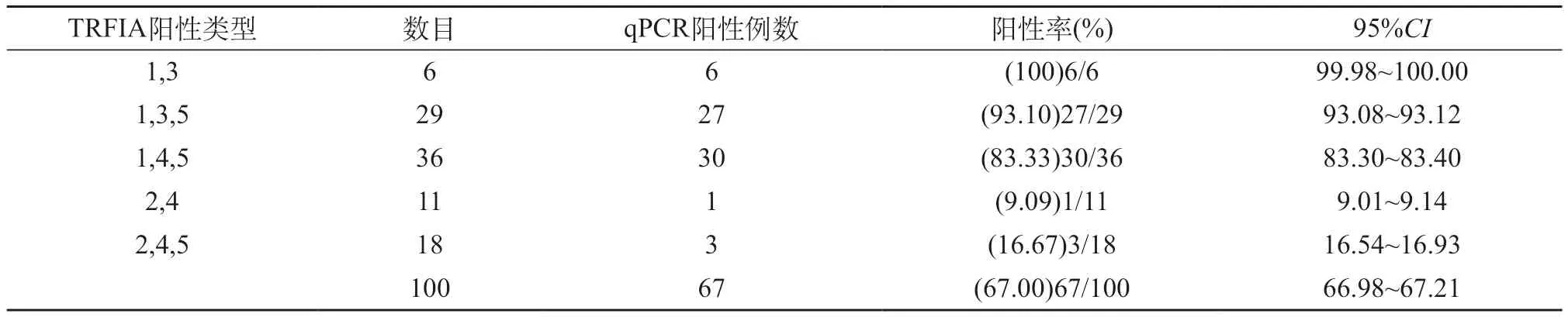
表1 TRFIA法与qPCR法检验结果对比
3 讨论
HBV感染是由病毒复制进化、宿主免疫应答及环境因子共同作用所致的,妊娠可引起多种生理变化,产生多脏器效应和免疫耐受[6-7]。在妊娠期间,母体的免疫系统对外来抗原进行了适应性的耐受,这种情况伴随着明显的激素改变,使肾上腺皮质激素、黄体酮和雌性激素升高[8-9]。急性乙型肝炎病毒感染转变为慢性乙型肝炎病毒感染的风险分别是95%左右发生在围生期,20%~30%发生在1~5岁儿童,而成人低于5%,说明慢性HBV感染的孕妇将病毒传播给胎儿的可能性较大[10]。所以,针对妊娠妇女的HBV感染状况,在怀孕前或者怀孕早期,及时对HBV进行筛查,能够有效应对可能发生病毒传播给胎儿事件。
TRFIA是一种利用稀土元素对抗原、抗体进行标记的非同位素免疫分析方法,利用稀土络合物的发光特性,采用时间分辨的方法对荧光进行测量,通过波长与时间的同步测量,可以有效消除非特异性荧光的干扰,提高分析的特异性[11]。TRFIA检测方法是能够对患者在检测期间的免疫情况有一个更好的了解,同时还能为HBV感染提供一个间接的证据,用他来排查机体是否感染了HBV,并充分了解到药物的效果,为医师选择药物提供依据。但TRFIA检测方法并不能准确判断患者体内HBV传染性的强弱。而qPCR作为HBV感染的最直接证据,具有较高的敏感性和准确性,是HBV感染的金标准[12]。qPCR可以明确病毒的数量,可以准确的判断HBV在体内的复制情况和传染性的强弱,可以作为乙型肝炎两对半检查的有力补充。并且该方法的整个操作过程均在完全闭管的状态下进行,不需要开盖电泳,这样不仅避免了核酸对环境的污染,也避免了使用致癌物溴化乙啶对人体造成的危害。
本研究结果表明,HBV-DNA与HBeAg呈正相关,病毒复制活跃、传染性强;HBsAb阳性是一种保护性抗体,提示患者感染过乙型肝炎病毒,病程进入恢复期,无传染性。
综上所述,乙型肝炎病毒标志物的含量会受到人体免疫功能、变异等多种因素的影响,如果仅仅依靠血清乙型肝炎病毒标志物的检测结果,来对病情做出诊断和判断是不充分的,而且在检测HBV-DNA的时候,很容易受到某些人为或非人为因素的影响,而qPCR与TRFIA方法互相补充,能够使HBV的检测变得更加准确,能够更有针对性地采取相应的治疗措施。因此,在进行临床工作时,可以采用两种方法结合检测,对妊娠患者的HBV病毒含量进行综合分析,从而对患者的病情、检测感染状况及病毒的活动程度都具有较高的临床意义。

