苦丁茶对大肠杆菌的抑菌作用及其机制研究
蓝怡,戴园园,余艳妮,崔文卿,葛珍珍,何一恒,杨珊,李笑,覃艳春
(1. 右江民族医学院药学院,广西 百色 533000;2. 右江民族医学院附属医院,广西 百色 533000;3. 右江民族医学院基础医学院,广西 百色 533000)
大肠杆菌是临床上常见的多重耐药细菌,耐药率呈逐年上升的趋势[1]。临床上治疗大肠杆菌的药物主要是第三代头孢菌素,2021年中国耐药细菌监测显示[2],大肠杆菌的分离率最高,占临床总分离细菌的18.96%,大肠埃希菌对头孢曲松、头孢噻肟、哌拉西林、甲氧苄啶-磺胺甲唑、环丙沙星和左氧氟沙星的耐药率均超过50%,为此需要研究新的药物来抗耐药大肠杆菌。
中药由于具有品种多,价格便宜,耐药性小等特点,在细菌耐药性的问题上显示出了得天独厚的优势,在临床上有良好的应用前景。目前已有学者提出,从天然药物中寻找高效、低毒性的抗菌成分,研发新型抗菌药物,有望成为解决细菌多重耐药性的新方法[3]。苦丁茶为冬青科冬青属植物,是一种中国南部地区广泛应用的药、茶两用植物,主产于广西、海南、广东等地。现代药理研究显示,苦丁茶具有降脂减肥、降血糖、抗动脉粥样硬化、抗氧化、抗病毒、抗菌等多种疗效,其治疗疾病的作用机理越来越受到人们的重视[4-5]。苦丁茶含有丰富的多糖、多酚、黄酮等成分,因此广泛的抗炎作用而被人熟知[6]。但苦丁茶对大肠杆菌的抗菌机制尚少见到报道。本试验通过研究苦丁茶水提液对大肠杆菌的抗菌作用,并从生物膜、细胞形态和胞内ATP的释放等探讨苦丁茶对大肠杆菌的抗菌作用机制,旨在挖掘苦丁茶对抗大肠杆菌潜在的临床价值,并为研发治疗大肠杆菌中西医合剂提供重要的实验依据,同时也增加苦丁茶的经济价值。
1 材料与方法
1.1 材料
1.1.1 实验菌株 大肠杆菌ATCC25922购于广东省微生物菌种保藏中心,实验所用大肠杆菌从临床分离,并经过法国梅里埃全自动微生物鉴定及药敏分析系统(VITEK 2 Compact)和肠杆菌科细菌生化鉴定编码管鉴定。
1.1.2 中药 苦丁茶,购于广西百色市大参林药店,经药学院黄元河副教授确认为冬青科冬青属苦丁茶。
1.1.3 主要试剂 酵母提取物、琼脂、氯化钠(天津市鑫铂特化工有限公司);胰蛋白胨(北京奥博星生物技术有限责任公司);95%无水乙醇(天津市福晨化学试剂有限公司);磷酸缓冲盐粉剂(PBS)(北京雷根生物技术有限公司);草酸铵结晶紫染色液(北京索莱宝科技有限公司);2’7’-二氯荧光素二乙酸酯(上海源叶生物科技有限公司);SOO27ATP检测试剂盒(上海碧云天生物技术有限公司);2,2-偶氮二(2-甲基丙基咪)二盐酸盐(APPH)(上海阿拉丁生化科技股份有限公司)。
1.2 仪器 AC2-6S8-CN生物安全柜(太仓艺斯高医疗器械科技有限公司);DHG-9140A电热恒温鼓风干燥箱(上海慧泰仪器制造有限公司);D3024R高速冷冻型微量离心机(南北仪器有限公司);SBC-12小型离子溅射仪(北京中科科仪股份有限公司);KYKY-EM8100扫描电子显微镜(北京中科科仪股份有限公司);Synergy H1多功能酶标仪(上海新领生物科技发展有限公司);MQD-621R立式双层大容量恒温振荡器(上海旻泉仪器有限公司);电子天平(奥豪斯仪器有限公司);CU-420恒温水浴箱(浙江明德仪器有限公司);IFA-110-8恒温培养箱(北京慧龙环科环境仪器有限公司)。
1.3 实验方法
1.3.1 苦丁茶提取液和菌液的制备
1.3.1.1 苦丁茶粗提物的制备 采用煮沸法[7-8]提取药液,称取苦丁茶500 g加入5 000 mL蒸馏水,煮沸后,用文火煎煮,第1次为1 h,第2次为40 min。将两次药液合并后,浓缩到50 mL,文火将其浓缩至25 mL,冷冻干燥后备用。
1.3.1.2 菌液的制备 将大肠杆菌接种于LB培养基,37 ℃培养18~24 h,选择菌落接种于MH营养肉汤培养基中,37 ℃培养24 h后,将菌液稀释至浊度为1.5×108cfu/mL备用。
1.3.2 抑菌圈测定最小抑菌浓度 采用二倍稀释法将苦丁茶以无菌水稀释,分别稀释为256 mg/mL、128 mg/mL、64 mg/mL、32 mg/mL、16 mg/mL、8 mg/mL 6个浓度备用。采用牛津杯法[9],向空白无菌培养皿中倒入2%的普通琼脂,冷却后,将牛津杯放置在普通琼脂上,轻轻按压至不留间隙,将100 μL的菌液与0.7% LB琼脂混匀,然后倒入普通琼脂,当0.7% LB琼脂凝固后,缓缓转动牛津杯将其拿出,分别加入配制好的药液100 μL,置37 ℃培养箱中培养24 h后,观察牛津杯周围是否有抑菌圈,以牛津杯周围无菌落生长的最小药物浓度作为其最小抑菌浓度(MIC)。实验用尺测量抑菌圈直径,重复3次,取平均值。
1.3.3 苦丁茶对大肠杆菌生长曲线的影响 取上述配置好的菌液100 μL接种于含有100 μL肉汤培养基的无菌96孔板各孔中,将32 mg/mL、16 mg/mL、8 mg/mL、4 mg/mL各浓度的苦丁茶稀释液100 μL加入各孔中,空白对照组加入100 μL的LB肉汤。37 ℃恒温培养24 h后,OD570 nm处每隔2 h测量吸光度值,以培养时间为横坐标,测出的OD值为纵坐标,并绘制24 h生长曲线[10]。
1.3.4 苦丁茶对大肠杆菌生物膜的影响 参考温燕龙等[11]的方法,在含有200 μL肉汤培养基的无菌96孔板各孔中加入200 μL配置好的菌液,放入37 ℃培养箱培养48 h。培养结束后,弃去培养液,用PBS溶液轻柔漂洗3次,将64 mg/mL、32 mg/mL、16 mg/mL、8 mg/mL、4 mg/mL各浓度的苦丁茶稀释液200 μL加入各孔中,阴性对照组加入200 μL LB培养液,阳性对照组只加入200 μL菌悬液,每个浓度设置3个复孔,在培养箱里24 h,培养结束后,弃去药液,用PBS轻柔漂洗2次,自然晾干,加入2%结晶紫溶液100 μL,染色30 min,弃去染液,用PBS轻柔漂洗3次。加入95%乙醇100 μL于96孔板中,于OD570 nm处测量数值。
1.3.5 苦丁茶对大肠杆菌菌体形态的影响 取菌悬液分别与16 mg/mL、8 mg/mL、4 mg/mL各浓度的苦丁茶稀释液混合,所有样品均置于37 ℃培养4 h。取出以12 000 r/min离心5 min,取上清液,加入戊二醛溶液4 ℃固定过夜。使用呈梯度的乙醇溶液(30%、50%、70%、80%、90%、100%)进行脱水,放入烘干箱烘干,真空条件下镀金处理,用扫描电子显微镜(scanning electron microscope,SEM)观察并拍摄大肠杆菌菌体和不同浓度苦丁茶稀释液处理后的大肠杆菌菌体形态变化[12]。
1.3.6 苦丁茶对大肠杆菌胞内ATP水平的影响 按ATP检测试剂∶ATP检测试剂稀释液=1∶4比例配制ATP检测工作液,菌株划线纯化后,挑取单个菌落至5 mL LB培养基中,37 ℃摇菌16~18 h。第2天,以1∶10比例转到50 mL新鲜培养基中,继续摇菌4 h,5 000 g离心,10 min,用PBS(pH=7.4)洗涤和重悬细胞3次,调配制OD=0.5,吸取调制好的菌液500 μL于EP管中,加入不同浓度的苦丁茶药液500 μL放入37 ℃培养箱培养1 h。菌悬液在高速冷冻型离心机(12 000 r/min)离心5 min。去掉上清液,加入400 μL裂解液,37 ℃水浴15 min,充分裂解细菌。裂解后4 ℃,12 000 r/min离心5 min,吸取上清,用于细胞内ATP水平测定。每孔加入100 μL ATP检测工作液到16196-3SSB(透明盖)黑色96孔板中,室温孵育5 min,充分消耗本底ATP,加入20 μL不同浓度的苦丁茶药液和标准品迅速用移液枪混匀,间隔5 s后用酶标仪测定ATP含量。
1.4 统计学方法 采用SPSS 20.0和WPS软件进行数据统计分析,两组间数据对比采用独立样本t检验(两尾法),以P<0.05为显著性的检验标准,即认为两组间有统计学差异。
2 结果与分析
2.1 苦丁茶对大肠杆菌的最小抑菌浓度 由表1可知:苦丁茶对大肠杆菌的最小抑菌浓度(MIC)为16 mg/mL。

表1 不同浓度苦丁茶提取液对大肠杆菌抑菌作用
2.2 苦丁茶对大肠杆菌生长的影响 由图1可知:与对照组相比,4 mg/mL、8 mg/mL浓度的苦丁茶对大肠杆菌曲线的抑制作用不明显,16 mg/mL和32 mg/mL浓度的苦丁茶对大肠杆菌的生长都具有明显的抑制作用。大肠杆菌的对数生长期起始时间随着苦丁茶浓度增大而有所推迟,呈现浓度依赖性。
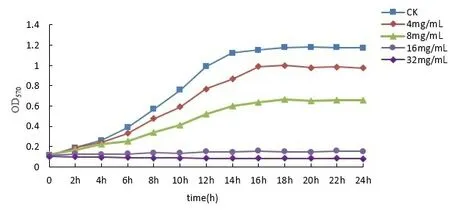
图1 不同浓度苦丁茶药液对大肠杆菌生长影响
2.3 苦丁茶对大肠杆菌生物膜的影响 由图2可知:与对照组相比,苦丁茶能抑制大肠杆菌生物膜的形成,其对生物膜的抑制作用呈现浓度依赖性。4 mg/mL苦丁茶药液处理后开始降低大肠杆菌生物膜的形成,8 mg/mL、16 mg/mL、32 mg/mL苦丁茶药液处理后,明显降低大肠杆菌的生物膜生成(P<0.01),经64 mg/mL苦丁茶药液处理后降低大肠杆菌生物膜的形成(P<0.001)。
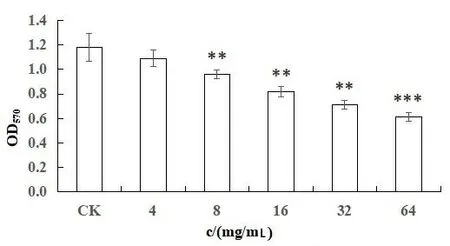
注:CK为对照组。**P<0.01,***P<0.001。
2.4 苦丁茶对大肠杆菌菌体形态的影响 大肠杆菌的SEM图较直观地反映了苦丁茶对菌体形态的影响。对照组中大肠杆菌菌体结构完整,外观饱满,菌体近乎椭圆形,表面光滑,折光性好(见图3A、图3B)。当加入4 mg/mL浓度的苦丁茶处理后(见图3C、图3D),大量菌体表面粗糙,折光性降低,个别菌体体积缩小。当加入8 mg/mL浓度的苦丁茶处理后(见图3E、图3F),菌体数量减少,部分菌体塌陷,胞膜表面不平整。当更高浓度16 mg/mL的苦丁茶作用处理后(见图3G、图3H),菌体数量显著减少,体积明显减小,表面褶皱、变得极度粗糙,部分菌体形态不规则,有严重的凹陷和扭曲,形态严重受损,如图3红色箭头所示。


注:A.大肠杆菌对照(×10 000);B.大肠杆菌对照(×20 000);C.苦丁茶0.25 MIC处理(×10 000);D.苦丁茶0.25 MIC处理(×20 000);E.苦丁茶0.5 MIC处理(×10 000);F.苦丁茶0.5 MIC处理(×20 000);G.苦丁茶1 MIC处理(×10 000);H.苦丁茶1 MIC处理(×20 000)。
2.5 苦丁茶抑制大肠杆菌胞内ATP产生 ATP是一种为大肠杆菌的代谢和活力提供能量和动力的能量因子,由图4可知:与对照组相比,加入4 mg/mL、8 mg/mL、16 mg/mL、32 mg/mL、64 mg/mL的苦丁茶均使大肠杆菌胞内ATP含量降低,用药前后差异有统计学意义(P<0.001),表明苦丁茶的加入抑制大肠杆菌胞内ATP产生。
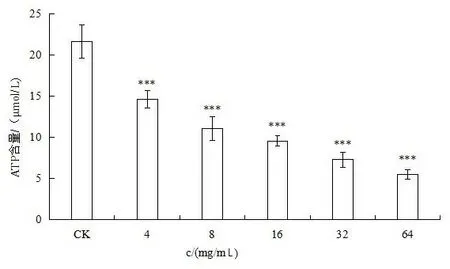
注:CK为对照组。***P<0.001。
3 讨论
苦丁茶作为我国本土珍贵的中药资源,备受专家学者的关注,但是国内外关于苦丁茶的研究主要集中在其化学组成成分和生物学活性方面,因此,研究苦丁茶对大肠杆菌的抑菌作用及机制,能为其作为先导药物应用于大肠杆菌引起的各种疾病提供理论依据。
对数生长期是微生物生长的重要环节,在对数生长期期间,微生物表现出快速的生长和增殖速度[13]。苦丁茶作用后对大肠杆菌的生长曲线测定结果表明苦丁茶对大肠杆菌生长具有明显的抑制效果。大多数致病细菌和环境细菌都生活在生物膜群落中[14],细菌的生物膜[15]通过特异性毒性因子附着、胞外多糖保护其免受特定的环境条件影响提高细菌抵抗外部不良环境的能力,提高其对抗生素的抵抗力,从而增加了抗药性,导致细菌逃逸宿主细胞的免疫防御,最终造成机体的持续性感染。大肠杆菌也有形成生物膜的能力,因此研究中药抗大肠杆菌生物膜意义非凡。对中药抗大肠杆菌生物膜机制的研究发现,许多中药具有抑制大肠杆菌生物膜形成和破坏生物膜的作用[16],如蜂胶中药提取物可以通过抑制细菌的DNA合成和膜蛋白的合成,从而破坏生物膜[17]。本研究发现不同浓度苦丁茶均能抑制大肠杆菌生物膜的形成,该结果与贺常亮[18]在筛选可以治疗鸡大肠杆菌的中药方剂时,发现多种组分主要是影响大肠杆菌的细胞膜通透性、破坏细胞结构的实验结论相符。大肠杆菌生物膜的形成是一个复杂的过程,需要如群体感应基因(quorum sensing,QS)、luxS、pgaABCD、qseBC等基因的参与[19]。相关研究表明,QS达到一定浓度之后,可以参与细菌生物膜的形成和毒力因子的表达[20]。QS和抗生素不同,不会对细菌产生选择压力,进而减少抗性突变体的出现和传播[21]。苦丁茶可能经过抑制DNA合成、膜蛋白的合成和群体QS破坏大肠杆菌的生物膜。
扫描电子显微镜能够使细菌放大20~130 000倍,并有很高的分辨率[22]。通过SEM结果显示苦丁茶作用后大肠杆菌数量减少,表面出现褶皱、粗糙、凹陷和扭曲,形态受损,而且随着药物浓度增加形态受损更严重,其机制可能是苦丁茶损伤大肠杆菌的细胞膜,使大肠杆菌膜通透性增高,导致细胞内容物的大量外泄,使得大肠杆菌膜凹陷,形成褶皱。
ATP是主要的供能物质,细胞代谢过程中会消耗大量的能量,ATP作为许多重要反应的能量来源,在所有活细胞中起着至关重要的作用[23]。经过不同浓度的苦丁茶处理后均能降低大肠杆菌胞内ATP的含量,可能是由于细胞膜通透性的改变、膜损伤或细胞水解速率加快、呼吸受到抑制,为保证细胞的质子动势平衡ATP的渗漏或快速耗竭[24-25]。有关报道[26],肉桂和香薰精油可通过诱导细胞渗漏降低对大肠杆菌和单核增生李斯特细胞内ATP含量并发挥抗菌作用。
综上所述,苦丁茶主要通过抑制大肠杆菌生物膜的形成和抑制胞内ATP生成,进而抑制大肠杆菌的生长和繁殖。

