外周血Septin9 基因甲基化检测在胃癌的临床应用价值探讨
苏群英 ,陆飞燕 ,陆相磊,王兴枝子,朱晓莹
[1. 右江民族医学院附属医院病理科,广西 百色 533000;2. 广西分子病理学(肝胆疾病)重点实验室,广西 百色 533000]
胃癌是我国常见的消化道恶性肿瘤,每年我国胃癌的新发病例数和死亡病例数分别为全球的44.10%和49.90%[1]。目前,胃癌诊断手段主要有胃镜和血清学筛查。但胃镜检测相对有创,患者依从性、可行性较差,血清学指标存在特异性和敏感性不足[2],亟待寻找胃癌诊断的便捷、有效方法。SEPTIN9基因甲基化(methylated Septin9,mSEPT9)检测,是近年临床用于结直肠癌检查的早期筛查和辅助诊断方法[3-4]。Septin9基因是一种抑癌基因,当它发生甲基化后,基因表达受抑制,会引起细胞分裂异常甚至癌变。研究证实[5-6]mSeptin9与人类结直肠癌、肝癌、胃癌、乳腺癌等多种恶性肿瘤的发生发展密切相关。研究发现Septin9基因在胃癌组织中表达异常,而胃癌患者外周血mSEPT9的情况尚未明确。本研究通过比较本院胃癌、胃炎患者和健康体检人群的mSEPT9甲基化的情况,进一步分析mSEPT9与胃癌患者的临床病理参数,以期为mSEPT9的潜在致病机制和进一步临床应用提供依据。
1 资料与方法
1.1 研究对象 回顾性收集2019年11月至2022年2月在右江民族医学院附属医院行外周血mSEPT9检测的所有病例,经筛选纳入胃癌患者136例,其中男性102例,女性34例。胃癌组:①经组织病理确诊为胃癌且符合诊断标准[7]《中国临床肿瘤学会(CSCO)原发性胃癌诊疗指南》(2017.V1);②患者在入组前均未接受放疗、化疗等治疗;③排除患有其他肿瘤、胃肠疾病、怀孕及免疫缺陷等患者;纳入胃炎病例30例,其中男性19例,女性11例,经过组织病理确诊为萎缩性胃炎或非萎缩性胃炎且符合诊断标准[8]《中国慢性胃炎共识意见》(2017年,上海);另有60例无疾病证据受检者作为对照,其中男性24例,女性36例,同时收集所有纳入病例的相关临床资料。对所有胃癌患者进行电话临床随访,记录患者的生存时间、生存状态,死亡原因等信息,总生存期定义为从确诊之日起到死亡之日或末次随访之日。本研究主要观察终点为肿瘤相关的生存,随访截止时间2022年5月12日。
1.2 检测仪器及试剂 mSEPT9检测试剂盒(PCR荧光定量法,北京博尔诚科技公司),紫外分光光度计 (Thermo Fisher NanoDrop One美国),实时荧光定量PCR仪(ABI 7500 Fast 美国)。
1.3 标本采集 无疾病证据受检者标本为体检人群体检时采集,胃炎组和胃癌组于患者住院第1天采集。采集受试者晨起空腹(禁食8~12 h)静脉血10 mL,EDTA-K2 抗凝,(1350±150)×g离心12 min,重复1次,获取3.5 mL血浆置于-20 ℃备用,统一检测。
1.4 外周血mSEPT9检测 所有检测均在右江民族医学院附属医院分子病理实验室完成。参照试剂盒说明书。依次裂解、磁珠富集DNA、洗涤、洗脱,亚硫酸盐转化;将转化后的DNA加入PCR预反应液中,按照94 ℃活化20 min;62 ℃ 5 s,55.5 ℃ 35 s,93 ℃ 30 s,行45次循环。结果判断:在确保质控对照样品有效的前提下,内参基因(β-肌动蛋白)CT值≤32,待检样本Ct值≤41.0时判为阳性;Ct值>41.0或无时结果判为阴性。每次实验均设阳性和阴性对照,阳/阴性对照品处理方法及流程与待检样本相同。
1.5 消化道肿瘤标记物检测 血清学肿瘤标记物CEA、CA199和AFP均由右江民族医学院附属医院检验科采用电化学发光法进行检测(罗氏电化学发光仪)。判读标准:CEA参考范围为0~6.5 ng/mL,AFP参考范围为0~9 ng/mL,CA199参考范围为0~34 U/mL。
1.6 统计学方法 应用SPSS 24.0、GraphPad Prism 7.0软件进行统计学分析。计数资料以例数(n)和百分数(%)表示,组间比较采用χ2检验或Fisher确切概率法;通过计算ROC曲线下面积(AUC),预测外周血mSEPT9检测的诊断价值;配对资料一致性检验,采用Kappa检验,Kappa≥0.75,说明两种方法诊断一致性较好,Kappa<0.4一致性较差;生存分析采用Kaplan-Meier 法,风险比采用Cox回归模型(log-rank检验),P<0.05为差异有统计学意义。
2 结果
2.1 外周血mSEPT9检测在各组中阳性率的比较 在所有未经治疗的受检者中,无疾病证据组、胃炎组、胃癌组外周血mSEPT9阳性率分别为3.33%(2/60)、 26.67%(8/30)、50.74%(69/136)。胃癌组外周血mSEPT9阳性率高于胃炎组和无疾病证据组,差异有统计学意义(分别为χ2=40.492,P<0.001;χ2=5.725,P=0.017)。226例检查者中外周血mSEPT9检测为胃癌的灵敏度为50.74%(69/136),特异度为88.89%(80/90)。绘制ROC曲线,ROC曲线下面积AUC为0.716,95%置信区间(0.649~0.783),P<0.001。见图1。
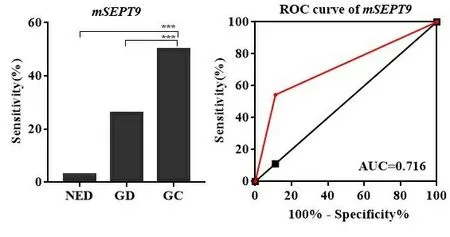
图1 血浆mSEPT9基因检测在各组的阳性率和ROC曲线
2.2 胃癌患者外周血mSEPT9基因甲基化检测结果及其临床病理参数关系 分析经病理确诊胃癌患者外周血mSEPT9基因检测结果与临床病理参数的关系,结果见表1。不同TNM分期患者的mSEPT9基因差异有统计学意义(P<0.05),但性别、淋巴结转移、病理分型、分化程度、浸润深度等mSEPT9基因差异无统计学意义(P>0.05)。
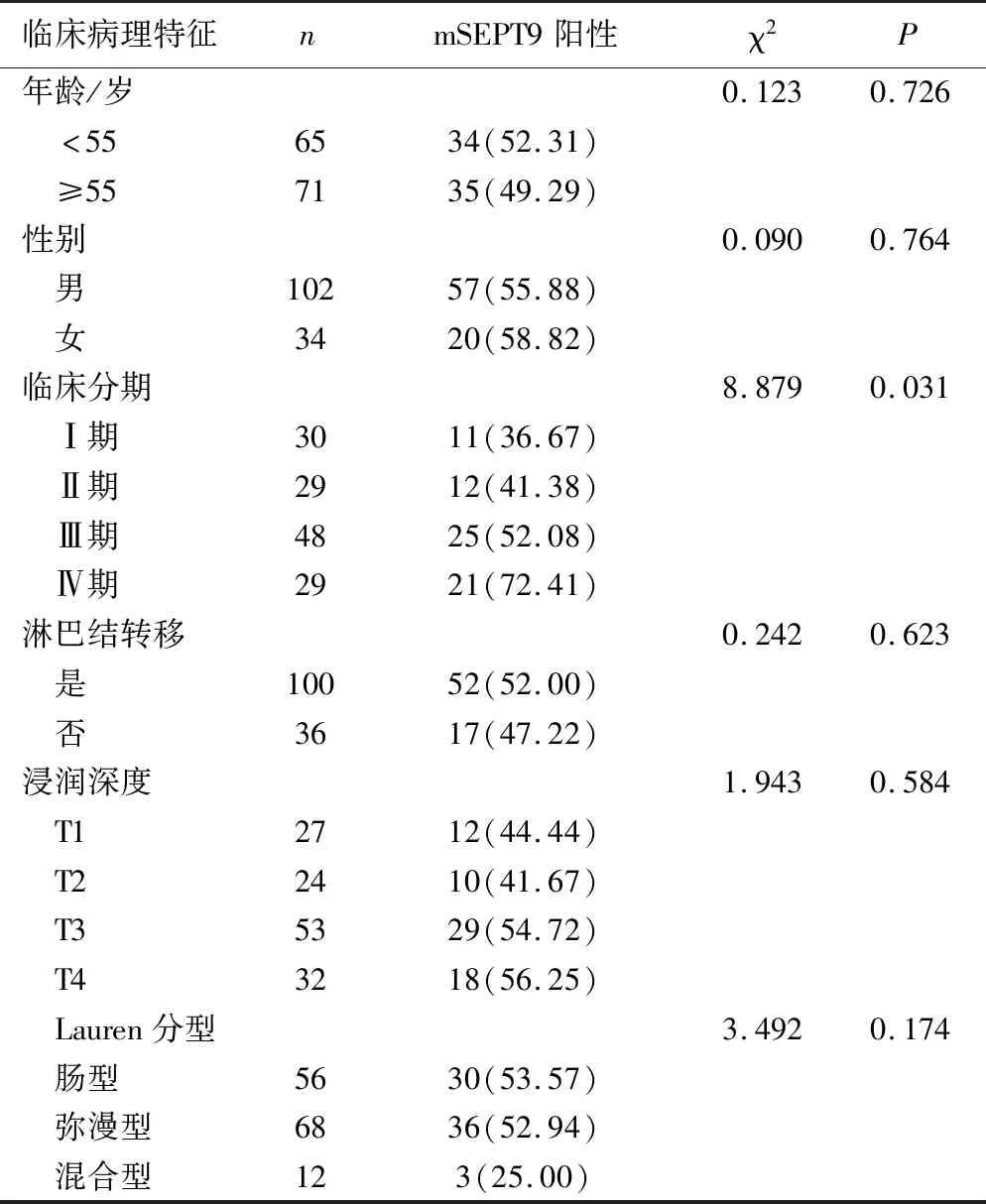
表1 胃癌患者外周血mSEPT9与临床病理参数关系
2.3 胃癌外周血mSEPT9检测与血清肿瘤标记物CEA、CA199、AFP阳性率的比较 在胃癌组中,外周血mSEPT9阳性率高于CEA、CA199、 AFP(Kappa值<0.4),见表2。联合外周血mSEPT9与CEA、CA199、 AFP行ROC曲线分析(AUC=0.730),联合指标未能改善胃癌的诊断价值(P>0.05)。但联合检测可提高胃癌诊断的灵敏度66.11%(90/136)。
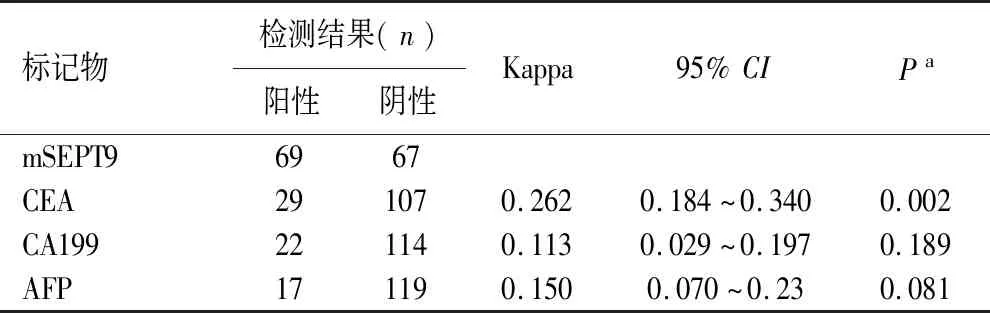
表2 胃癌患者外周血mSEPT9基因甲基化与CEA、AFP、CA199结果一致性的比较
2.4 胃癌患者外周血mSEPT9与生存期相关性分析 为了探究外周血mSEPT9在胃癌患者预测预后的价值,本研究对胃癌患者生成状态进行随访,并根据随访数据绘制了Kaplan-Meier生存曲线,见图2。外周血mSEPT9患者的生存率低于阴性患者(HR=0.471,95%CI:0.288~0.772,P=0.002),提示mSEPT9是胃癌患者的潜在危险因素和预后标志。
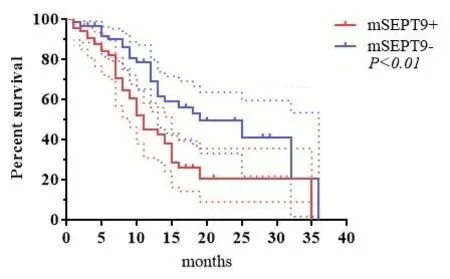
图2 不同mSEPT9表达胃癌患者的生存曲线分析
3 讨论
早期胃癌无特殊体征和症状,大部分患者就诊时,疾病已经进展,患者预后相对较差。因此提高胃癌早期诊断率,对改善胃癌的预后具有重要的意义[9]。我国卫生部于2005年启动农村恶性肿瘤高发区癌症早诊早治项目,其中胃癌是重点防治对象。2012年城市癌症早诊早治项目也正式纳入国家重大公共卫生服务项目。目前,胃癌诊断手段主要有胃镜和血清学指标(常见肿瘤标志物等)。胃镜是有创检测,患者依从性较差,此外胃镜的可及性在基层仍不能满足需求。消化道常用肿瘤标记物如CEA、CA199和AFP也是临床辅助诊断胃癌的常用手段,但存在特异性和灵敏性不佳,难以实现胃癌的早期精准的诊断[10]。液体活检是近年来发展迅速的检测手段。其最大的优势就是微侵入性,通过采集外周血,分离血浆中游离的核酸达到检测目的。
DNA甲基化是哺乳动物基因组 DNA 后天修饰的主要途径之一,它对维持染色体的结构、X染色体的失活、基因印记和肿瘤的发生、发展都起重要的作用[11-12]。Septin9蛋白能够调节细胞成长,防止细胞分裂过快或以不受控制的方式进行分裂增殖,具有抑癌作用[13]。 Septin9-v2启动子发生甲基化后,基因转录被抑制,可使正常细胞的形态发生异常改变,极性丧失,进而发展为肿瘤[14]。研究表明[15],胃癌组织中Septin9甲基化比例异常升高,在肠型胃癌中高达83.30%。当肿瘤细胞发生凋亡坏死时,被甲基化Septin9随即释放入外周血。因此,通过检测外周血mSEPT9水平可以推测患胃癌的风险。本研究结果显示,胃癌患者外周血mSEPT9阳性率高于胃炎组和无疾病证据组提示外周血mSEPT9可作为胃癌临床诊断的有效指标。胃癌患者外周血mSEPT9检测的灵敏度较低(50.83%)与胃癌患者TNM分期有相关性,可能是因为肿瘤细胞释放的ctDNA,进入全身血液循环后被稀释,但随着疾病的进展,肿瘤获得优势生长,其释放到外周血的ctDNA量增多,mSEPT9检测的阳性率也得到提高。胃癌患者外周血mSEPT9在低龄组(<55 y)和Lauren分型肠型组中阳性率较高,但差异无统计学意义,这需要更大的样本数量以便进一步分析。mSEPT9诊断效能高于消化道血清学标物CEA、CA199、AFP,但mSEPT9检测联合CEA、 CA199、AFP三者或与其中任一种指标,均未能有效提高诊断效能,这与文献报道相符[16-17],但联合检测有利于提高胃癌诊断的灵敏度。在对胃癌患者临床随访中发现,胃癌mSEPT9检测阳性组生存期低于阴性组,这提示mSEPT9检测对评估胃癌患者预后有较好的指导作用。
综上所述,外周血mSEPT9检测可作为胃癌诊断与判断预后的候选标志物之一,但mSEPT9在胃癌的复发、转移等机制仍需进一步研究。在高危人群中,外周血mSEPT9检查可作为有胃癌诊断与判断预后的补充手段。

