毛竹PeCIGRs 基因的克隆及表达分析
兰智鑫,侯 丹,吴蔼民,林新春
(1.浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300;2.华南农业大学 林学与风景园林学院,广东 广州 510642)
毛竹Phyllostachysedulis属禾本科Poaceae 竹亚科Bambusoideae 刚竹属Phyllostachys,具有快速生长的特性,最高日生长量超过1 m[1-2],是中国生长最快的植物之一。同时,毛竹也是中国竹类植物中分布最广的竹种,约占中国竹资源总面积的3/4[3]。此外,毛竹的茎秆木质化程度高,柔韧性好,在木材加工等方面被广泛应用,因而还具有重要的经济价值[4]。近年来,随着竹类植物,特别是毛竹的速生特性、高经济价值等优势逐渐凸显,以毛竹为主的竹资源研究备受关注,对毛竹快速生长机制的研究较为深入。一方面是激素、miRNA 和基因等内在机制对竹子高生长的调控[1,5-6],如CHEN 等[7]研究表明:赤霉素(GA)是调控毛竹节间伸长的主要激素;另一方面是包括干旱、高盐等逆境胁迫对竹子高生长的影响,如毛美红等[8]的研究指出:干旱胁迫会显著影响毛竹新竹的胸径和株高。尽管对毛竹高生长机制的研究已涵盖了多个方面,但相比其他物种(如模式植物拟南芥Arabidopsisthaliana),对毛竹高生长分子机制的研究仍处在起步阶段,因而探究基因对毛竹茎秆发育的作用研究十分必要,对毛竹以及其它竹资源的可持续发展有重要意义。
CIGR基因属于GRAS 转录因子家族。GRAS 家族是植物特有的一类转录因子且高度保守,已在拟南芥、水稻Oryzasativa、玉米Zeamays、高粱Sorghumbicolor、毛竹等多个物种中被鉴定[9-12],并依据序列、结构以及进化关系上的差异将该家族进一步划分为包含DELLA、HAM、PAT1 等在内的共17 个亚家族[13]。此外,功能研究表明:GRAS 家族参与植物生长发育、非生物胁迫响应等多种生物过程和分子功能的调控[14-16],如杨树Populuseuphratica的PeSCL7 过表达拟南芥后明显提高了抗盐和抗旱性[17]、拟南芥SCR突变后影响了根径向组织的分裂[18]。CIGR基因作为该家族成员之一,最早在水稻中被发现,并以参与调控病原体诱导的防御反应被熟知[19-20]。随后在多花黄精Polygonatumcyrtonema等物种中陆续被鉴定[21-22],并对其功能展开了进一步的探究。研究发现:该基因还参与调控茎秆伸长,如水稻中通过混合分组分析法(BSA)筛选到在染色体分布上同绿色革命基因sd1 紧密相连的候选基因CIGR,并发现该基因在高秆水稻的组织中高表达[23]。从植物分类学角度来看,毛竹与水稻同属于禾本科植物,参考水稻已有研究成果来探究毛竹相关机制具有重要的意义。为明确CIGR基因是否同样参与毛竹茎秆发育以及是否还参与逆境等非生物胁迫的响应,本研究利用文献中已鉴定的水稻CIGR基因[24]的序列在毛竹数据库中进行比对,得到4 条同源基因,结合克隆和组织特异性表达、逆境胁迫及植物生长调节剂响应分析初步对毛竹CIGR基因进行探究,以期为研究毛竹CIGR基因的功能与作用机制提供基础。
1 材料与方法
1.1 材料
本研究使用的克隆材料毛竹茎秆采自浙江省杭州市临安区毛竹林示范园区,取3 m 幼竹中部位置的节间样品速冻于液氮,保存于-80 ℃用于后续分析。
1.2 目的基因的克隆
根据毛竹数据库(http://www.bamboogdb.org/)获取4 个CIGR基因的编码序列(CDS),使用Oligo 7设计CDS 全长引物、引物序列(表1)。提取毛竹茎秆的RNA,并反转录为cDNA 作为模板,反应体系为10 μL,2×E-taqPCR Master Mix 酶5 μL、cDNA 1 μL、上下游引物各1 μL、ddH2O 补至10 μL。PCR 扩增程序为:95 ℃预变性3 min、95 ℃变性30 s、60 ℃退火30 s、72 ℃延伸120 s、34 个循环及72 ℃延伸5 min。琼脂糖凝胶获取扩增片段并回收,经载体连接及大肠埃希菌Escherichiacoli转化测序后获得阳性单菌落并保存于-80 ℃。
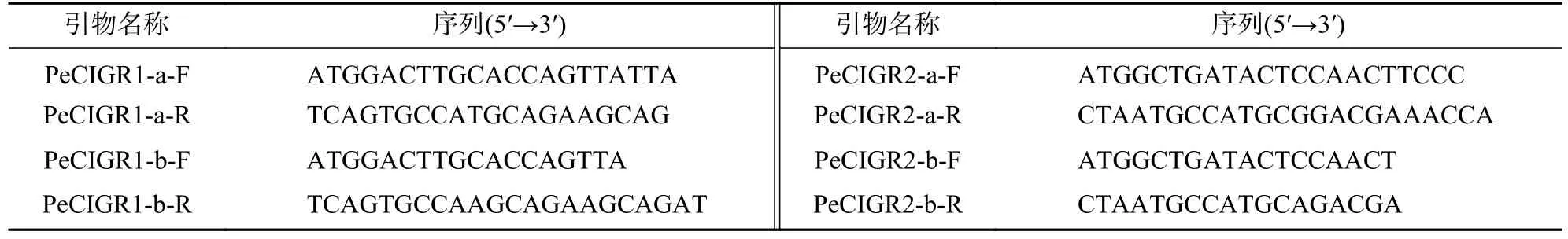
表1 基因克隆引物Table 1 Primers used in gene clone
1.3 生物信息学分析
利用DNAMAN 对克隆得到的CIGR基因进行序列比对。利用Expasy 在线软件 (https://web.expasy.org/protparam/) 及Plant-mPLoc 在线软件 (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对CIGR 蛋白理化性质和亚细胞定位进行分析和预测。利用Clustal X 进行同源氨基酸序列比对,ESPript 3.0 在线软件 (https://espript.ibcp.fr/ESPript/ESPript/) 用于多序列比对可视化。利用MEGA 7 的Neighbor-Joining 算法对多个物种的CIGR 蛋白序列进行系统进化树的构建。
1.4 组织表达特异性分析
从美国国家生物技术信息中心(NCBI) 获取毛竹26 个组织转录组数据[25],利用 Rstudio 软件对毛竹PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b基因在不同组织中的表达进行可视化分析。
1.5 非生物胁迫和植物生长调节剂处理分析
从NCBI 获取课非生物胁迫及植物生长调节剂处理转录组数据(GSE169067),包含了干旱(PEG)、盐(NaCl)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)处理。所有处理均为3 个生物学重复,取样的时间为0、3、24 h,利用Rstudio 软件完成毛竹PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b基因在非生物胁迫和植物生长调节剂处理下表达模式的可视化分析。
2 结果与分析
2.1 毛竹4 个CIGR 基因的克隆
PCR 扩增、凝胶电泳(图1)、PCR 产物回收及连接转化测序研究表明:毛竹PH02Gene08687、PH02Gene44779、PH02Gene17912、PH02Gene13317完整的编码区序列长度分别为1 707、1 716、1 635、1 638 bp,分别编码568、571、544、545 个氨基酸,与毛竹数据库序列比对一致。为便于后续研究分析,对上述基因进行重命名,依次为PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b。
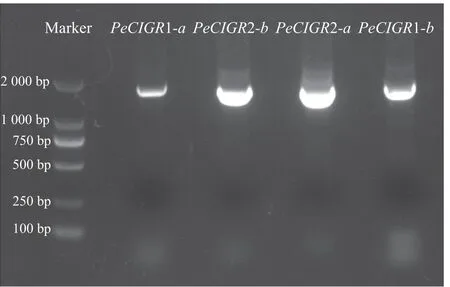
图1 PeCIGRs 基因克隆Figure 1 Cloning of PeCIGRs gene
2.2 PeCIGRs 蛋白多重序列比对及系统进化树分析
多序列比对发现:毛竹PeCIGRs 蛋白与小佛肚竹Bambusaventricosa、二穗短柄草Brachypodium distachyon、水稻等6 个物种CIGR 蛋白序列的C 端相似度较高,具有GRAS 蛋白典型的5 个保守区域:LRI 区域、VHIID 区域、LRII 区域、PFYRE 域及末端 SAW 区域,因而属于GRAS 蛋白家族成员(图2)[26]。为进一步明确毛竹PeCIGRs基因的功能,本研究利用毛竹、葡萄Vitisvinifera、小佛肚竹、水稻、二穗短柄草、高粱的CIGR 蛋白序列构建进化树,结果如图3 所示。整个进化树分成两大分支,其中PeCIGR1-a、PeCIGR1-b 和PeCIGR2-a、PeCIGR2-b 分别聚在2 条分支上。同其他物种聚类结果表明:毛竹PeCIGRs 蛋白与小佛肚竹、二穗短柄草、水稻CIGR 蛋白进化关系更近。综上推测,毛竹PeCIGRs 蛋白与小佛肚竹、二穗短柄草、水稻CIGR 蛋白在功能上可能具有相似性。
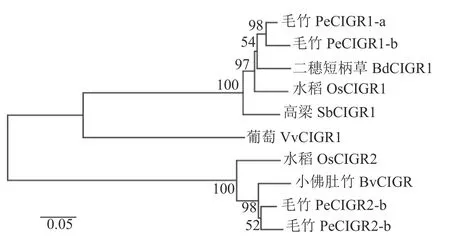
图3 不同物种CIGR 蛋白序列系统进化树分析Figure 3 Phylogenetic tree analysis of CIGR protein sequences of different species
2.3 PeCIGRs 蛋白的理化性质及亚细胞定位分析
表2 为PeCIGRs 蛋白的理化性质分析结果。PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b 蛋白的等电点为5.63~6.03,不稳定指数为44.1~49.91,疏水性为-0.437~-0.310。4 个CIGR 蛋白均为酸性亲水蛋白,且PeCIGR1-a、PeCIGR1-b 蛋白相较PeCIGR2-a、PeCIGR2-b 蛋白更稳定。亚细胞定位预测表明:毛竹4 个CIGR 蛋白都定位于细胞核,与水稻CIGR 蛋白定位一致[19]。

表2 PeCIGRs 蛋白理化性质及亚细胞定位分析Table 2 Analysis of physicochemical properties and subcellular localization of PeCIGRs protein
2.4 PeCIGRs 基因启动子顺式作用元件分析
PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b启动子上游2 000 bp 顺式作用元件预测结果(表3~6)表明:4 条基因启动子序列除包含TATA-box 和CAAT-box 等核心启动元件外,还包含与光响应相关的元件,如3-AF1 binding site、ACE、Box 4;与激素相关的元件,如脱落酸响应元件ABRE、赤霉素响应元件(GARE-motif);与胁迫相关的元件,如低温响应元件(LTR)、干旱响应元件(MBS)以及分裂相关的元件(CAT-box)。上述结果表明:PeCIGRs基因可能参与调控毛竹分裂生长、光信号响应、植物生长调节剂和胁迫诱导等多种生物途径。

表3 PeCIGR1-a 基因启动子顺式作用元件分析Table 3 Cis-element analysis of PeCIGR1-a gene promoter
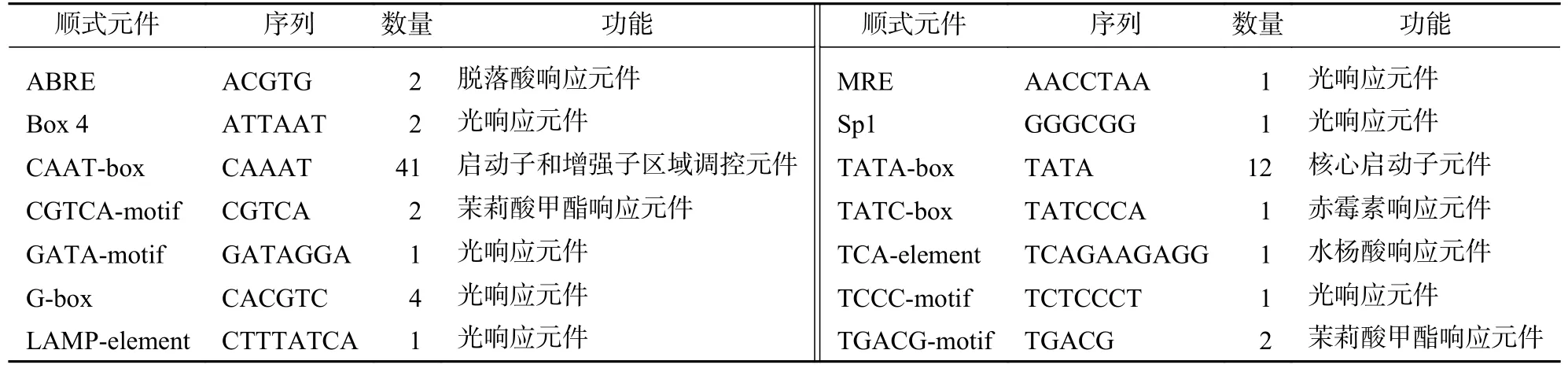
表4 PeCIGR1-b 基因启动子顺式作用元件分析Table 4 Cis-element analysis of PeCIGR1-b gene promoter
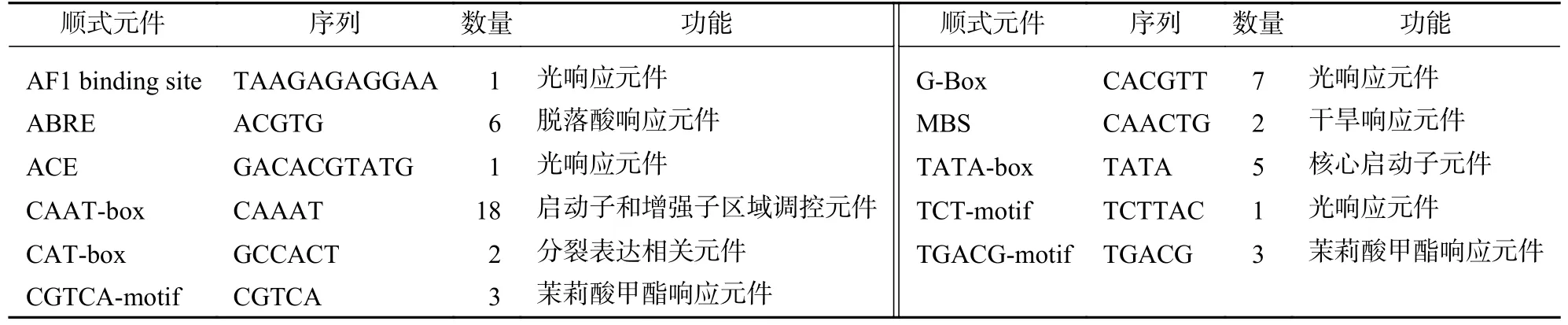
表5 PeCIGR2-a 基因启动子顺式作用元件分析Table 5 Cis-element analysis of PeCIGR2-a gene promoter

表6 PeCIGR2-b 基因启动子顺式作用元件分析Table 6 Cis-element analysis of PeCIGR2-b gene promoter
2.5 PeCIGRs 基因在不同组织中的表达模式
通过分析PeCIGRs基因在毛竹不同部位以及不同组织的表达模式发现(图4):PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b在不同发育阶段毛竹茎秆中的表达高于其他组织,如叶片、叶鞘、箨片、鞭、根以及不同部位的芽,且4 个基因的表达峰值都集中在3 m 高的幼竹顶部。此外,在茎秆的其他发育阶段中,PeCIGR1-a、PeCIGR1-b基因主要在1.5 m 幼竹底部、顶部高表达;PeCIGR2-a、PeCIGR2-b则主要在6.7 m 幼竹的底部、中部高表达。综上表明,PeCIGRs基因可能在毛竹茎秆发育中发挥着重要的作用。
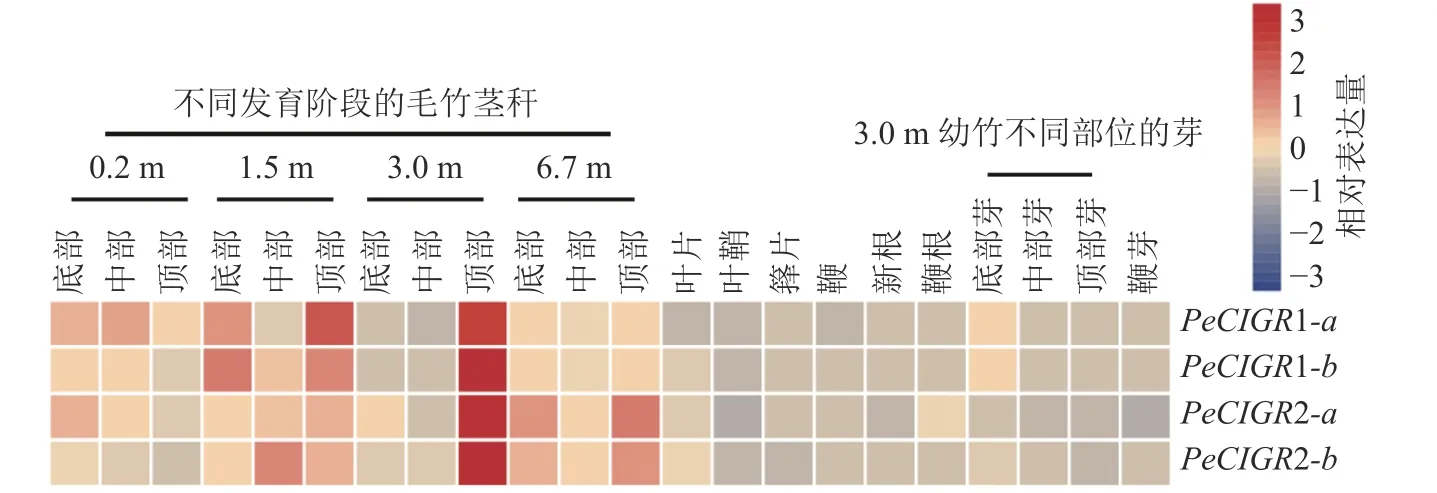
图4 毛竹PeCIGRs 在不同组织中的表达模式Figure 4 Expression patterns of PeCIGRs in different tissues
2.6 PeCIGRs 基因在非生物胁迫和植物生长调节剂处理下的表达模式
通过分析PeCIGRs基因在非生物胁迫(盐、干旱)和植物生长调节剂处理(脱落酸、水杨酸)下的表达模式发现(图5):PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b在盐、干旱、水杨酸处理中表达模式一致,均呈现先升高后下降的变化趋势。在脱落酸处理中,4 个CIGR基因呈现2 种不同的表达模式,其中PeCIGR1-a、PeCIGR1-b是在处理3 h 后明显上调,在24 h 后表达下调,而PeCIGR2-a、PeCIGR2-b基因在处理后3 h 没有明显变化趋势,在处理24 h 后表现出下调的趋势。综上所述,PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b对盐、干旱胁迫具有强烈的响应,对水杨酸、脱落酸具有一定的应答作用。
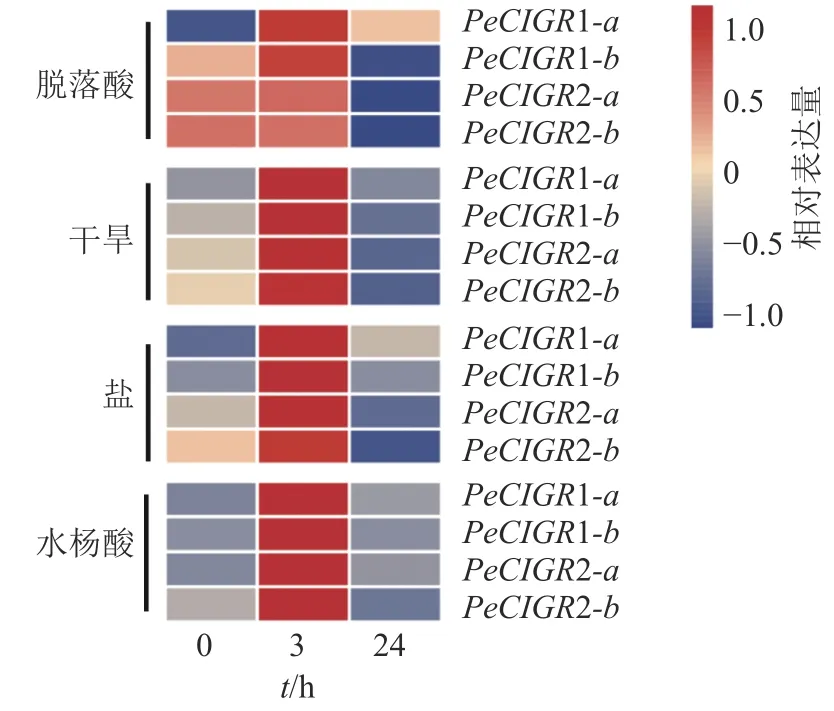
图5 毛竹 PeCIGRs 在非生物胁迫和植物生长调节剂处理下的表达模式Figure 5 Expression patterns of PeCIGRs in abiotic stresses and hormonal treatment
3 讨论
基因调控在竹子快速生长中扮演着重要的角色,如参与细胞壁合成的CesAs基因、参与响应激素的PheSAUR29 基因等[27-28]。现有竹子基因层面的研究多参考水稻等模式植物展开,如毛竹PeGA20ox1 基因,是与水稻、二穗短柄草等物种进行比对后得到的同源性较高的基因,该基因通过异源转入拟南芥后显著增加了株高和节间长度[29]。本研究同样是在水稻茎秆发育研究中发现了1 个与茎秆伸长密切相关的基因CIGR,该基因是赤霉素应答基因,在光信号转导[21]、赤霉素(GA)信号转导[20]以及茎秆发育[23]等途径都参与调控。为探究该基因在毛竹生长发育等途径中是否参与调控,本研究通过克隆及表达分析等方法对毛竹CIGR基因展开初步探究。
除在水稻中被报道外,CIGR基因也在其他物种中被发现参与调控节间伸长和茎秆发育。如小佛肚竹的BvCIGR基因异源转入水稻后引起了株高和节间的伸长[30];白花虎眼万年青Ornithogalumthyrsoides QtCIGR1 异源转入烟草Nicotianatabacum中后显著提升节间长度[22]。与此结果相似,在分析CIGR基因在毛竹不同部位的表达情况时发现,该基因主要表达在茎秆中;在分析毛竹茎秆不同发育阶段时发现,该基因在3 m 茎秆顶部的表达量最高,该时期处于竹子的速生期[31]。此外,在多物种CIGR 蛋白进化系统分析及序列比对分析中还发现:毛竹CIGR 蛋白与小佛肚竹、水稻的CIGR 蛋白序列具有较高的相似度。这进一步为参考水稻、小佛肚竹的CIGR 蛋白对毛竹相关功能进行研究提供了可靠性。综上,本研究参考与毛竹CIGR 蛋白具有高相似性的物种已有研究成果,初步分析了CIGRs基因在毛竹组织中的表达特征。结果表明:毛竹PeCIGRs基因参与毛竹茎秆发育,特别是在毛竹茎秆速生期中扮演着重要的角色。
毛竹生长喜温喜湿[32],因而干旱等其他环境因子或非生物胁迫对其生长有重要影响[33]。GRAS 家族在盐胁迫、干旱胁迫等非生物胁迫以及激素信号转导中也参与应答[34-36],如水稻OsGRAS23 过表达后提升了植物的抗旱性[37],山葡萄VitisamurensisVaPAT1 过表达拟南芥后显著提升了植物对寒冷、干旱以及盐等非生物胁迫的抗性[38]。为明确毛竹CIGR基因是否也参与非生物胁迫应答,本研究对毛竹CIGR基因启动子顺式作用元件进行了预测,发现与非生物胁迫(干旱、低温)和植物生长调节剂响应(脱落酸、水杨酸)相关元件的存在。在此基础上,本研究进一步对毛竹非生物胁迫和植物生长调节剂处理的表达模式进行分析,结果表明:PeCIGRs基因的确受到了盐、干旱、水杨酸的强烈诱导,且PeCIGR1-a、PeCIGR1-b和PeCIGR2-a、PeCIGR2-b分别在脱落酸处理的不同时间点也参与应答。这表明PeCIGRs基因在非生物胁迫响应和植物生长调节剂应答中发挥着重要作用。
4 结论
本研究从毛竹克隆得到4 条CIGR基因,依次命名为PeCIGR1-a、PeCIGR1-b、PeCIGR2-a、PeCIGR2-b。4 条基因序列都具有典型的GRAS 结构域,属GRAS 家族。组织特异性分析表明:4 条基因主要在速生期的茎秆顶部中表达,表明4 条基因在幼竹速生生长中参与调控。非生物胁迫和植物生长调节剂处理下PeCIGRs基因的表达模式表明:4 条基因在盐、干旱、水杨酸处理早期受到强烈的诱导,在脱落酸处理中,PeCIGR1-a、PeCIGR1-b和PeCIGR2-a、PeCIGR2-b分别在不同处理时间点参与应答,表明这4 条基因也参与毛竹对非生物胁迫的响应和植物生长调节剂的应答。

