红芪多糖对糖尿病胃轻瘫大鼠胃窦组织平滑肌细胞焦亡的影响
仲倩利,李荣科,万生芳,张倩,魏昭晖,郭倩,马欣欣,张磊,杨雅丽,张亚男
甘肃中医药大学,甘肃 兰州 730000
糖尿病胃轻瘫(diabetic gastroparesis,DGP)是糖尿病常见的消化系统并发症之一,以非梗阻因素所致的胃排空延迟为特点[1],主要表现为早饱、恶心、呕吐、腹胀、厌食等,严重降低患者生活质量。DGP发病机制复杂,有研究指出,细胞焦亡与糖尿病及其并发症进展有关[2],细胞焦亡引起的大量炎症因子释放是DGP重要病理环节。DGP属中医学“痞满”“呕吐”等范畴,其病机以脾虚为本,治当健脾益气,用药以补气健脾类药物为主[3]。红芪是补气中药,其主要活性成分红芪多糖有抗炎、抗氧化、免疫调节及延缓糖尿病并发症等作用[4]。课题组前期研究表明,红芪多糖能降低DGP大鼠血糖,调节血脂代谢,促进胃排空,增加胃激素含量,修复胃肠组织损伤,提高胃肠动力[5-7]。本实验观察红芪多糖对DGP大鼠胃窦组织平滑肌细胞焦亡的影响,深入探讨红芪多糖提升胃动力、促进胃排空的分子机制,为开发治疗DGP药物提供实验依据。
1 材料与方法
1.1 动物
SPF 级 雄性Wistar 大鼠60 只,6 周龄,体质 量(180±20)g,北京斯贝福生物科技有限公司提供,动物许可证号SCXK(京)2019-0010。饲养于甘肃中医药大学,温度22~25 ℃,相对湿度45%~50%。本实验经甘肃中医药大学实验动物中心动物伦理委员会审批(2021-804)。
1.2 药物及制备
红芪多糖,陕西省宝鸡市方晟生物开发公司制备,纯度72.4%,批号20200315。枸橼酸莫沙必利分散片,成都康弘药业集团股份有限公司提供,5 mg/片,批号190614。
1.3 主要试剂与仪器
链脲佐菌素(STZ,德国VETEC 公司,批号WXBD4971V),苏木素-伊红染液(江苏艾迪生物,批号B1003),TUNEL 试剂盒(瑞士Roche,批号11684817910),RNA提取试剂盒(上海翌圣生物,批号19221ES50),NOD 样受体蛋白3(NLRP3)抗体(美国ImmunoWay公司,批号YT5328),胱天蛋白酶-1(Caspase-1)抗体(美国ImmunoWa 公司,批号YT5743),焦孔素D(GSDMD)抗体(武汉三鹰,批号20770-1-AP),白细胞介素(IL)-1β 抗体(美国ImmunoWay公司,批号YT5201),GAPDH一抗(美国Affinity公司,批号AF7021),辣根过氧化物酶标记二抗(美国Affinity 公司,批号S0001),Super ECL Plus超敏发光液(北京普利莱,批号P10100)。血糖仪(罗氏卓越金采,型号Accu-Chek Performa),高速冷冻离心机(美国Thermo Fisher Scientific 公司,型号FRESCO 21),离心机(常州市金坛恒丰,型号XYJ80-2),包埋机(武汉俊杰,型号JB-P5),病理切片机(上海徕卡,型号RM2016),正置光学显微镜(日本尼康,型号Nikon Eclipse CI),倒置荧光显微镜(日本尼康,型号Nikon Eclipse Ti-SR),显微镜相机控制器(日本尼康,型号Nikon DS-U3),多功能酶标仪(瑞士Tecan公司,型号Infinite M200 Pro),实时定量PCR仪(美国Thermo公司,型号Varioskan Lux),摇床(海门市麒麟医用仪器厂,型号TS-92),凝胶电泳仪、转膜仪(美国Bio-Rad 公司,型号PowerPoc Basic),多功能分子成像系统(美国Azure Biosystems公司,型号c600)。
1.4 分组、造模及给药
60只大鼠适应性喂养1周后,随机选取10只作为空白组,剩余50只禁食不禁水24 h,一次性腹腔注射1%STZ溶液(溶于0.1 mol/L柠檬酸缓冲液,pH=4.5)50 mg/kg,空白组注射等体积柠檬酸缓冲液。72 h后尾静脉采血检测随机血糖,≥16.7 mmol/L且维持1周以上为糖尿病造模成功[5]。DM大鼠予高脂高糖饲料不规则喂养(单日上午进食、双日下午进食),连续喂养4周后检测随机血糖,≥16.7 mmol/L并伴有腹部胀大、体质量减轻等表现,随机抽取空白组和造模大鼠各2只处死,检测胃肌电活动,造模大鼠胃自主收缩频率较空白组显著降低提示DGP模型制备成功。将成模大鼠随机分为模型组、莫沙必利组及红芪多糖低、中、高剂量组,每组分别为11、8、9、9、8只。实验第6周开始给药,根据体表面积法及红芪多糖纯度计算等效剂量,莫沙必利组予枸橼酸莫沙必利分散片3.5 mg/kg灌胃,红芪多糖低、中、高剂量组分别予红芪多糖50、100、200 mg/kg灌胃(灌胃时将所需用量枸橼酸莫沙必利分散片和红芪多糖分别溶于2 mL纯净水),灌胃体积均为2 mL,空白组和模型组予等体积纯净水灌胃,每日1次,连续8周。给药期间空白组予普通饲料喂养,其余各组继续予高脂高糖饲料喂养,每2周尾静脉采血检测随机血糖并测量体质量。
1.5 指标检测
1.5.1 胃排空率检测
给药结束后,大鼠禁食24 h、禁水2 h,予50 mg/dL酚红溶液2 mL灌胃,20 min后10%水合氯醛腹腔注射(0.33 mL/100 g)麻醉,剖腹结扎贲门和幽门,取出整胃,沿胃大弯剪开,生理盐水冲洗胃内容物,定容至20 mL,加入0.5 mol/L氢氧化钠20 mL搅拌均匀,室温静置1 h,取5 mL上清液,加入20%三氯乙酸溶液0.5 mL去蛋白,3 500 r/min离心15 min,取上清液。另取酚红溶液2 mL,依次加入生理盐水18 mL、0.5 mol/L氢氧化钠20 mL、三氯乙酸溶液4 mL,搅拌均匀,作为标准品。多功能酶标仪波长560 nm 处测定吸光度(A值),计算胃排空率。胃排空率(%)=(标准品A值-样品A值)÷标准品A值×100%。
1.5.2 HE染色
取相同部位胃窦组织,放入固定液中固定,脱水,透明,石蜡包埋,切片(厚度4 μm),依次放入二甲苯Ⅰ20 min、二甲苯Ⅱ20 min、无水乙醇Ⅰ10 min、无水乙醇Ⅱ10 min、95%乙醇5 min、90%乙醇5 min、80%乙醇5 min、70%乙醇5 min,蒸馏水洗。Harris苏木素染6 min,自来水洗,1%盐酸乙醇分化,自来水冲洗,0.6%氨水返蓝,流水冲洗,伊红染液染色3 min,切片依次放入95%乙醇Ⅰ5 min、95%乙醇Ⅱ5 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min脱水透明,中性树胶封片。显微镜下观察,图像采集分析。
1.5.3 TUNEL染色
石蜡切片脱蜡至水,加蛋白酶K工作液(用PBS以1∶9稀释),37 ℃孵育30 min,PBS洗涤5 min×3次,加破膜工作液,常温孵育20 min,PBS 洗涤5 min×3次,取TUNEL 试剂盒内试剂1(TdT)和试剂2(dUTP)按2∶29混合,覆盖组织,切片放于湿盒内,37 ℃孵育2 h,PBS 洗涤5 min×3 次,加DAPI 染液,避光室温孵育10 min,PBS洗涤5 min×3次,切片甩干后用抗荧光淬灭封片剂封片。倒置荧光显微镜下观察并采集图像,每张切片随机挑选3个200倍视野拍照,绿色荧光细胞核为DNA损伤阳性细胞,蓝色细胞核为活细胞,计算细胞损伤率。细胞损伤率(%)=DNA损伤阳性细胞数÷活细胞数×100%。
1.5.4 RT-qPCR检测
称取大鼠胃窦组织100 mg于无酶EP管中,使用RNA提取试剂盒提取总RNA,反转录成cDNA,将所得cDNA样品分别配制RT-qPCR体系进行扩增。反应条件:95 ℃预变性30 s,95 ℃变性0.05 s,60 ℃退火34 s,共40个循环。以GAPDH为内参,2-ΔΔCt法计算目的基因相对表达量。引物由上海翌圣生物科技有限公司合成,引物序列见表1。
1.5.5 Western blot检测
取胃窦组织100 mg于EP管中,预冷生理盐水清洗,剪碎,加入蛋白裂解液,匀浆机70 Hz、180 s研磨,置于冰上裂解,每15 min进行一次反复晃动,2 h后,低温离心机4 ℃、12 000 r/min离心10 min,取上清液,BCA法测定蛋白浓度,上样,SDS-PAGE分离蛋白,将蛋白转至PVDF膜,5%脱脂奶粉室温封闭1 h,TBST洗膜6 min×4次,加入NLRP3、Caspase-1、IL-1β一抗(均为1∶500)、GSDMD 一抗(1∶2 000)、GAPDH一抗(1∶3 000),4 ℃孵育过夜,TBST洗膜6 min×4 次,滴加二抗(1∶3 000),室温孵育1 h,TBST洗膜6 min×4次,ECL发光液显色,多功能分子成像系统成像。采用Image J 1.4.8软件进行蛋白灰度分析,以目的蛋白与内参蛋白(GAPDH)灰度值比值计算蛋白相对表达量。
1.6 统计学方法
采用GraphPad Prism 8.0.1统计软件进行分析。计量资料以±s表示,进行正态性和方差齐性检验,符合正态分布且方差齐多组间比较采用方差分析,组间两两比较用t检验;不符合正态分布或方差不齐采用非参数秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 一般状况
造模时大鼠死亡3只,给药过程中模型组和红芪多糖低、中剂量组各死亡3、1、1只,最终空白组、模型组及红芪多糖各剂量组均剩余8只大鼠。空白组大鼠活跃,毛色光泽,垫料干燥;模型组大鼠懒动,喜卧扎堆,毛色黯淡,垫料潮湿;随着给药时间增加,各给药组大鼠一般状况逐渐好转,以红芪多糖高剂量组和莫沙必利组较为明显。
2.2 红芪多糖对模型大鼠随机血糖和体质量的影响
与空白组比较,给药各时点模型组大鼠随机血糖显著升高(P<0.01);与模型组比较,给药4周后红芪多糖高剂量组和莫沙必利组大鼠随机血糖显著降低(P<0.05),给药8周后红芪多糖各剂量组和莫沙必利组大鼠随机血糖显著降低(P<0.01)。见表2。
表2 各组大鼠不同时点随机血糖比较(±s,mmol/L)
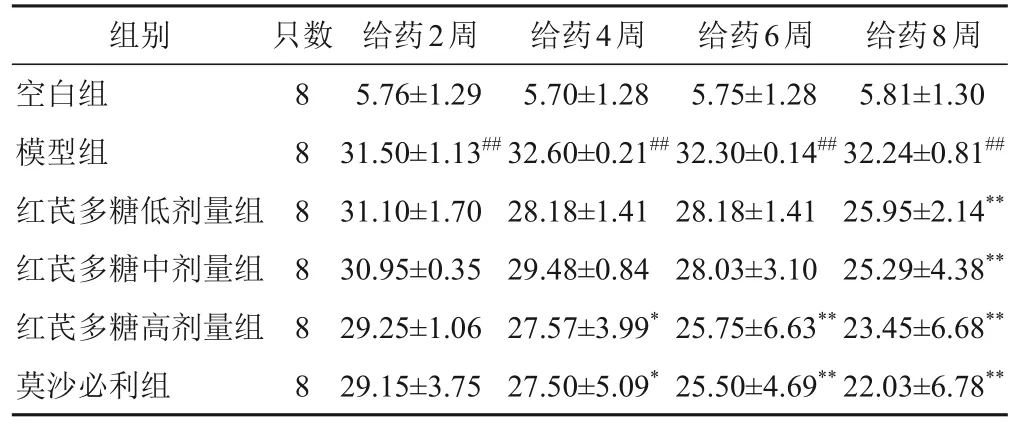
表2 各组大鼠不同时点随机血糖比较(±s,mmol/L)
注:与空白组同一时点比较,##P<0.01;与模型组同一时点比较,*P<0.05,**P<0.01
组别空白组模型组红芪多糖低剂量组红芪多糖中剂量组红芪多糖高剂量组莫沙必利组给药8周5.81±1.30 32.24±0.81##25.95±2.14**25.29±4.38**23.45±6.68**22.03±6.78**只数8 8 8 8 8 8给药2周5.76±1.29 31.50±1.13##31.10±1.70 30.95±0.35 29.25±1.06 29.15±3.75给药4周5.70±1.28 32.60±0.21##28.18±1.41 29.48±0.84 27.57±3.99*27.50±5.09*给药6周5.75±1.28 32.30±0.14##28.18±1.41 28.03±3.10 25.75±6.63**25.50±4.69**
与空白组比较,给药各时点模型组大鼠体质量显著减轻(P<0.01);与模型组比较,给药2周后红芪多糖高剂量组和莫沙必利组大鼠体质量显著增加(P<0.01),给药4周后红芪多糖中、高剂量组和莫沙必利组大鼠体质量显著增加(P<0.05,P<0.01),给药8周后红芪多糖各剂量组和莫沙必利组大鼠体质量显著增加(P<0.01)。见表3。
表3 各组大鼠不同时点体质量比较(±s,g)

表3 各组大鼠不同时点体质量比较(±s,g)
注:与空白组同一时点比较,##P<0.01;与模型组同一时点比较,*P<0.05,**P<0.01
给药8周480.84±47.79 229.51± 8.20##283.78±30.83**316.25±32.94**340.13±43.60**374.69±45.64**组别空白组模型组红芪多糖低剂量组红芪多糖中剂量组红芪多糖高剂量组莫沙必利组只数8 8 8 8 8 8给药2周429.56±44.93 278.81±25.10##291.08±12.22 317.49± 9.42 329.68±20.37**364.30±35.67**给药4周445.84±46.48 264.15±11.39##268.26±31.48 308.08±25.72*307.39±25.10*351.14±37.86**给药6周463.23±47.28 246.99±16.35##263.29±31.48 310.71±26.73**327.65±30.23**366.41±39.87**
2.3 红芪多糖对模型大鼠胃排空率的影响
与空白组比较,模型组大鼠胃排空率显著降低(P<0.01);与模型组比较,红芪多糖各剂量组和莫沙必利组大鼠胃排空率显著升高(P<0.01)。见表4。
表4 各组大鼠胃排空率比较(±s,%)
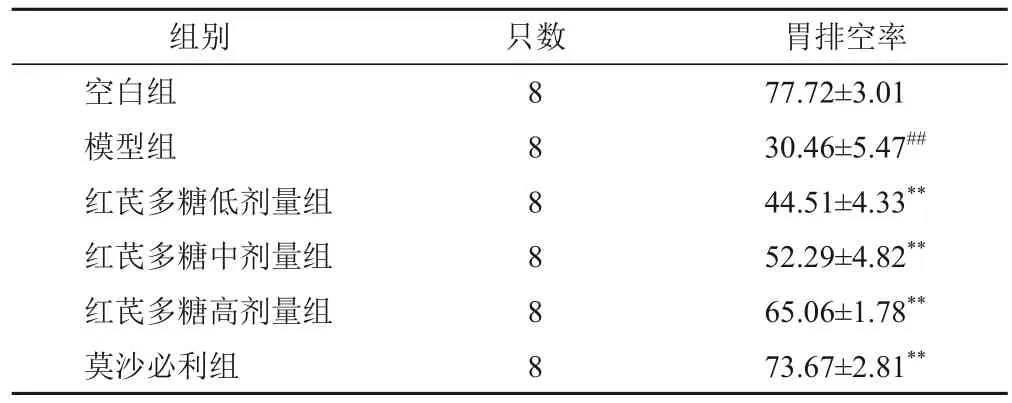
表4 各组大鼠胃排空率比较(±s,%)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
胃排空率77.72±3.01 30.46±5.47##44.51±4.33**52.29±4.82**65.06±1.78**73.67±2.81**组别空白组模型组红芪多糖低剂量组红芪多糖中剂量组红芪多糖高剂量组莫沙必利组只数8 8 8 8 8 8
2.4 红芪多糖对模型大鼠胃窦组织病理形态的影响
空白组大鼠胃窦组织腺体结构清晰,上皮细胞未见明显变性脱落,无炎性细胞浸润;模型组大鼠胃窦组织腺体结构破坏,细胞膜完整性丧失,大面积黏膜上皮细胞坏死脱落,有大量炎性细胞浸润;各给药组大鼠胃窦组织炎性细胞浸润减少,以莫沙必利组和红芪多糖高剂量组作用较显著。见图1。
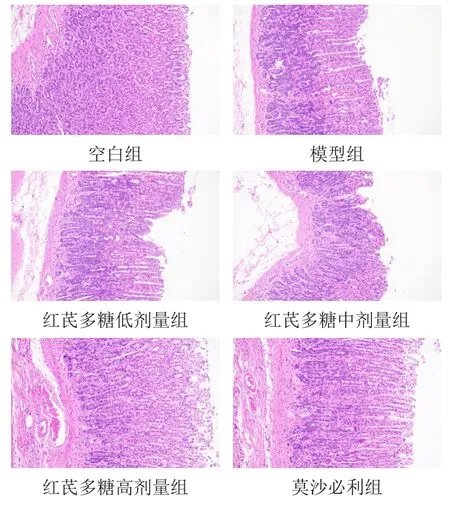
图1 各组大鼠胃窦组织形态(HE染色,×100)
2.5 红芪多糖对模型大鼠胃窦组织平滑肌细胞DNA损伤的影响
与空白组比较,模型组大鼠胃窦组织平滑肌细胞损伤率显著升高(P<0.01);与模型组比较,红芪多糖中、高剂量组和莫沙必利组大鼠胃窦组织平滑肌细胞损伤率显著降低(P<0.05,P<0.01)。见图2、表5。

图2 各组大鼠胃窦组织平滑肌细胞DNA损伤情况(TUNEL染色,×200)
表5 各组大鼠胃窦组织平滑肌细胞损伤率比较(±s,%)

表5 各组大鼠胃窦组织平滑肌细胞损伤率比较(±s,%)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
细胞损伤率1.94±0.02 18.87±4.96##9.76±9.28 7.27±1.97*3.69±1.47**3.42±0.42**组别空白组模型组红芪多糖低剂量组红芪多糖中剂量组红芪多糖高剂量组莫沙必利组只数8 8 8 8 8 8
2.6 红芪多糖对模型大鼠胃窦组织焦亡相关mRNA表达的影响
与空白组比较,模型组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β mRNA表达显著升高(P<0.05,P<0.01);与模型组比较,各给药组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β mRNA 表达显著降低(P<0.01)。见表6。
表6 各组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β mRNA表达比较(±s)

表6 各组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β mRNA表达比较(±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,**P<0.01
组别空白组模型组红芪多糖低剂量组红芪多糖中剂量组红芪多糖高剂量组莫沙必利组IL-1β 1.00±0.05 1.55±0.21##0.96±0.12**0.88±0.12**0.68±0.13**0.49±0.09**只数8 8 8 8 8 8 NLRP3 1.13±0.67 1.71±0.33##0.77±0.09**0.65±0.07**0.60±0.16**0.46±0.03**Caspase-1 1.00±0.10 1.48±0.33#0.88±0.01**0.57±0.03**0.45±0.02**0.20±0.01**GSDMD 1.00±0.08 1.47±0.21#0.80±0.15**0.52±0.03**0.27±0.05**0.21±0.05**
2.7 红芪多糖对模型大鼠胃窦组织焦亡相关蛋白表达的影响
与空白组比较,模型组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β 蛋白表达显著升高(P<0.05,P<0.01);与模型组比较,各给药组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β蛋白表达显著降低(P<0.05,P<0.01)。见图3、表7。

图3 各组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β蛋白免疫印迹
表7 各组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β蛋白表达比较(±s)

表7 各组大鼠胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β蛋白表达比较(±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别空白组模型组红芪多糖低剂量组红芪多糖中剂量组红芪多糖高剂量组莫沙必利组IL-1β 0.29±0.11 0.51±0.16##0.23±0.08**0.21±0.08**0.17±0.06**0.14±0.04**只数8 8 8 8 8 8 NLRP3 0.17±0.03 0.32±0.05#0.13±0.03*0.12±0.03*0.09±0.02**0.08±0.02**Caspase-1 0.30±0.06 0.48±0.06#0.21±0.08**0.19±0.05**0.15±0.01**0.09±0.02**GSDMD 0.20±0.07 0.39±0.11#0.19±0.04*0.14±0.01**0.09±0.02**0.08±0.01**
3 讨论
糖尿病是一种复杂的非感染性炎症性疾病,也是临床常见代谢性疾病,我国2 型糖尿病患病率达11.2%[8],其发病率高、并发症多、危害严重。糖尿病患者多伴有消化系统功能异常,其中最常见的是DGP,发病率占糖尿病的60%以上[9]。由于其发病较为隐匿,且早期多以消化道症状为主,因而极易被忽视。目前DGP发病机制尚未完全明确,多数学者认为DGP是在高血糖基础上由自主神经病变、Cajal间质细胞病变、胃肠激素分泌异常、胃肠平滑肌炎症、免疫系统及其他因素导致,胃平滑肌细胞损伤、胃肠肌运动功能减弱是其关键机制[10-11]。有研究发现,DGP患者胃肠组织存在广泛的炎性细胞浸润,炎症因子及炎症反应在DGP的发病过程中起着至关重要的作用[12-13]。
细胞焦亡是一种由Gasdermin蛋白介导的Caspase依赖的炎症性程序性细胞死亡方式,具有凋亡和坏死的特点,包括细胞核萎缩、DNA断裂和TUNEL染色阳性、细胞肿胀和破裂、炎症反应[14-15]。NLRP3、Caspase-1和GSDMD是细胞焦亡的核心因子,NLRP3能识别高糖、高脂等内源性损伤相关分子模式,与凋亡相关斑点样蛋白和Caspase-1前体组装成多蛋白复合体即NLRP3炎性小体,进而使Caspase-1活化,促进炎症因子IL-1β和IL-18加工和成熟,引发炎症级联反应,特异性切割GSDMD,产生具有细胞膜成孔活性的GSDMD-N片段,形成质膜孔,释放炎症因子和危险相关分子模式,引发细胞焦亡,激活下游炎症反应,导致细胞内渗透压增加,致使细胞肿胀裂解,进一步扩大免疫炎症反应[16-17]。
研究发现,细胞焦亡与糖尿病及其并发症的发生发展有关[18]。高脂喂养小鼠Caspase-1、NLRP3 和GSDMD水平明显升高,抑制脂肪细胞NLRP3炎性小体激活可改善胰岛素抵抗[19];Caspase-1 通过参与由NLRP3炎性小体调节的炎症反应影响糖尿病患者肾脏结构和功能[20];GSDMD介导的细胞焦亡会加速胰岛β细胞破坏,导致胰岛素抵抗[21]。NLRP3炎性小体激活后释放大量促炎因子IL-1β,导致胰岛素分泌异常,最终引发糖尿病[22]。基于此,可以认为NLRP3、Caspase-1、GSDMD和IL-1β与糖尿病及其并发症密切相关。DGP是糖尿病的重要并发症之一,胃肠平滑肌炎症是DGP 发生的重要机制,细胞焦亡的发生伴随大量炎症因子释放及持续的炎症反应,因此推测糖尿病持续的高糖高脂状态引发炎症级联反应,导致胃窦平滑肌细胞损伤,细胞焦亡,使胃动力减弱、胃排空减慢,进而引发DGP。
本实验结果发现,模型大鼠胃窦组织出现大面积黏膜上皮细胞坏死脱落,有明显炎性细胞浸润,同时胃窦组织平滑肌细胞出现细胞膜完整性丧失、DNA损伤显著增加,NLRP3、Caspase-1、GSDMD、IL-1β mRNA和蛋白表达显著升高,以上病理变化可能是导致大鼠血糖升高,体质量、胃排空率显著降低的原因;经药物干预后,各给药组大鼠状态明显好转,血糖显著降低,体质量、胃排空率显著升高,胃窦组织黏膜损伤程度减轻,胃窦组织平滑肌细胞DNA损伤减少,NLRP3、Caspase-1、GSDMD、IL-1β mRNA 和蛋白表达显著降低,提示胃平滑肌炎症及损伤减轻,胃动力有所恢复。
综上,红芪多糖能改善DGP大鼠一般状况,提高胃排空率,一定程度上减轻胃平滑肌炎症损伤、恢复胃动力,其机制可能与下调胃窦组织NLRP3、Caspase-1、GSDMD、IL-1β mRNA和蛋白表达,进而抑制细胞焦亡有关。关于红芪多糖调控细胞焦亡的深层分子机制,课题组将从代谢组学角度进一步研究。

