基于网络药理学与实验验证探讨青钱柳治疗糖尿病性脂肪肝作用及机制
刘艺璇 ,吴琴 ,张亚男 ,蔡昱哲 ,李定祥 ,邓奕辉
1.湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 410208;2.湖南中医药大学,湖南 长沙 410208
2021年国际糖尿病联盟发布的第十版全球糖尿病地图数据显示,目前我国有1.4亿成人糖尿病患者,预计到2045年将增至1.74亿[1]。非酒精性脂肪性肝病是糖尿病的独立危险因素[2]。《中国成人2型糖尿病合并非酒精性脂肪性肝病管理专家共识》推荐使用吡格列酮治疗,但慎用于伴心功能不全、水肿、骨折风险的患者,临床用药局限[3]。中药在降糖方面具有多成分、多靶点、多通路的作用特点,能够有效避免单一成分导致的不良反应[4]。
青钱柳Cyclocarya paliurus(Batal.)Iljinskaja 是一种药食同源植物,民间常以其叶作茶饮,有降糖功效。青钱柳调节糖脂代谢的药效作用物质基础及具体作用机制尚待阐明。通过网络药理学综合分析药物成分,有助于揭示某种特定疾病相关的靶点及通路[5]。本研究采用网络药理学方法对青钱柳防治糖尿病性脂肪肝的主要活性成分及潜在作用靶点进行预测分析,通过体内实验验证其靶点及信号通路,为进一步揭示其药效成分和药理作用提供依据。
1 材料与方法
1.1 网络药理学分析
1.1.1 药物化学成分收集与活性成分筛选
由于TCMSP(http://lsp.nwu.edu.cn/tcmsp.php)、中药材综合数据库(TCMID,http://www.megabionet.org/tcmid/)等数据库均未收录青钱柳相关关键词,故检索青钱柳相关文献获取其化学成分[6-9]。在PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载获取的成分,部分成分的分子结构通过ChemDraw20.0软件绘制,将全部成分的分子结构导入SwissADME平台(http://www.swissadme.ch/),以“GI absorption”项为“high”且“Druglikeness”至少2项“YES”为条件对化学成分进行筛选。将结果输入SwissTargetPrediction(http://www.swisstargetprediction.ch/)及Super-PRED(http://prediction.charite.de/)数据库获取潜在靶点。使用SwissTargetPrediction数据库获取小分子靶点,设定Probability≥0.05;分子量>200 者使用Super-PRED 数据库获取靶点。
1.1.2 药物活性成分-靶点网络构建
将筛选的活性成分重新编号,利用Cytoscape3.9软件构建青钱柳活性成分-作用靶点网络,分析其活性成分与靶点之间的作用关系。
1.1.3 疾病相关靶点及交集靶点获取
在CNKI学术翻译助手平台(https://dict.cnki.net/index)输入“2型糖尿病”“非酒精性脂肪肝”获取疾病英文词汇,分别得到type 2 diabetic mellitus、type 2 diabetes mellitus、type 2 diabetes、diabetes mellitus、type 2 diabetes,以及nonalcoholic fatty liver disease、nonalcoholic fatty liver、nonalcoholic steatohepatitis,将所得词汇分别输入TTD(http://bidd.nus.edu.sg/BIDD-Databases/TTD/TTD.asp)、DrugBank(http://www.drugbank.ca/atc) 及DisGeNET (https://www.disgenet.org/)数据库进行检索,将检索结果汇总后去重、取并集,再输入UniProt 数据库(https://uniprot.org/),设置 类 别 为“reviewed”“human”。采 用Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny/)对青钱柳作用靶点与疾病相关靶点取交集,即为青钱柳治疗糖尿病性脂肪肝的潜在作用靶点。
1.1.4 蛋白相互作用网络构建
将青钱柳治疗糖尿病性脂肪肝的潜在作用靶点导入STRING数据库(http://www.string-db.org/),设置参数为“Multiple proteins”“Homo sapiens”,置信度≥0.4,导出文件后利用Cytoscape3.9软件构建蛋白相互作用(PPI)网络。
1.1.5 GO和KEGG通路富集分析
利用DAVID 在线分析平台(https://david.ncifcrf.gov/)对交集靶点进行GO和KEGG通路富集分析,并利用微生信在线平台(http://www.bioinformatics.com.cn/)绘制GO分析条图及KEGG分析气泡图。
1.1.6 活性成分-共同靶点-信号通路网络构建与分析
使用Cytoscape3.9软件内置的merge功能取并集,构建药物活性成分-共同靶点-信号通路网络,节点表示青钱柳活性成分、靶点及通路,边表示化合物所关联的潜在靶点和通路。利用Network Analyzer功能进行网络模型特征分析,得到连接度(degree)、网络密度等参数,获取核心活性成分及靶点。
1.2 实验验证
1.2.1 动物、试药与仪器
SPF级SD雄性大鼠36只,体质量(210±10)g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号SCXK(湘)2019-0004,分笼饲养于湖南中医药大学动物中心实验室,通风良好,每日12 h照明,相对湿度(50±5)%,温度25 ℃,自由进食饮水。本实验经湖南中医药大学动物伦理委员会审查批准(LL2022022306)。
青钱柳由湖南省中医药研究院中药研究所提供,经湖南中医药大学翦雨青研究员鉴定为胡桃科植物青钱柳Cyclocarya paliurus(Batal.)Iljinskaja 的干燥叶。青钱柳水提物制备方法:取1 kg 青钱柳,加入12倍水,煮沸2 h,过滤,滤渣再加10倍水,煮沸1 h,合并2次滤液,旋转蒸发仪浓缩,得浓缩液1 L(1 mL浓缩液含1 g原药材),于4 ℃冰箱保存备用。盐酸吡格列酮片(杭州中美华东制药有限公司,批号2101401A),于研钵中碾成粉末后溶于生理盐水,配制成1 mg/mL药液。
Anti-mTOR(phospho S2448)抗体、Anti-Akt1(phospho S124)抗体(英国Abcam公司,货号分别为ab109268、ab81283),Akt1抗体、m-TOR抗体、PI3K抗体、GAPDH抗体(美国Proteintech公司,货号分别为10176-2-AP、66888-1-Ig、20584-1-AP、10494-1-AP),p-PI3K抗体(北京博奥森公司,货号bs-5570r),HRP 标记山羊抗兔二抗(中国Abiowell 公司,货号AWS0002),ECL Plus超敏发光液(中国Abiowell公司,货号AWB0005),显影液、定影液(中国上海佳信公司,货号分别为BW-61、BW-62),苏木素染液、电镜固定液(武汉赛维尔生物科技有限公司,货号分别为G1004、G1102),812 包埋剂(SPI 公司,货号90529-77-4)。
Chemray 800全自动生化分析仪(深圳雷杜生命科技),BioPrep-24 生物样品均质仪(中国杭州奥盛),ChemiScope 6100 化学发光成像系统(中国勤翔),Epoch酶标检测仪(美国BioTek),HT7800/HT7700透射电子显微镜(日本HITACHI)。
1.2.2 造模
30 只SD 大鼠予高脂高糖饲料(59%普通饲料、18%猪油、20%蔗糖和3%蛋黄)喂养,并于第4周末腹腔注射链脲佐菌素35 mg/kg诱导2型糖尿病模型,72 h后尾部取血,用血糖仪测定血糖,以空腹血糖≥16.7 mmol/L为模型制备成功。成模率为70%,共纳入21只成模大鼠。1周后,随机选取3只大鼠进行肝脏组织HE染色,可见肝脏脂肪变性。血糖指标与肝脏病理变化均满足上述条件者即为糖尿病性脂肪肝模型[10-11]。
1.2.3 分组及给药
将18 只成模大鼠根据体质量随机分为模型组、吡格列酮组(10 mg/kg)、青钱柳组(0.54 g/kg),每组6只。6只普通饲料喂养大鼠作为空白组。青钱柳临床推荐用量70 kg成人为6 g/d,按人与大鼠体表面积折算,大鼠给药剂量为0.54 g/kg。各给药组予相应药物灌胃,空白组灌胃生理盐水,体积均为1 mL/100 g,每日1次。4周后取材并检测相关指标。
1.2.4 血脂、血糖、肝功能指标检测
用10%戊巴比妥钠腹腔注射麻醉大鼠,仰卧位固定,从腹正中线皮肤切开腹腔,腹主动脉取血4 mL,4 ℃、3 500 r/ min离心15 min,分离血清,按试剂盒说明书,采用全自动生化分析仪分别测定血脂[总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)]、血糖[血糖(GLU)、糖化血清蛋白(GSP)]及肝功能指标[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)]。
1.2.5 HE染色
腹主动脉取血后,用眼科剪沿大鼠肝脏外缘取下完整肝脏,置于4 ℃生理盐水中浸洗,在冷冻台上用刀片切取右叶肝组织并固定于4%多聚甲醛中,24 h后将肝组织依次进行脱水、石蜡包埋、切片、染色及封片,镜下观察并采集图像进行分析。
1.2.6 透射电镜观察自噬体
将大鼠肝组织置于预冷好的冷冻机上,生理盐水冲洗后分离右叶组织,切取1 mm×1 mm×1 mm 组织块,固定于2.5%戊二醛溶液中,经锇酸固定、梯度脱水、浸透、包埋、切片、修切、染色后,在透射电镜下观察肝细胞形态及自噬体。
1.2.7 Western blot检测关键靶点蛋白表达
取大鼠肝组织,迅速放入-80 ℃冰箱中冻存,实验前取出解冻,取黄豆大小,放入1.5 mL EP管中,加入蛋白裂解液提取总蛋白,利用蛋白测定试剂盒检测蛋白含量。以40 μg 蛋白/泳道上样,经SDS-PAGE 后,湿转法转膜至PVDF 膜,加PI3K 一抗(1∶1 000)、Akt1 一抗(1∶5 000)、mTOR 一抗(1∶5 000)、p-PI3K 一抗(1∶2 000)、p-Akt1 一抗(1∶5 000)、p-mTOR一抗(1∶5 000)、GAPDH一抗(1∶5 000),置于4 ℃冰箱中孵育过夜,TBST 洗涤3 次,每次10 min,加HRP标记二抗孵育。按1∶1比例配制化学发光液,将膜放在曝光板上,膜上滴适量发光液,将曝光后的底片用Quantity One专业灰度分析软件进行分析,以GAPDH 为内参,计算关键靶点蛋白相对表达量。
1.2.8 统计学方法
采用SPSS26.0 统计软件进行分析。计量资料满足正态分布以±s表示,组间比较采用方差分析;不满足正态分布用M(QR)表示,组间比较采用独立样本非参数检验。P<0.05表示差异有统计学意义。
2 结果
2.1 网络药理学分析结果
2.1.1 青钱柳活性成分及有效靶点
通过查阅文献共获得青钱柳化学成分124个,运用SwissADME平台筛选后保留活性成分46个,并对其进行重新编号,见表1。使用SwissTargetPrediction 及Super-PRED 数据库获取活性成分靶点,经筛选、汇总、去重后,共获得599个靶点。

表1 青钱柳活性化合物
2.1.2 青钱柳活性成分-靶点网络
将青钱柳活性成分和有效靶点数据导入Cytoscape3.9进行网络构建,获得的药物活性成分-靶点网络共包含646个节点、2 169条边。基于此网络进行分析,degree 值前6 位活性成分为pterolactone、5S-5-羟基-1-(4-羟基-3-甲氧基苯基)-7-(4-羟苯基)-3-庚酮、六氢姜黄素、槲皮素、山柰酚、3,6,3',5'-四甲氧基-5,7,4'-三羟基黄酮醇,degree值分别为108、107、104、104、104、104,推测上述成分可能是青钱柳的重要活性成分。
2.1.3 疾病相关靶点及交集靶点
通过TTD、DrugBank 及DisGeNET 数据库得到2 型糖尿病相关靶点2 382个,去重后为2 195个;非酒精性脂肪肝相关靶点829个,去重后为816个。将疾病相关靶点与599个青钱柳靶点取交集,得到共同靶点101个。
2.1.4 蛋白相互作用网络
将101 个交集靶点导入STRING 平台构建PPI 网络,并使用Cytoscape软件进行可视化分析。该网络共101个节点、1 053条边,平均节点度为20.851,聚类系数为0.598,见图1。靶蛋白节点越大、颜色越深其degree值越高,表明该靶点越重要。计算靶点degree值及中介中心度(BC)、接近中心度(CC),以三者均不低于其相应中位数(degree≥15、BC≥0.001 8、CC≥0.607 1)为条件进行筛选,得到青钱柳治疗糖尿病性脂肪肝的关键靶点15 个,分别为PPARG、MTOR、

图1 青钱柳治疗糖尿病性脂肪肝核心靶点PPI网络
PPARA、AKT1、STAT3、EGFR、TLR4、VEGFA、HIF1A、 MMP9、 IL6、 TNF、 CASP3、 PTGS2、ESR1。其中degree值最高的是AKT1,能与70个蛋白发生相互作用,可能发挥重要作用。将上述关键靶点名称输入DisGeNET数据库,获得关键靶点的拓扑性质信息,见表2。
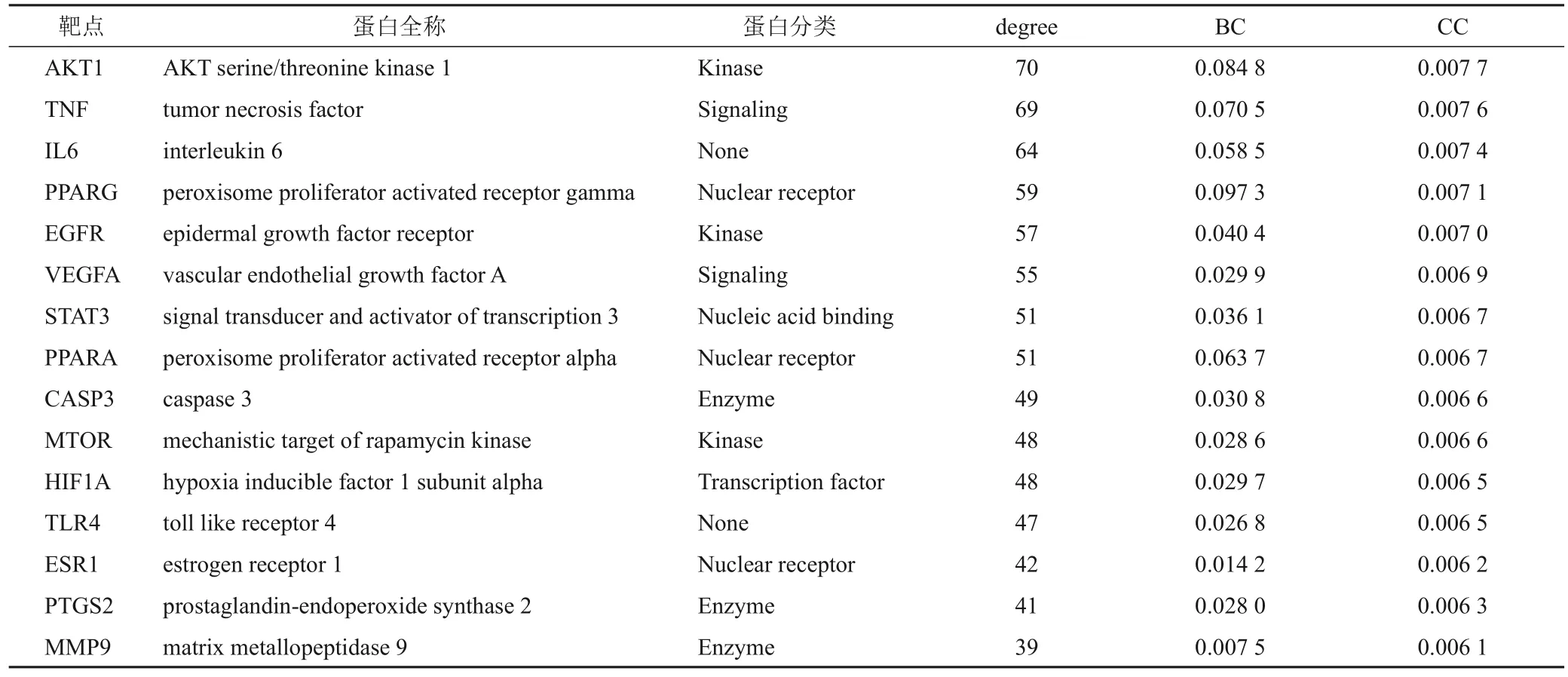
表2 青钱柳治疗糖尿病性脂肪肝关键靶点及其拓扑性质
2.1.5 GO和KEGG通路富集分析结果
对15个关键靶点进行GO功能富集分析,得到270个条目,以P<0.05、FDR<5%为条件,共筛选出81个条目,包括66个生物过程(Biological process)、2个细胞 组 分(Cellular component)、 13 个 分 子 功 能(Molecular function)。主要生物过程包括蛋白结合(protein binding)、RNA聚合酶Ⅱ启动子转录的正调控(positive regulation of transcription from RNA polymerase Ⅱ promoter)、细胞因子介导的信号通路(cytokine-mediated signaling pathway)、基因表达的正调控(positive regulation of gene expression)、转录的正调控及DNA模板化(positive regulation of transcription,DNA-templated)、平滑肌细胞增殖的正调控(positive regulation of smooth muscle cell proliferation)、炎症反应(inflammatory response)、肽基-丝氨酸磷酸化的正调节(positive regulation of peptidyl-serine phosphorylation)、对缺氧的反应(cellular response to hypoxia)、基因表达的负调控(negative regulation of gene expression)、凋亡过程的正调控(positive regulation of apoptotic process)、凋亡过程的负调控(negative regulation of apoptotic process)、RNA聚合酶Ⅱ启动子转录的负调控(negative regulation of transcription from RNA polymerase Ⅱpromoter)等;主要细胞组分包括大分子复合体(macromolecular complex)与细胞质(cytoplasm);主要分子功能包括相同的蛋白质结合(identical protein binding)、酶的结合(enzyme binding)、RNA聚合酶Ⅱ转录因子活性及配体激活的序列特异性DNA结合(RNA polymerase Ⅱ transcription factor activity, ligandactivated sequence-specific DNA binding)、NO合成酶调节活性(nitric-oxide synthase regulator activity)、蛋白质结构域特异性结合(protein kinase binding)、转录因子结合(transcription factor binding)、RNA聚合酶Ⅱ抑制转录因子的结合(RNA polymerase Ⅱ repressing transcription factor binding)、转录辅助因子结合(transcription coactivator binding)、转录因子活性及序列特 异 性DNA 结 合(transcription factor activity,sequence-specific DNA binding)、蛋白磷酸酶结合(protein phosphatase binding)、蛋白质结合(protein binding)、转录激活活性(transcriptional activator activity)、RNA聚合酶Ⅱ转录调节区域序列特异性结合(RNA polymerase Ⅱ transcription regulatory region sequence-specific binding)。见图2。

图2 青钱柳治疗糖尿病性脂肪肝关键靶点GO富集分析
对15个关键靶点进行KEGG通路富集分析,以P<0.05为条件,共筛选出89个信号通路,前21条通路见图3。靶点数靠前的信号通路为糖尿病并发症中的AGE-RAGE信号通路(AGE-RAGE signaling pathway in diabetic complications Insulin resistance)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、TNF信号通路(TNF signaling pathway)、丙型肝炎(Hepatitis C)、胰岛素抵抗(Insulin resistance)、阿尔茨海默病(Alzheimer disease)、脂肪细胞因子信号通路(Adipocytokine signaling pathway)、HIF-1 信号通路(HIF-1 signaling pathway)、脂质和动脉粥样硬化(Lipid and atherosclerosis)、癌症的途径(Pathways in cancer)等。可见,青钱柳治疗糖尿病性脂肪肝是多靶点、多通路相互影响的结果。

图3 青钱柳治疗糖尿病性脂肪肝关键靶点KEGG通路富集分析
2.1.6 活性成分-共同靶点-信号通路网络
利用Cytoscape3.9软件构建青钱柳治疗糖尿病性脂肪肝活性成分-共同靶点-信号通路网络。其中degree值较大的成分是5S-5-羟基-1-(4-羟基-3-甲氧基苯基)-7-(4-羟苯基)-3-庚酮、2α-羟基乌苏酸、六氢姜黄素、2α, 3α, 20β, 23-tetrahydroxyurs-12-en-28-ursolic acid、2a-羟基熊果酸,degree值较大的靶点有STAT3、AKT1、MTOR、TLR4、PIK3CA、EGFR等,见表3。

表3 青钱柳治疗糖尿病性脂肪肝核心活性成分及靶点
2.2 实验验证结果
2.2.1 青钱柳对模型大鼠一般情况的影响
空白组大鼠反应灵活,毛发光泽,粪便、尿液正常;模型大鼠反应欠灵敏、皮毛晦黯无光泽,尿量明显增多并有烂苹果味,部分出现显著的“三多一少”表现;与模型组比较,青钱柳组大鼠一般情况明显改善。与空白组比较,模型组大鼠体质量、肝湿重明显升高;与模型组比较,青钱柳组大鼠体质量、肝湿重明显下降,差异均有统计学意义(P<0.05)。见表4。
表4 各组大鼠体质量、肝湿重比较(±s,g,每组6只)

表4 各组大鼠体质量、肝湿重比较(±s,g,每组6只)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
肝湿重17.50±1.04 28.00±2.67*19.60±0.87#20.39±1.80组别空白组模型组青钱柳组吡格列酮组体质量461.50± 9.98 582.00±13.42*463.00±40.34#480.75±38.40
2.2.2 青钱柳对模型大鼠血脂、血糖、肝功能指标的影响
与空白组比较,模型组大鼠TC、LDL、GLU、GSP、ALT、AST含量明显升高,差异有统计学意义(P<0.05);与模型组比较,吡格列酮组大鼠LDL、GLU、GSP、ALT、AST含量下降,青钱柳组大鼠TC、GLU、GSP、ALT、AST含量下降,差异均有统计学意义(P<0.05)。见表5。

表5 各组大鼠血脂、血糖、肝功能指标比较
2.2.3 青钱柳对模型大鼠肝组织形态的影响
正常组大鼠肝细胞排列整齐,肝小叶结构清晰,肝细胞无脂肪变,无炎细胞浸润;模型组大鼠肝细胞肿胀,细胞内有大小不一的脂滴空泡,细胞核边缘化,可见少量炎症细胞浸润;青钱柳组和吡格列酮组大鼠肝细胞脂肪变显著减轻,炎症细胞显著减少。见图4。
2.2.4 青钱柳对模型大鼠肝脏自噬体的影响
透射电镜观察显示,自噬体是由单层膜或典型双层膜将一小部分细胞质包围而成的结构。与空白组比较,模型组大鼠肝细胞自噬体数量有减少趋势;与模型组比较,青钱柳组大鼠肝细胞自噬体数量明显增多,见图5。
2.2.5 青钱柳对模型大鼠关键靶点蛋白表达的影响
与空白组比较,模型组大鼠肝组织p-PI3K、p-Akt1、p-mTOR蛋白表达升高,差异有统计学意义(P<0.05,P<0.01);与模型组比较,青钱柳组大鼠肝组织p-PI3K、p-Akt1、p-mTOR蛋白表达下降,吡格列酮组大鼠肝组织p-Akt1、p-mTOR蛋白表达下降,差异均有统计学意义(P<0.05)。见图6、表6。
表6 大鼠肝组织PI3K、Akt1、mTOR、p-PI3K、p-Akt1、p-mTOR蛋白表达各组比较(±s,每组3只)
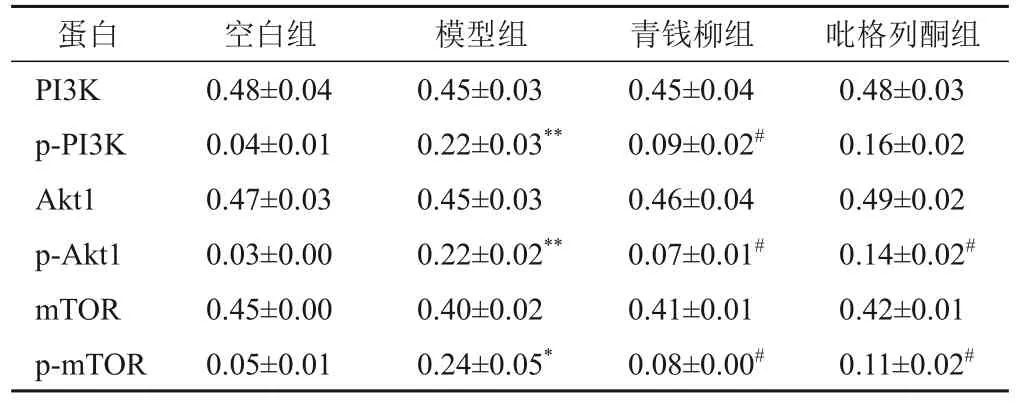
表6 大鼠肝组织PI3K、Akt1、mTOR、p-PI3K、p-Akt1、p-mTOR蛋白表达各组比较(±s,每组3只)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05
蛋白PI3K p-PI3K Akt1 p-Akt1 mTOR p-mTOR吡格列酮组0.48±0.03 0.16±0.02 0.49±0.02 0.14±0.02#0.42±0.01 0.11±0.02#空白组0.48±0.04 0.04±0.01 0.47±0.03 0.03±0.00 0.45±0.00 0.05±0.01模型组0.45±0.03 0.22±0.03**0.45±0.03 0.22±0.02**0.40±0.02 0.24±0.05*青钱柳组0.45±0.04 0.09±0.02#0.46±0.04 0.07±0.01#0.41±0.01 0.08±0.00#
3 讨论
目前,青钱柳的相关研究多集中于化学成分、药理作用及有效部位提取工艺,尚未对其作用机制开展深入研究。因此,本研究通过网络药理学初步探讨青钱柳发挥治疗作用的途径,并通过动物实验进行验证。
网络药理学分析结果显示,青钱柳可以通过多个生物学过程对糖尿病性脂肪肝发挥治疗作用,其核心作用靶点可能是AKT1,并且涉及PI3K/Akt1/mTOR信号通路。研究表明,该通路参与自噬分子机制、信号调控,以及细胞的生长、增殖、分化和凋亡等过程,其中PI3K属于脂质激酶,是细胞膜的关键组成部分,分为3种亚型[12],主要是Ⅰ型PI3K参与该通路信号传导,通过作用于下游Akt,使磷酸化的Akt激活下游mTOR,从而负性调节自噬。mTOR 由2 种不同蛋白mTORC1和mTORC2组成,前者与自噬密切相关,对经典的抑制剂雷帕霉素敏感[13],后者与自噬的关系尚未明确。研究发现,肝脏自噬在脂质代谢中发挥重要作用,自噬失调会导致肝内脂质淤积增加,且肝内脂质淤积可进一步加重代谢功能障碍,从而形成恶性循环,促使疾病发生和进展[14]。通过调控自噬靶向改善非酒精性脂肪肝肝脏脂质积累的策略可能是防治糖尿病性脂肪肝新的干预手段。
基于网络药理学预测结果进行动物实验验证,以高糖高脂饲料喂养+链脲佐菌素腹腔注射方法构建糖尿病性脂肪肝大鼠模型,通过青钱柳水提物连续灌胃4周后取材,对PI3K/Akt1/mTOR信号通路进行验证。结果显示,青钱柳能够降低模型大鼠GLU、GSP、TC水平,减轻肝功能损伤,与以往研究结果[15-16]一致;Western blot检测结果显示,青钱柳可下调模型大鼠肝组织p-PI3K、p-Akt1、p-mTOR蛋白表达,透射电镜观察发现肝脏自噬体增多。
综上所述,青钱柳可有效降低糖尿病性脂肪肝大鼠血脂、血糖水平,减轻肝功能损伤,对肝脏有一定保护作用,其作用机制与抑制PI3K/Akt1/mTOR信号通路以增强自噬有关。

