多发性骨髓瘤合并轻链型淀粉样变性患者的临床特征及预后分析
洪 伊 郭锦洲 陈文萃 赵 亮 黄湘华 刘志红
[作者单位]南京大学医学院附属金陵医院(东部战区总医院)硕士研究生(洪 伊) 国家肾脏疾病临床医学研究中心(南京,210016)
多发性骨髓瘤(MM)是浆细胞异常增殖的血液系统恶性肿瘤,其发病率占血液系统肿瘤的10%[1]。轻链型(AL型)淀粉样变性是最常见的淀粉样变性类型,因错误折叠的免疫球蛋白轻链沉积浸润并破坏全身各组织器官起病,心肾最常受累[2]。MM和AL型淀粉样变性都属于单克隆增殖性浆细胞疾病,据报道10%~15%的MM患者在病程中可并发重要器官受累的AL型淀粉样变性[2-3],而AL型淀粉样变性发展为MM的报道却极为罕见[4-5]。有研究表明合并两组疾病的患者对治疗的反应率低,中位生存期不足2年,患者整体预后不良[5-7]。迄今为止,国内外对合并两组疾病的相关研究较少。因此,本研究旨在分析MM伴发AL型淀粉样变性患者的临床特征,治疗情况及结局,并探索对患者预后有影响的危险因素。
对象和方法
研究对象2009年7月至2022年12月在国家肾脏疾病临床医学研究中心确诊的71例MM合并AL型淀粉样变性患者。MM诊断和分期标准参照《中国多发性骨髓瘤诊治指南(2020年修订)》[8]。AL型淀粉样变性诊断标准和器官受累标准参照《系统性轻链型淀粉样变性诊断和治疗指南(2021年修订)》[9]。
研究资料调阅电子病历系统,记录患者入院时的症状、体征,收集确诊时的血常规、血清白蛋白、校正血清钙、血清肌酐、β2微球蛋白、24 h尿蛋白定量、心肌损伤标志物、血清游离轻链、血清免疫固定电泳、骨髓浆细胞比例、有无溶骨破坏等指标,以及心脏超声、胸腹部CT等影像学资料,并记录患者的治疗方案。
治疗和随访治疗方案:硼替佐米+阿霉素+地塞米松(PAD),硼替佐米+地塞米松(BD),硼替佐米+环磷酰胺+地塞米松(BCD);沙利度胺+地塞米松(TD),沙利度胺+地塞米松+环磷酰胺(TCD),来那度胺+地塞米松(RD),长春地辛+多柔比星脂质体+地塞米松(VAD)和对症支持治疗。
随访截止2023-03-31,总生存期(OS)定义为自确诊之日至末次随访或死亡时间。
相关定义AL型淀粉样变性分期参考《Mayo 2012分期系统》[10],诱导治疗后血液学疗效评估参照《中国多发性骨髓瘤诊治指南2020年修订》[8],分为完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)。血液学总缓解率(ORR)定义为诱导治疗后疗效达 PR 及以上。AL型淀粉样变性治疗后器官缓解的评估参考国内指南[9]。
统计学方法使用《IBM SPSS 26.0》及《MedCalc 20.0》软件进行统计分析,《GraphPad Prism 8.0》进行绘图,X-tile软件选取所需截断值。连续变量满足正态分布时以均数±标准差描述,两组间比较采用独立样本t检验;不满足正态分布时以中位数(四分位间距)描述,两组间比较采用Mann-Whitney检验。计数资料以百分率表示,采用卡方检验或Fisher精确检验比较组间差异。生存分析通过Kaplan-Meier曲线和COX风险比例回归模型进行评估,Log-rank比较生存曲线差异,并计算相对风险(HR)和95%置信区间(CI)。双侧P<0.05为差异有统计学意义。
结 果
一般资料患者临床基线特征见表1,诊断为有症状MM患者36例(50.7%),冒烟型MM患者28例(39.4%),7例患者无法分型。27例患者无法ISS分期;15例患者无法Mayo 2012分期(或)部分患者无法预后分期。大部分(84.5%)患者以水肿起病,IgG型M蛋白最常见(29.6%),中位骨髓浆细胞比例为15%。
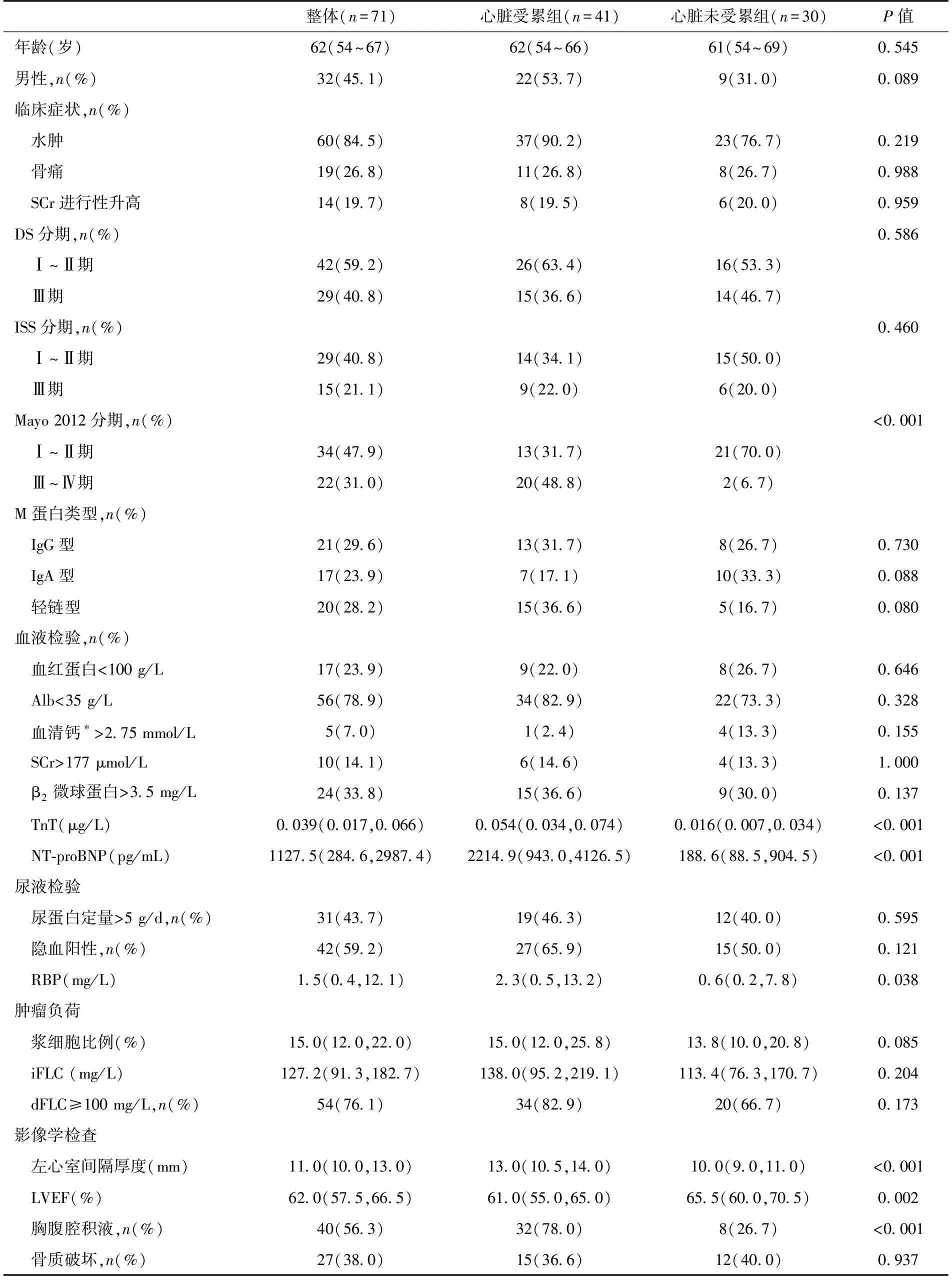
表1 多发性骨髓瘤合并轻链型淀粉样变性患者的基线特征
心脏淀粉样变性组血清肌钙蛋白T(TnT)(0.054 μg/Lvs0.016 μg/L,P<0.001),氨基末端脑钠肽前体(NT-proBNP)(2 214.9 pg/mLvs188.6 pg/mL,P<0.001),尿视黄醇结合蛋白(2.3 mg/Lvs0.6 mg/L,P=0.038)及左心室间隔厚度(13.0 mmvs10.0 mm,P<0.001)均高于无心脏淀粉样变性组,并且大部分患者合并有胸腹腔积液(78.0%vs26.7%,P<0.001)(表1)。
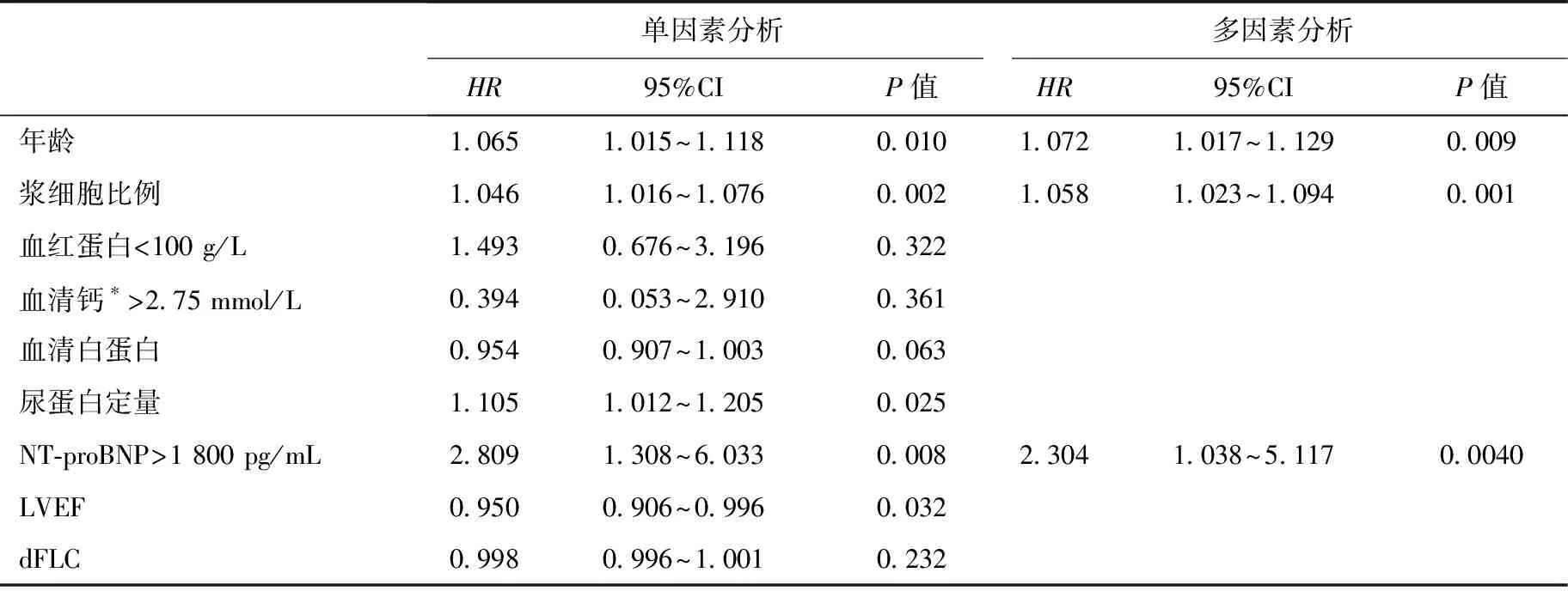
表2 COX风险比例模型单因素与多因素结果
治疗情况及疗效50例患者接受1~29(中位3)个疗程的初始治疗,其中16例BD[其中6例化疗后行自体外周血干细胞移植(ASCT)],6例BCD,1例PAD;15例TD,1例TCD,2例RD;9例VAD;21例患者因无法耐受化疗药接受对症支持治疗。
36例患者可评估血液学疗效,初次治疗药物诱导结束后,有1例CR,9例VGPR,9例PR,14例SD,3例PD;经切换治疗方案后,血液学有3(8.3%)例CR,14(38.9%)例VGPR,10(27.8%)例PR,9(25.0%)例SD,血液学总缓解率(ORR)为75%。开始治疗3个月后评估器官反应,15例患者可评估心脏反应,其中1例PR,14例无反应,心脏缓解率为6.7%;36例患者可评估肾脏反应,其中1例CR,7例VGPR,7例PR,21例NR,肾脏总缓解率为41.7%。
生存及预后危险因素分析中位随访时间16(1.0~120.0)月,31例死亡,死亡原因:疾病进展11例,心功能不全急性加重4例,消化道出血、肺部感染和脓毒血症各2例,肝硬化1例,死亡原因不明9例。
估计的中位OS为34月,6月、1年、2年和4年的累积生存率分别为83.6%、75.2%、62.2%和43.0%(图1A)。合并有心脏淀粉样变性患者的生存明显比无心脏淀粉样变性患者差(中位OS,25.0月vs65.0月,P=0.029)(图1B)。初始治疗以BD为主的患者生存明显优于初始治疗以TD或VAD为主的患者(中位OS,39.9月vs10.0月,P<0.001)(图1C)。
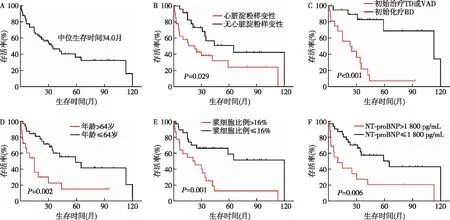
图1 多发性骨髓瘤合并轻链型淀粉样变性患者生存曲线
Kaplan-Meier生存曲线显示,年龄>64岁的患者生存较年龄≤64岁的患者差(中位OS,15.0月vs59.0月,P=0.002)(图1D),浆细胞比例>16%的患者生存较浆细胞比例≤16%的患者差(中位OS,21.0月vs120.0月,P=0.001)(图1E),NT-proBNP>1 800 pg/mL的患者生存较NT-proBNP≤1 800 pg/mL的患者差(中位OS,10.0月vs65.0月,P=0.006)(图1F)。
使用X-tile软件,确定年龄最佳截断值为64岁、浆细胞比例的最佳截断值为16%。参考《Mayo 2012分期》标准,NT-proBNP截断值取1 800 pg/L[10]。参考《中国多发性骨髓瘤诊治指南(2020年修订)》,血红蛋白截断值取100 g/L,校正后血清钙截断值取2.75 mmol/L[8]。
单因素分析表明,年龄、浆细胞比例、尿蛋白定量、NT-proBNP和左室射血分数与患者的预后相关。将单因素分析中P<0.05的指标纳入多因素模型中,结果显示与预后独立相关的因素分别是年龄(HR=1.072,95%CI 1.017~1.129,P=0.009)、浆细胞比例(HR=1.058,95%CI 1.023~1.094,P=0.001)、和NT-proBNP(HR=2.304,95%CI 1.038~5.117,P=0.040)(表2)。
讨 论
MM合并AL型淀粉样变性并不常见,相关研究较少,阐明此类患者的临床预后特征对加深MM的认识具有重要临床意义。本研究发现大部分此类患者以水肿起病,骨痛、贫血及高钙血症少见。这可能与本研究大部分患者合并肾脏淀粉样变性相关,该结果提示MM合并AL型淀粉样变性患者临床起病以淀粉样变性引起的器官症状为主[11],而非典型的“CRAB”症状[12-14];此外,还有部分患者表现为持续发热,腹泻,胃肠道出血等其他器官受累的特异性症状[3]。因此,对于临床上出现不明原因的水肿,肾功能恶化或心功能不全的MM患者应考虑伴发淀粉样变性的可能。
治疗上,MM合并AL型淀粉样变性的选择仍以MM的治疗方案为主,但其疗效是否与其他MM患者一致仍有争议。Vela-Ojeda等[5]在2003年研究发现,经美法仑联合泼尼松治疗后,合并AL型淀粉样变性的MM患者与一般MM患者相比,血液学PR率低(37.5% vs 62.5%)且治疗失败率高(56.2%vs20%)。然而,2022年国内一项研究报道,硼替佐米诱导治疗后MM合并AL型淀粉样变性组患者血液学ORR较MM组更高(85.7%vs79.7%),且血液学达到VGPR以上疗效的患者比例也更高(76.2%vs55.1%)[7]。本组患者治疗方案以硼替佐米和沙利度胺为主,治疗后血液学ORR为75%,达到VGPR及以上的患者比例为47.2%,血液学CR为8.3%,心脏缓解率仅为6.7%;有6例患者经BD诱导后接受ASCT,其中5例患者在ASCT血液学疗效达到深度缓解,并获得长期生存。本研究表明MM合并AL型淀粉样变性的患者接受抗浆细胞治疗后仍有较高的血液学缓解率,但器官缓解率较低,如何进一步优化治疗方案,提高患者器官缓解率,是值得临床关注的重要问题。此外,本研究接受ASCT的患者预后较好,提示适合ASCT的患者在诱导治疗后应早期序贯移植,有助于疾病的深度缓解和重要器官的功能恢复。
合并AL型淀粉样变性对MM患者的预后有显著的影响[5,15]。本中心曾报道245例原发性系统性淀粉样变性患者的研究,发现MM合并AL型淀粉样变性组的死亡比例较高[16]。Vela-Ojeda等[5]发现合并AL型淀粉样变性的MM患者比未合并的MM患者预后差(中位OS,13.0月vs64.0月,P<0.004),并认为潜在的AL型淀粉样变性可能是MM患者预后不良的因素之一。本研究患者中位OS为34月,2年生存率62.2%,预后较一般MM患者差[7,17]。但也有学者认为淀粉样蛋白沉积在MM患者中常见,经过高剂量化疗和ASCT治疗后,淀粉样蛋白似乎不影响MM患者的整体预后[12]。然而,可以耐受上述治疗的患者一般情况较好,该研究可能排除了组织器官严重淀粉样变性的患者。
MM合并AL型淀粉样变性患者预后相关危险因素的研究较少。文献报道血清白蛋白水平<3.5 g/dL,β2微球蛋白水平>3.5 mg/L,血液学疗效未达到VGPR与患者预后不良密切相关[5]。刘咏等发现我国MM合并淀粉样变性的患者中,心脏受累者预后极差,中位OS仅为13月[7]。在本研究中,年龄、浆细胞比例和NT-proBNP是影响此类患者预后的独立危险因素,结果表明患者肿瘤负荷的多少和心脏受累的严重程度与预后密切相关。在预后相关危险因素上,此类患者兼顾了MM和AL型淀粉样变性两者的特点。有研究表明伴发AL型淀粉样变性可能会增加MM患者的肿瘤负荷[6],本研究组观察到较高的浆细胞比例与患者较差的预后相关,该结果表明肿瘤负荷重预示患者结局不良,与已报道的研究结果相似[18]。本研究合并心脏受累的患者同样预后不良,COX多因素结果进一步验证NT-proBNP>1 800 pg/mL是患者结局不良的独立危险因素,该结果和原发性AL型淀粉样变性中的研究结果类似,严重心脏淀粉样变性也是造成MM伴发AL型淀粉样变性患者生存期进一步缩短的重要原因。
本研究有一定的局限性:(1)样本来源于单中心,纳入样本量有限,部分病例随访时间短。(2)本组患者化疗方案没有统一标准,无法分析治疗方案对预后的影响。(3)本研究中多数患者未进行骨髓细胞遗传学检查,未能分析患者细胞遗传学特点与预后的相关性。
小结:合并AL型淀粉样变性的MM患者的临床特征以淀粉样变性累及器官引起的症状为主,临床对相关器官功能的筛查有助于此病的诊断。MM合并AL型淀粉样变性患者的总体预后不佳,心脏受累患者预后更差。抗浆细胞治疗后有较高的血液学缓解率,但器官缓解率低。年龄、心脏受累严重程度和肿瘤负荷是影响患者预后的独立危险因素。

