人工湿地中异养硝化-好氧反硝化菌分离及脱氮除磷特性的研究
崔看利,张丹,方展明,任雨新,姜瑞璇,孙学亮
(天津农学院 水产学院 天津市水产生态及养殖重点实验室,天津 300392)
在养殖水体中存在着大量的有机体、鱼类的排泄物以及过剩饵料的分解物,这些有机物分解会产生氨氮、亚硝酸盐、硝酸盐等不利于鱼类健康生存的物质[1],许多研究表明水体富营养化主要是由氮、磷等营养盐含量过多所引起的[2]。随着国家环保政策日趋严格,如何高效处理养殖尾水成为了水产行业中的焦点问题。人工湿地作为主要由植物和微生物组成的水生生态系统,其在养殖尾水处理中具有较大的应用潜力,最大的优点是成本低、能耗少、管理运营简单且环境友好[3]。
生物脱氮被普遍认为是去除水体中氮元素最经济有效的途径[4],传统的生物脱氮是利用自养硝化细菌和厌氧反硝化细菌两类细菌来对污水中的氮进行处理,它们对氧和营养物质的需求明显不同,限制了生物脱氮的效率,异养硝化-好氧反硝化菌的发现弥补了传统生物脱氮的不足,极大地提高了脱氮效率[5-6]。目前已筛选出许多种异养硝化-好氧反硝化细菌具有较好的脱氮能力[7-10]。释磷-吸磷理论是目前被普遍接受的生物除磷理论之一[11]。REY-MARTÍNEZ[12]等提出生物除磷工艺,生物除磷工艺具有耗能少,节约成本,除磷效率较高的优点。
本试验在人工湿地养殖尾水处理系统中,分离异养硝化-好氧反硝化菌并对其温度、pH、氮源、碳源等生长影响因子及菌株脱氮除磷特性进行研究,以期加强对人工湿地中异养硝化-好氧反硝化菌种类和性能的认知,为其在生产中的应用提供理论依据。
1 材料与方法
1.1 培养基
稀释培养基:100 mL 8.5‰生理盐水,pH 7.0。
维氏盐溶液(g/L)[4]:5.0 k2HPO4、2.5 MgSO4·7H2O、0.05 FeSO4·7H2O、0.05 MnSO4·4H2O 依次溶于1 L 盐度为1.5%的海水中。
BTB 初筛培养基(g/L):0.65 NaNO2、5.66 柠檬酸钠、50 mL 维氏盐溶液、依次溶于1 L 蒸馏水中,加入1%溴百里酚蓝1 mL、琼脂20.0,调节pH 7.0。
复筛培养基(g/L):5.628 丁二酸钠、0.382 2 NH4Cl、0.1 MgSO4·7H2O、6.7 Na2HPO4·12H2O、1.0 KH2PO4、微量元素2mL,依次溶于1L 无氨水中,调节pH 7.0~7.4。
异养硝化培养基(g/L):在复筛培养基的基础上将丁二酸钠改为4.0,Na2HPO4·12H2O 为2.310 6,KH2PO4为0.878,其余条件不变。
好氧反硝化培养基(g/L):在异养硝化培养基的基础上,将0.382 2 NH4Cl 改为0.722 0 KNO3,其余条件不变。
异养硝化-好氧反硝化培养基(g/L):在异养硝化培养基的基础上,将0.382 2 NH4Cl 改为0.492 9 NaNO2,其余条件不变。
所有培养基都经121 ℃灭菌20 min。
1.2 菌株的富集、分离及鉴定
取底泥样品、毛刷、石子(源于天津市通洋农业科技发展有限公司所建立的人工湿地)分别置于已灭菌的装有100 mL 8.5‰生理盐水的锥形瓶中,恒温摇床上以30 ℃、150 r/min 进行培养24 h 后,各取1 mL 菌液,涂布到固体培养基上,每个涂布三块,30 ℃恒温培养箱中培养至长出单菌落。从平板中挑取形态不同的菌落,通过平板划线法纯化,倒置放入30 ℃恒温培养箱中培养,长出菌落后观察菌落形态特点。经过多次分离,直到平板上的单菌落形态一致后,分别挑取1环,采用平板划线法接种于BTB 培养基中,在30 ℃恒温培养箱中培养24 h,观察培养基长有菌落的地方是否变蓝,变蓝为目的菌株,将筛出的目的菌株接种于复筛培养基30 ℃,150 r/min 摇床培养24 h,测定TN 和可溶性活性磷的含量,对总氮与可溶性活性磷去除率最高则为复筛菌株。
菌株经革兰氏染色结果为阴性菌,利用TIANGEN 的细菌基因组DNA 提取试剂盒,提取DNA 后, PCR 扩增反应条件为94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸5 min,29 个循环,4 ℃,5 min。引物为27F 和1 492R,经琼脂糖凝胶电泳(1%)验证,紫外分析仪检查电泳结果,后将目的菌株DNA 交由北京六合华大基因科技有限公司完成测序,测序结果经NCBI进行Blast 分析,使用MEGA 7.0 软件的临位链接法(NJ)构建系统发育进化树。
1.3 不同因素对菌株生长的影响
以异养硝化培养基为基础,温度设置为15℃、20℃、25℃、30℃、37℃,pH 设置为3、5、7、8、9,碳源设置为丁二酸钠、乙酸钠、甘油、柠檬酸钠、葡萄糖,C/N 设置为3、5、7、12、15、18、20、25、30,C/N/P 设置为70∶10∶1、14∶2∶1、7∶1∶1、7∶1∶4、7∶1∶8,取菌液OD600≈1,分别接种1 mL 到100 mL 培养基中,转速为150 r/min,其余条件保持相同,培养24 h 后测定OD600值,取OD600最高值设置条件为最佳生长条件,并重复试验3 次,数据采用平均值±标准差表示(表1)。
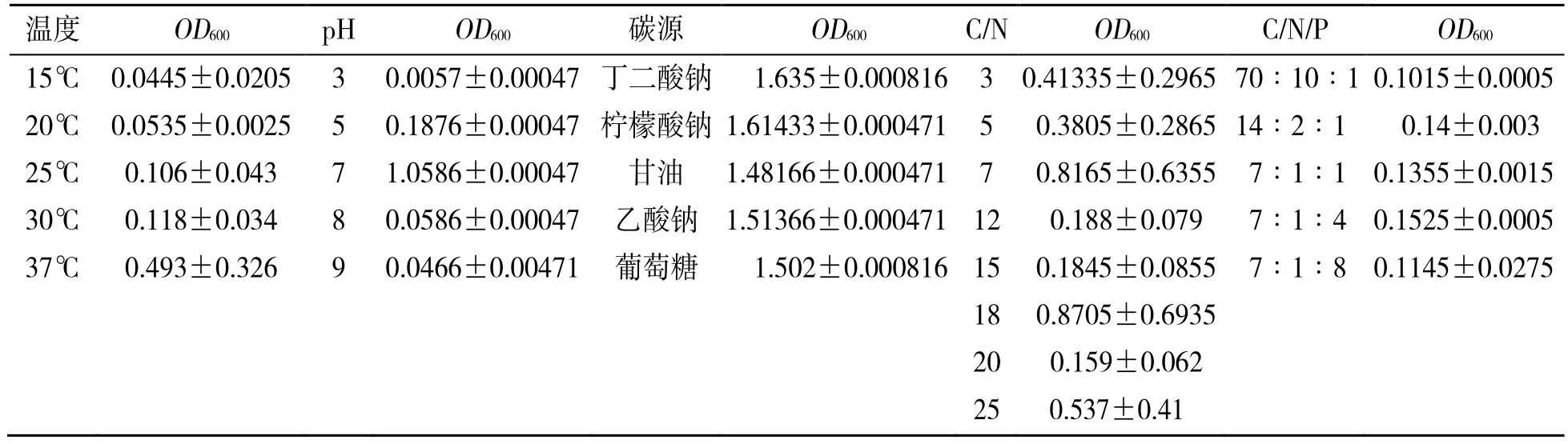
表1 不同因素下目的菌株OD600 值变化
1.4 不同氮源对目的菌株脱氮除磷性能影响
以异养硝化培养基为基础,在优化条件的基础上,分别以NH4Cl、KNO3、NaNO2作为不同氮源,取菌液OD600≈1 分别接种1 mL 于100 mL 培养基中,其余条件保持相同,分别在不同氮源条件下培养24 h,每3 h 测定OD600值、TN、NH4-N、NO3-N、NO2-N,可溶性活性P,并重复试验3 次。
1.5 分析方法
OD600测定采用分光光度计法、TN 采用碱性过硫酸钾消解紫外分光光度法、NH4-N 采用纳氏试剂法、NO3-N 采用麝香草酚法分光光度法、NO2-N采用重氮-偶氮光度法,可溶性活性磷采用钼-锑-抗法。不同因素对目的菌株生长影响的试验数据以平均数±标准差表示。
2 结果
2.1 KL1 菌株鉴定
菌株KL1 在LB 固体培养基培养24 h 后,菌落圆形,呈米白色且表面光滑,对菌株进行16S rRNA基因PCR 扩增,得到长度为2 000 bp 序列。将所获得菌株KL1 的16S rDNA 基因序列在NCBI 的GenBank 核酸序列数据库,进行Blast 分析,并下载相似性比较高的基因,寻找已经获得分类地位的菌种,以MEGA7.0 软件的临位链接(NJ)法构建系统发育进化树,发现菌株KL1 与假单胞菌同源性最高。利用MEGA7.0 软件构建系统发育进化树,结果如图1 所示,菌株KL1 与假单胞菌属在同一发育地位,确定菌株KL1 为假单胞菌属。

图1 菌株KL1 系统发育树
2.2 不同因素对菌株KL1 生长的影响
2.2.1 pH 和温度对菌株KL1 生长的影响
由图2 可知,随着温度增加,OD600值也随之增加,37℃时,OD600值最高,菌株生长最佳,随着pH 增加,OD600值先呈上升趋势,后下降。pH为7 时,生长最好,OD600值为1.059,pH 为3 和9 时,OD600值分别为0.006 和0.050,菌株KL1 生长量较低。
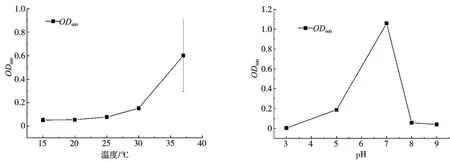
图2 不同pH 和温度对菌株KL1 生长的影响
2.2.2 氮源和碳源对菌株KL1 生长的影响
由图3 可知,24 h 内,菌株KL1 以NH4Cl 为唯一氮源,OD600值整体趋势高于以KNO3和NaNO2为唯一氮源的OD600值。6~9 h,NH4Cl 为唯一氮源,菌株KL1 的生长速度最快。不同碳源下菌株KL1 对丁二酸钠利用最佳,次之为柠檬酸钠,对乙酸钠与葡萄糖利用一般,对甘油利用最差。

图3 不同氮源和碳源对菌株KL1 生长的影响
2.2.3 C/N 和C/N/P 对菌株KL1 生长的影响
由图4 可知,随C/N 增加,菌株KL1 在C/N为7 和18,OD600值出现两个峰值。
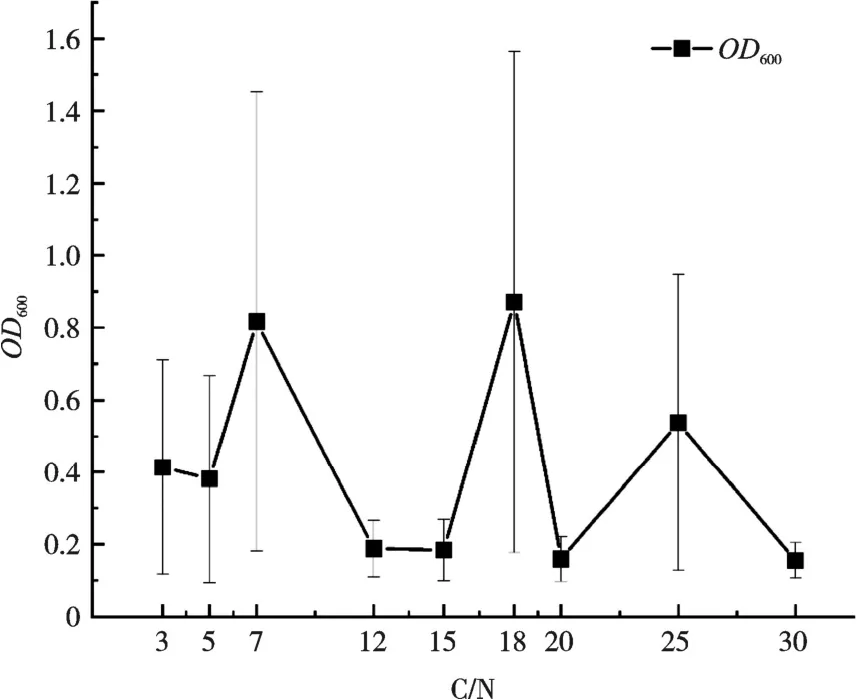
图4 不同C/N 对菌株KL1 生长的影响
由图5 可知,24h 时,随着C/N/P 增加,目的菌株OD600值也随之增加,其中C/N/P 为7∶1∶4时,目的菌株生长最优,C/N/P 为7∶1∶8,菌株KL1 生长最差。
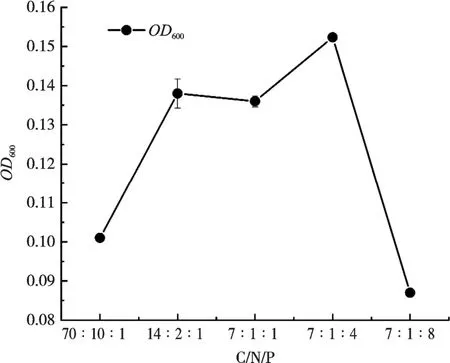
图5 不同C/N/P 对菌株KL1 生长的影响
2.3 氮源对菌株KL1 脱氮除磷性能的影响
由图6 可知,NH4Cl 为唯一氮源,随着菌株生长量增加,氨氮浓度和TN 浓度逐渐下降,21 h,NO2-N 积累浓度为2%(2.466 2 mg/L),NO3-N无积累。24 h,TN 和NH4-N 去除率分别高达81%(TN 浓度剩余22.763 1 mg/L)和92%(氨氮剩余浓度9.900 4 mg/L),菌细胞利用氮为58%(70.700 05 mg),转化为气态氮为23%(28.54 mg)。
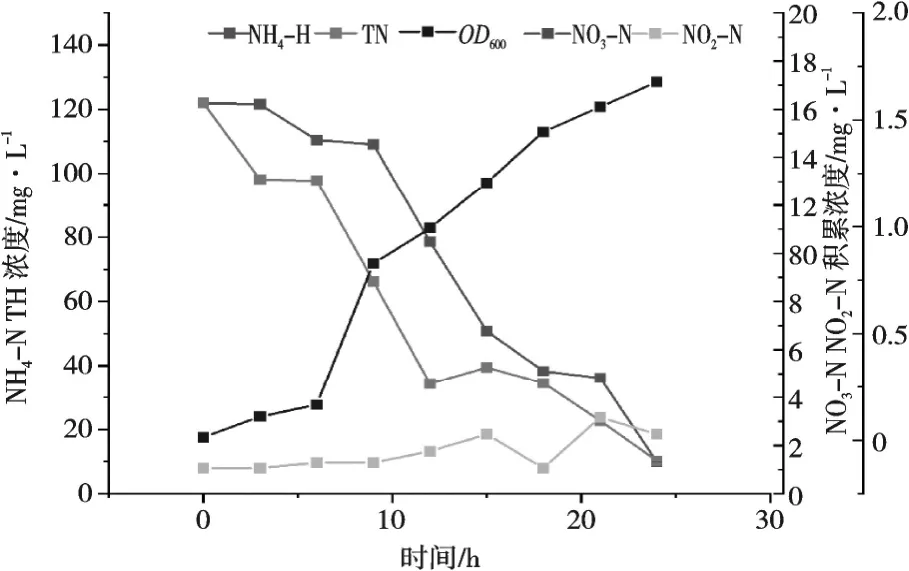
图6 NH4Cl 为唯一氮源对菌株KL1 脱氮性能的影响
由图7 可知,KNO3为唯一氮源,随着OD600值增加,NO3-N 和TN 浓度明显下降,NO2-N 积累浓度较少,NH4-N 无积累。24 h,NO2-N 积累浓度为5%(7.398 7 mg/L),TN 去除率为44%(TN 剩余浓度76.193 79 mg/L),NO3-N 去除率为95%(NO3-N剩余浓度6.595 mg/L),细胞利用氮为36%(48.215 11 mg),转化成气态氮为8%(10.591 1 mg)。
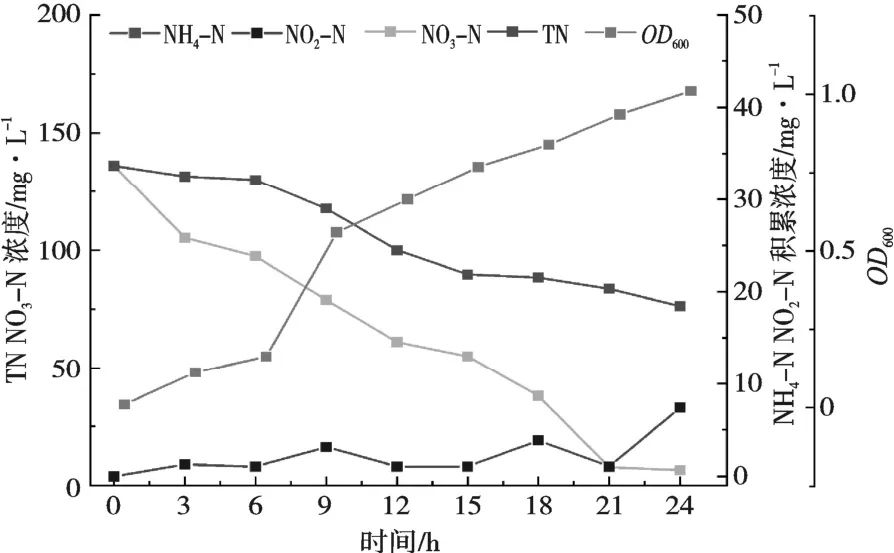
图7 KNO3 为唯一氮源对菌株KL1 脱氮性能的影响
由图8 可知,NaNO2作为唯一氮源,随着OD600值的增大,NO2-N 和TN 浓度随之下降,NH4-N开始积累,对TN 和NO2-N 去除率为41%(53.797 mg/L)和56%(73.867 mg/L),菌细胞利用氮含量为21%(27.545 mg),转化为气态氮含量为21%(28.105 7 mg/L),对TN 去除率和菌细胞利用的氮较以NH4Cl 和KNO3作为唯一氮源低。
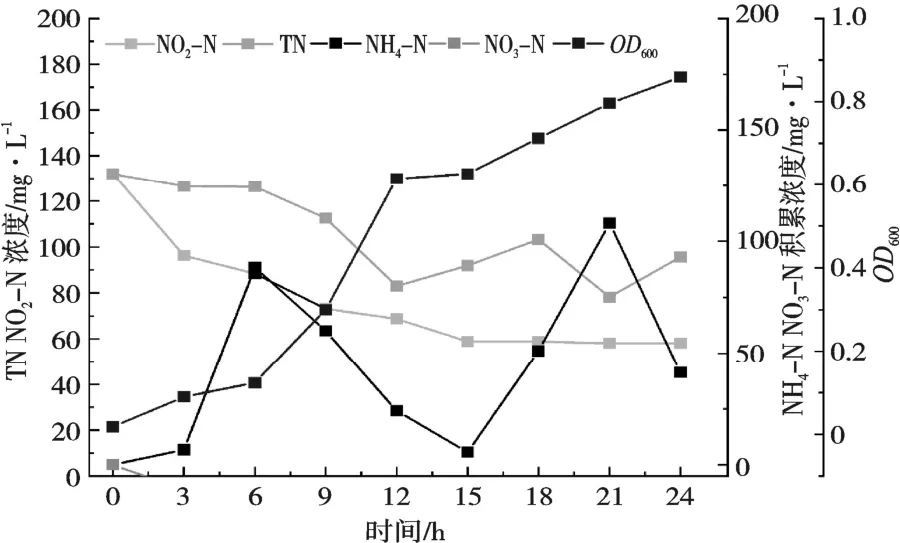
图8 NaNO2 为唯一氮源对菌株KL1 脱氮性能的影响
由图9 可知,NH4Cl 为唯一氮源,对无机磷去除率最高,24 h 对于无机磷的去除率高达31%(磷初始浓度为400 mg/L)。不同氮源下,0~6 h内,磷浓度呈急剧下降趋势,6~24 h 内,磷浓度呈上升趋势,后呈下降趋势。24 h,KNO3、NaNO2为唯一氮源时,对无机磷的去除率分别为29%和26%,较NH4Cl 为唯一氮源对无机磷的去除率低。
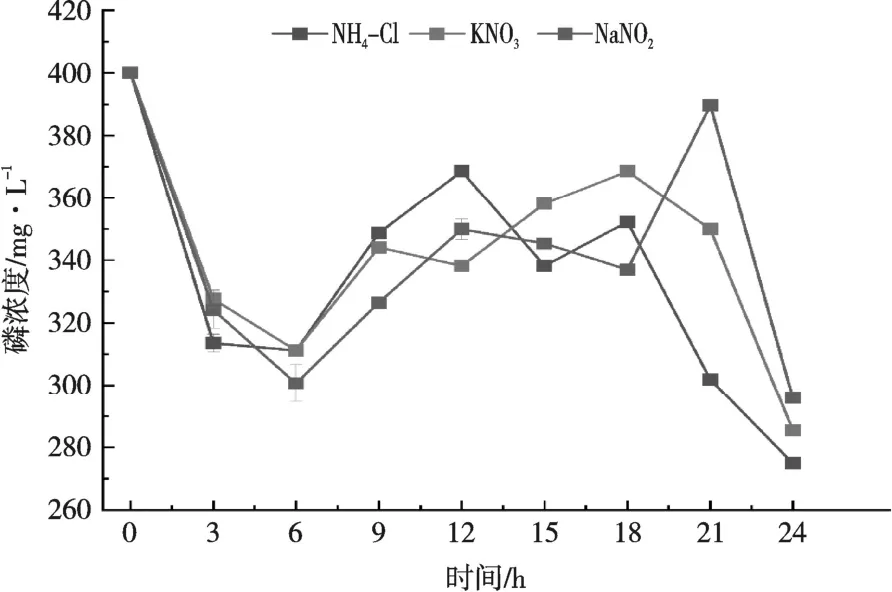
图9 不同氮源对菌株KL1 除磷性能的影响
3 讨论
3.1 不同因素对菌株KL1 生长的影响
3.1.1 温度和pH 对菌株KL1 生长的影响
温度通过影响蛋白质的结构与功能,以及影响基因调控,酶活性来影响微生物的生长、繁殖和新陈代谢[13-14],结果表明,37 ℃为菌株KL1 的较适合生长温度。与许有燊等[15]在水产养殖环境中筛选出芽孢杆菌的最适生长温度一致。pH 过高或过低会降低微生物的酶活性,改变微生物细胞膜电位,影响微生物的代谢活动和营养吸收,从而影响菌株的生长[16-18],试验结果表明,pH 为7时菌株KL1 生长最好,与苏兆鹏等[14]提出的大部分HN-AD 菌在中性或是偏碱性环境下可以很好的生长的结论一致。
3.1.2 氮源对菌株KL1 生长的影响
氮是异养硝化-好氧反硝化菌合成自身细胞生长繁殖所需要的元素之一[19-20],菌株KL1 以NH4Cl为唯一氮源生长利用最好,次之为KNO3、NaNO2,原因可能为氨氮可以直接作为细菌合成生物大分子例如蛋白质氮源,有学者认为氨氮作为氮源要优于硝态氮[21],此结果与蔡茜等的研究相同[22]。
3.1.3 碳源对菌株KL1 生长的影响
碳源是微生物生命活动所需的重要营养物,其构成了微生物细胞的含碳物质和供给微生物生长繁殖所需要的能量[23,19],本文结果表明丁二酸钠作为唯一碳源菌株KL1 生长最好,柠檬酸钠次之,对乙酸钠和葡萄糖利用一般,对甘油利用最差。冯亮等[24,13]提出假单胞菌属最适碳源为丁二酸钠,与本研究结果一致,说明丁二酸钠可能对假单胞菌属生长繁殖方面有良好的应用价值。
3.1.4 C/N 对菌株KL1 生长的影响
随着C/N 增加,目的菌在C/N 为7 和18 时,OD600值出现两个峰值,与黄郑郑提出的随着C/N增加对菌株生长有抑制作用的结果不同[25],可能是因为本研究以丁二酸钠为碳源,氯化铵为氮源,与黄郑郑使用碳源以及氮源不同,出现两个峰值的原因可能是碳源分子结构和官能团不同,或不同菌株对唯一氮源中的SO42-和Cl-利用率不同。有研究表明,对于大多数HN-AD 菌而言,其最佳C/N 比在8~20,未发现C/N 为7 和18 时,OD600出现两个峰值[26]。
3.1.5 C/N/P 对菌株KL1 生长的影响
碳、氮和磷是目的菌合成自身细胞生长繁殖所需要的元素[19-20],C/N/P 过低可能不能满足目的菌株自身生长繁殖的需要,从而生长受到限制,C/N/P 过高,可能使目的菌株不耐受,且过量的碳素、氮素与磷元素会对养殖水体造成一定的污染。FOROUZESH 等[27]在不同C/N/P 条件下,就微生物对脱氮除磷性能的影响做出相关的试验与讨论,但未提出C/N/P 对微生物生长的影响。
3.2 氮源对菌株KL1 脱氮性能的影响
菌株KL1 以NH4Cl 为唯一氮源,对TN 和NH4-N 去除率分别高达81%和92%,NO3-N 无积累,具有较好的异养硝化能力。NO3-N 无积累可能是细胞利用AMO 将NH4-N 氧化成羟胺,羟胺经HAO 作用转化成NO2-N,最终生成气态物质N2O 或氮气[28],推测异养硝化过程的路径之一为NH4-N→NO2-N→N2,此路径与XI 等提出的异养硝化过程一致[29],有一部分氮素被菌细胞作为生长利用,储存在细胞内。
以KNO3为唯一氮源,对NO3-N 的去除率高达95%,对总氮的去除率为44%,但仍有5%NO2-N的积累存在,与王骁静等[19]筛选的菌株好氧反硝化能力有一定的差距。推测其好氧反硝化路径之一可能为NO3-→NO2-→NO→N2O→N2,此结果与GUPTA 等一致[30]。本试验中出现了NO2-N 的积累,原因可能为菌细胞质内或细胞膜上存在硝酸盐还原酶,NADH 或NADPH 作为电子供体可将NO3-N还原成NO2-N[28]。
NaNO2作为唯一氮源时,NH4-N 有积累,NO2-N作为异养硝化和好氧反硝化过程中的中间态,可能转化为氨态氮[22,27],NO3-N 几乎无积累,说明菌株KL1 异养硝化能力要弱于好氧反硝化能力。TN 去除率以及菌细胞利用的氮素都低于以NH4Cl和KNO3作为唯一氮源,可能NO2-N 本身对微生物具有毒害作用导致其生长能力以及脱氮能力受到负面影响,此结果与ROUT 等研究一致[7]。
3.3 氮源对KL1 菌株除磷性能的影响
在脱氮除磷系统中,不同的氮源对反硝化聚磷菌除磷效果的影响存在一定差异[31]。试验结果表明,0~3 h 内,磷浓度急剧下降,可能是因为菌株生长需要大量利用无机磷。在好氧的条件下,菌株以游离氧为电子受体,氧化细胞内储存的PHB,并利用该反应产生的ATP,将无机磷酸盐转化为多聚磷酸盐贮存在体内[32-33]。6~21 h,磷浓度呈先上升,后下降趋势,可能由于菌密度过大,导致培养基内氧气不充足,厌氧时释磷并合成大量B-羟基丁酸聚合物[34],此结果与曾凡哲等研究一致[35]。NO3-N、NO2-N 为唯一氮源时,菌株KL1 对无机磷的去除率分别为29%和26%,对NO3-N、NO2-N 去除率分别为95%和56%,说明菌株KL1 具有较好的反硝化除磷能力。吕泳涛等[36]研究发现,以硝酸盐为电子受体时的除磷效率大于亚硝酸盐。以NH4-N 为唯一氮源时,对无机磷的去除率为31%,说明菌株KL1 兼具较好的异养硝化除磷能力。
4 结论
在人工湿地尾水处理系统分离出异养硝化-好氧反硝化菌株KL1,对其进行形态学观察和16S rRNA 基因序列分析,确定为假单胞菌属。菌株KL1 最适温度范围为30~37 ℃,最适pH 范围为5~7,最佳碳源为丁二酸钠,最佳C/N 范围为7~18,最佳C/N/P 范围为(14∶2∶1)~(7∶1∶4)。以NH4Cl 为唯一氮源时,对NH4-N 和TN 去除率高达92%和81%。以KNO3为唯一氮源时,对NO3-N和TN 去除率分别为95%和44%。以NO3-N、NO2-N为唯一氮源时,对无机磷的除磷率分别为29%和26%。在人工湿地养殖尾水处理系统中分离的菌株KL1 具有较好的脱氮及反硝化除磷能力,有将来应用于实际生产的巨大潜力。

