HIF-1a/PDK1 通路活化促进化疗后残存乳腺癌组织癌干细胞生成*
朱芳,王佑权,徐喆,王先明,屈洪波
518000 广东 深圳,深圳市龙华区人民医院 健康管理科(朱芳),甲乳外科(王佑权);518000 广东 深圳,深圳大学附属华南医院 甲乳外科(徐喆、王先明、屈洪波)
随着新辅助治疗在乳腺癌患者中的广泛应用,大部分乳腺癌患者经过新辅助化疗及靶向治疗后能够获得病理完全缓解(pathologic complete response,PCR),其预后也明显改善[1]。然而,临床中仍有一部分乳腺癌在新辅助治疗后未获得缓解,残存乳腺癌组织高表达肿瘤干细胞(breast cancer stem cells,BCSCs)标志物[2]。既往研究表明,BCSCs 具有自我更新和多向分化潜能,表现出放化疗抵抗性,被认为是乳腺癌复发转移的根源[3]。本研究组早前发现,低氧微环境促进乳腺癌MCF-7 细胞中BCSCs 微球体富集,而下调低氧诱导因子(hypoxia inducible factor, HIF)-2a 表达显著抑制BCSCs 微球体细胞的增殖[4]。近期研究发现,HIF-1a 通过活化丙酮酸脱氢酶激酶同工酶 1(pyruvate dehydrogenasekinase isoenzyme1,PDK1)诱导肿瘤细胞糖代谢由线粒体氧化磷酸化向糖酵解转变,使得肿瘤细胞获得抗凋亡能力,并诱导产生酸性微环境促进肿瘤侵袭及免疫逃逸[5]。基于此,本研究拟探讨HIF-1a/PDK1 信号通路在化疗后残存乳腺癌组织BCSCs 微球体富集中的作用及机制。
1 资料与方法
1.1 病例资料
选取2021 年3 月至2022 年10 月于深圳市龙华区人民医院接受诊治40 例乳腺癌患者为研究对象,实验分为新辅助化疗前粗针穿刺乳腺癌组织组和新辅助化疗后手术切除的乳腺癌组织组。所有病例经术前粗针穿刺病检确诊为乳腺癌,并检测雌激素、孕激素及人表皮生长因子2(human epidermal growth factor receptor 2,HER2)、Ki-67 及P53 的表达水平。患者均为女性,年龄33~67 岁。肿瘤临床分期(cTNM):Ⅱ期22 例,Ⅲ期18 例;伴有淋巴结转移24 例,不伴有淋巴结转移16 例;分子分型:三阴型10 例,Luminal 型20 例,HER2 过表达型10 例。所有患者术前均接受6 个周期TAC 或TCbHP 方案新辅助化疗。术后对乳腺癌原发灶及腋窝淋巴结再次评估,结果显示获得病理缓解为22 例,仍有残存病灶为18 例。本研究经龙华区人民医院伦理委员会审查批准,伦理号:[2021]第(089)号。所有患者均签署知情同意书。
1.2 主要试剂
胎牛血清、神经营养因子及DMEM/F-12 培养基购自美国Gibco 公司;表皮生长因子和成纤维细胞生长因子购自以色列ProSpec 公司; L-谷氨酰胺购自美国Sigma 公司;兔抗人一抗HIF-1a、PDK1、乙醛脱 氢 酶1A1(acetaldehyde dehydrogenase 1A1,ALDH1A1)及β-actin 抗体购自美国Abcam 公司,TRITC标记鼠抗兔二抗、细胞裂解液、HRP 标记鼠抗兔二抗IgG、BCA 检测试剂盒及总蛋白提取试剂盒购自武汉三鹰生物技术有限公司。
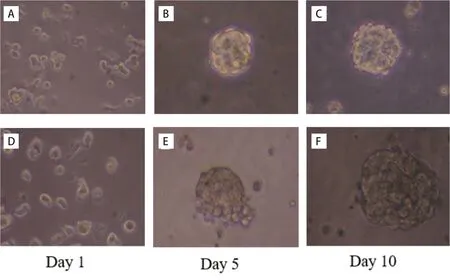
图2 倒置相差显微镜观察BCSCs 微球体形态学(×200)Figure 2.Morphology of BCSCs Microspheres Observed by Inverted Phase Contrast Microscope (×200)
1.3 免疫组化法检测两组细胞HIF-1a、PDK1 及ALDH1A1 表达
收集化疗前粗针穿刺乳腺癌组织和化疗后残存乳腺癌组织,采用SABC 法免疫组化染色,标本经固定、脱水、包埋及切片。首先通过柠檬酸盐缓冲液修复,采用3%过氧化氢灭活内源性酶,置入37℃孵箱孵育30 min,加入一抗HIF-1a、PDK1 或ALDH1A1(浓度为1∶200),4℃孵育过夜。采用PBS 冲洗3 次,加入HRP 标记的二抗(浓度为1∶500),置入37℃孵箱孵育1.5 h,采用DAB 显色,复染、脱水及封片。倒置显微镜下观察,并计数500 个肿瘤细胞,判定标准如下:以上3 种指标以细胞浆出现黄色或棕黄色颗粒为阳性表达。阳性细胞数范围在大于75%为4 分,在51%~75%之间为3 分,在26%~50%之间为2 分及1%~25%之间为1 分。细胞染色强度判定如下:棕黄色为3分,黄色为2分,淡黄色为1分及无色为0分。以上两项相乘积的总分:强阳性为10~12 分,阳性为7~9 分,弱阳性为4~6 分,阴性为≤3 分。
1.4 无血清悬浮培养获得原代BCSCs 微球体
实验分组同前,用眼科剪将两组癌组织块剪成大小为1 mm×1 mm×1 mm 的小组织块,采用D-Hanker溶液冲洗并经过200 目细胞筛过滤,离心5 min 后加入红细胞裂解液去掉红细胞。采用无血清悬浮培养基(serum free medium,SFM)调整细胞浓度为3×104个/L,将稀释后的细胞接种于低粘附6 孔板中,置入37℃、5% CO2的饱和湿度培养箱中进行孵育。每3 天进行全量或半量换液1 次,每间隔10 天传代1 次,每天在相差显微镜下观察微球体形态并拍照留存。
1.5 有限稀释法检测微球体细胞单克隆形成能力
实验分组同前。采用Accutase 酶将微球体细胞消化并吹打成单细胞悬液,计数细胞浓度,以每孔200 μL 含有120、100、80、60、40、20、10 个细胞接种于96 孔板,每一个浓度设置5 个复孔,每2 天添加25 μL 的SFM,置入37℃、5% CO2及饱和湿度孵箱中培养,每天在倒置相差显微镜下观察微球体形成情况,测定每个浓度梯度下未形成微球体孔并计算其所占比例。通过方差分析作拟合优度检验,以每孔细胞数为自变量,以未形成微球体百分比作为应变量来进行直线回归分析,则37%应变量所对应的自变量即为一个微球体所需要细胞数,由于1 个微球体来自1 个CSCs,故根据方程可以计算出BCSCs在肿瘤组织中的含量,实验重复3 次。
1.6 Transwell 体外侵袭实验检测微球体细胞侵袭能力
实验分组同前。采用RPMI-1640 稀释基质胶(1∶9),取100 μL 稀释基质胶加到24 孔板的Transwell 小室中,小室周围加少许PBS;将24 孔板放入37℃孵育4 h。采用Accutase 酶将微球体细胞吹打成单细胞悬液并计数,加入10%胎牛血清RPMI-1640 重悬成1×105个/mL。上室加入100 μL 细胞悬液,下室加入600 μL 含20% RPMI-1640 培养基,37℃培养箱孵育48 h,去除上室培养液,棉签擦去未侵袭细胞,加500 μL 含0.1%结晶紫于24 孔板中,放入小室,使膜浸入里面,37℃固定染色30 min,PBS 轻轻洗2 遍,倒置风干,倒置显微镜下观察迁移至人工基底膜下的细胞数量,并在200 倍光镜下计数10 个视野细胞数,取平均值。
1.7 Western blot 检测微球体细胞HIF-1a、PDK1及ALDH1A1 蛋白表达
实验分组同前,将微球体细胞悬液低速离心去除上清,分别加入RIPA 裂解液及PMSF,将玻璃匀浆器插入冰中进行匀浆30 min。用移液器将裂解液移至1.5 mL 离心管中,于4℃,12 000 r/min 离心5 min,将上清转移到0.5 mL EP 管中;采用BCA 法进行蛋白定量,将蛋白沸水煮5 min 进行上样,8%SDSPAGE 电泳,于80 V 电压下电泳20 min 至分离胶处,再120 V 电压下电泳约90 min。做“三明治”夹板,采用250 mA 恒流模式下转膜1.5 h。放入20 mL封闭液中,于37℃孵箱中孵育2 h,加入一抗HIF-1a、PDK1 或ALDH1A1(浓度为1∶500),置入4℃孵箱中过夜。次日TBST 洗膜3 次,每次10 min,加人HRP 标记二抗(1∶1 000),37℃孵箱中孵育1.5 h,TBST 洗膜3 次,每次5 min。在ECL 试剂盒显影拍照。以上实验重复3 次,取平均值,以β-actin 为内参,计算目的蛋白相对表达量。
1.8 统计学方法
所有数据采用SPSS 24.0 软件进行统计学分析,计量资料以均数±标准差()表示,两个样本均数比较应用t 检验,计数资料采用χ2检验。相关性分析采用Pearson 关联分析,P < 0.05 为差异有统计学意义。
2 结 果
2.1 化疗后残存乳腺癌组织HIF-1a、PDK1 及ALDH1A1 表达
免疫组化染色结果显示(图1),HIF-1a、PDK1 及ALDH1A1 蛋白均表达于细胞质中,两组呈现出不同程度的棕黄色颗粒,以上3 指标在化疗后残存乳腺癌组织中表达率分别为36.5%、74.5%和49.5%,较化疗前组(16.5%、32.5%和21.5%)明显增高,差异有统计学意义(P < 0.05)。Pearson 关联分析表明,HIF-1a 与ALDH1A1 表达存在显著正相关(χ2= 30.2,P < 0.01, r = 0.7),PDK1 与ALDH1A1 表达也存在正相关(χ2= 21.4, P < 0.01, r = 0.5)。
2.2 化疗后残存乳腺癌组织中BCSCs 微球体分离及培养
显微镜下观察BCSCs 微球体形态学(图2)结果显示:无血清悬浮培养至第5 天,六孔板中散在单个细胞逐渐减少,逐渐形成微球体且微球体直径逐渐增大。培养至第10 天,可见类圆形成熟微球体形成,每个微球体包含数十至数百个细胞,微球体边缘细胞折光性强,微球体可传5~10 代。测量第10 天微球体参数,结果显示化疗前组微球体直径及数量分别为(103.5±2.0)μm 和(2.0±1.0)个,化疗后残存乳腺癌组织组为(220.5±2.5)μm 和(2.0±1.0)个,比较微球体直径,差异有统计学意义(P < 0.05)。
2.3 化疗后残存乳腺癌组织BCSCs 微球体细胞单克隆形成能力
显微镜下观察第10 天BCSCs 微球体大小及数量,评估其单克隆形成能力(图3)。After ch1、After ch2、After ch3 代表化疗后残存乳腺癌组织3 次实验,则形成1 个微球体每孔所需要细胞数为(29.5±1.1)个、(31.3±1.2)个 及(32.2±1.4)个,故BCSCs 平均所占比例为3.3%±0.2%;Before ch1、Before ch2、Before ch3 代表化疗前乳腺癌组织3 次实验,形成1 个微球体每孔所需要细胞数为(60.3±3.2)个、(70.6±2.2)个及(80.5±2.7)个,BCSCs 平均所占比例为(1.4±0.2)%,故化疗后组中BCSCs 含量是化疗前组的2.5 倍,差异有统计学意义(P < 0.05)。

图3 微球体细胞单克隆形成能力直线回归分析Figure 3.Linear Regression Analysis of Clone-Forming Ability of Microspheres.
2.4 化疗后残存乳腺癌组织BCSCs 微球体细胞体外侵袭能力
Transwell 体外侵袭实验显示(图4),来源于化疗前粗针穿刺乳腺癌组织和化疗后残存乳腺癌组织培养的BCSCs 微球体细胞穿过人工基底膜细胞数分别为(22.0±3.0)个及(40.0±4.0)个。与化疗前组相比,化疗后残存乳腺癌组织的BCSCs 微球体细胞穿膜数显著增加,差异有统计学意义(P < 0.05)。
2.5 化疗后残存乳腺癌组织微球体细胞HIF-1a、PDK1 及ALDH1A1 蛋白表达

图5 Western blot 检测两组微球体细胞HIF-1a、PDK1 及ALDH1A1 蛋白表达Figure 5.Expressions of HIF-1a, PDK1 and ALDH1A1 Proteins in BCSCs Microspheres in Two Group Detected by Western Blot
Western blot 凝胶成像条带结果显示(图5),化疗前粗针穿刺乳腺癌组织和化疗后残存乳腺癌组织HIF-1a 蛋白相对表达量为:0.3±0.1 和0.6±0.1;PDK1 蛋 白 相 对 表 达 量 为0.4±0.1 和0.7±0.1;ALDH1A1 蛋白相对表达量为0.2±0.1 和0.6±0.1。与化疗前组相比,化疗后残存乳腺癌组织中HIF-1a、PDK1 及ALDH1A1 蛋白表达均明显增高,差异有统计学意义(P < 0.05)。
3 讨 论
肿瘤干细胞理论认为,肿瘤是由一群功能异质性细胞组成,其中一小部分具有自我更新及多向分化潜能的“干细胞样”肿瘤细胞是肿瘤复发转移根源[6-8]。本课题组前期研究证实,低氧微环境有利于BCSCs 富集,而小分子抑制剂LY294002 能够阻断PI3K/Akt 信号通路并导致低氧下BCSCs 微球体细胞增殖能力降低[9]。最近研究发现,低氧微环境下CSCs 主要依赖糖酵解参与肿瘤能量代谢和维持CSCs 表 型[10-13]。Kim 等[14]发 现ALDH 抑 制 剂DEAB 下调HIF-2a 表达能够抑制小鼠4T1 细胞体外增殖能力和成瘤能力。基于此,本研究拟从低氧微环境角度探讨化疗后残存乳腺癌组织中HIF-1a/PDK1 通路活化是否促进BCSCs 微球体细胞的富集及相关机制。
研究表明,低氧微环境下肿瘤细胞通过HIFs 诱导干细胞相关基因(OCT4、SOX2、Nanog)表达,从而在维持CSCs 表型中发挥关键作用[15]。 Liu 等[16]发现,miR-526b-3p 通过靶向HIF-2a/Notch 信号通路抑制BCSCs 生成和化疗耐药性。而Lu 等[17]发现,HIF-1 和Nanog 通过协同转录机制共同介导BCSCs自我更新。本研究发现化疗后残存乳腺癌组织高表达HIF-1a、PDK1 及ALDH1A1 蛋白,且3 者之间具有显著正相关,提示了化疗后残存乳腺癌组织通过激活HIF-1a 调控的PDK1 糖酵解途径促进BCSCs微球体细胞富集。类似的研究,Lu 等[18]发现,化疗药物促进乳腺癌细胞中CSCs 富集,其机制是HIFs通过调控谷胱甘肽s -转移酶1 表达发挥作用,而抑制该酶表达可降低卡铂诱导的BCSCs 富集,延缓化疗后肿瘤复发。
为验证化疗后残存乳腺癌组织的BCSCs 微球体细胞是否具有自我更新能力和侵袭潜能。本研究通过无血清悬浮培养技术从化疗后残存乳腺癌组织中原代培养BCSCs 微球体,为后续实验奠定基础。无血清悬浮培养被认为是筛选BCSCs 的一种重要方式,本研究组已经掌握该项技术[4]。体外成球实验提示了化疗后残存乳腺组中BCSCs 微球体直径较化疗前组明显增加,考虑与微球体中含有更多处于分化顶层CSCs 有关。体外侵袭实验及有限稀释实验也发现,化疗后残存乳腺癌组织BCSCs 微球体细胞体外侵袭能力和自我更新能力明显增强。这与Li 等[19]研究类似,其发现新辅助化疗后残存乳腺癌组织中微球体细胞成球率更高,富集更多ALDH1A1+/CD24-乳腺癌细胞,而应用拉帕替尼能够降低HER2 阳性乳腺癌患者的BCSCs 比例。
那么,化疗后残存乳腺癌组织中BCSCs 微球体富集过程是否受到HIF-1a/PDK1 信号通路调控?本研究采用Western blot 检测无血清悬浮培养的BCSCs 微球体细胞中HIF-1a 及下游靶蛋白PDK1,并探讨其表达与BCSCs 标志物的ALDH1A1 表达的相关性。结果显示化疗后残存乳腺癌组织中BCSCs微 球 体 细 胞 高 表 达HIF-1a、PDK1 及ALDH1A1 蛋白。这与Peng 等[20]研究一致,其发现PDK1 在BCSCs 中高表达,下调 PDK1 表达与ALDH+亚群及干细胞相关转录因子表达降低有关,最终抑制干细胞微球体形成和肿瘤生长。相反,高水平的 PDK1增强了BCSCs 特性,并与总生存率差相关。
总之,本研究分别从化疗后残存乳腺癌组织和体外培养BCSCs 微球体细胞两方面探讨了化疗药物通过诱导乳腺癌组织中HIF-1a/PDK1 信号通路活化,从而上调CSCs 相关标志物ALDH1A1 蛋白表达,并在维持BCSCs 表型中发挥关键作用,为针对HIF-1a/PDK 信号通路的靶向治疗提供新的线索。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

