针刺调控脑缺血再灌注损伤大鼠海马区环状RNA_009775 表达的研究
向 静,江姗姗,唐 红,汪红娟,李展富,王 瑶,谢灿明,田浩梅,陈楚淘*
湖南中医药大学针灸推拿与康复学院,湖南 长沙 410208
缺血性脑卒中是因脑动脉阻塞引发脑组织受损或死亡,造成相应功能障碍的一类临床常见疾病。 高发病率、高致死率、高致残率是此病的主要特征[1],对家庭及社会造成了沉重的医疗负担。 恢复局部血供是治疗缺血性脑卒中最有效的手段,然而过程中存在再灌注引发局部损伤及中枢神经系统功能障碍加重的风险[2]。 血流的再通导致脑组织功能不可逆损伤的现象,被称为脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)[3],减轻CIRI是缺血性脑卒中整体治疗方案的重要组成部分。 针刺对CIRI 的疗效已逐步被世界范围内的临床及基础研究证实[4-6],其机制与抑制炎症级联反应、减轻过度氧化损伤、调节细胞自噬等方面密切相关[7],但其微观层面的机制仍有待进一步挖掘。
随着新一代测序技术的发展,非编码RNA 对基因及蛋白质表达水平的关键调控作用引起人们的重视[8]。环状RNA(circularRNA,circRNA)具有区别于其他非编码RNA 的闭环结构,该结构可抵抗RNA外切核酸酶,相较于线性RNA 更稳定、更难以被降解。 此外,circRNA 可充当miRNA 结合位点的竞争性内源RNA(competitive endogenous RNA, ceRNA),间接影响miRNA 与下游mRNA 的结合,在调节基因表达中发挥重要作用[9]。 最近研究表明,相较于其他器官,circRNA 在大脑中高度富集[10],可通过介导血管生成、神经炎症、小胶质细胞活化和氧化应激等多种生物学途径,参与中枢神经系统疾病的发生与进展[11-12],提示circRNA 有望成为治疗CIRI 的新靶点。 本研究拟采用基因芯片检测技术,从circRNA 角度阐释针刺抗CIRI 可能的作用机制,为治疗CIRI 提供新的参考依据。
1 材料
1.1 实验动物与分组
SPF 级雄性SD 大鼠39 只,体质量(230±20) g,由湖南中医药大学实验动物中心提供,动物许可证号:SCXK(湘)2019-0004。 所有大鼠饲养于SPF 级实验动物室,室温24~26 ℃,湿度40%~60%,通风,实验期间自由摄水、进食,适应性饲养1 周。 依照随机数字表法将大鼠分为假手术组、模型组、针刺组,每组13 只。实验已通过湖南中医药大学实验动物福利和伦理委员会审查,批准编号:LL2022030912。
1.2 主要试剂与仪器
8×15 K 规格circRNAs 芯片(美国Arraystar 公司,批号:R312-01);circRNA 芯片标记试剂盒(美国Arraystar 公司,批号:Human CircRNA Array V2);(0.32±0.2) mm 线栓(北京西浓科技有限公司,批号:2432-100);0.25 mm×13 mm 针灸针(苏州医疗用品厂有限公司,批号:210501);2%TTC 染液、4%多聚甲醛(北京索莱宝科技有限公司,批号:G3005、P1110);二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量检测试剂盒(武汉赛维尔生物科技有限公司,批号:G2026)。扫描仪(美国Agilent 公司,型号:G250-5C);恒温水浴箱(常州金坛恒丰仪器制造有限公司,型号:HH-W600)。
2 方法
2.1 模型制备
模型组与针刺组采用改良版线栓法[13]制备CIRI模型。 大鼠术前禁食12 h,2%戊巴比妥钠(0.3 mL/100 g)腹腔注射麻醉。以仰卧位固定大鼠于鼠板,局部消毒备皮,取颈正中线偏左侧3 mm 行长约10 mm的纵向切口,钝性剥离左侧颈总动脉(common carotid artery, CCA)、颈内动脉(internal carotid artery, ICA)、颈外动脉与迷走神经;将线栓经CCA 缓送入ICA 以阻断血流,当线栓黑色标记点处于CCA 分叉时固定线栓,消毒缝合切口,对留于切口外的线栓进行固定和标记。完成上述操作2 h 后,将线栓向外抽拉10 mm,实现缺血侧的再灌注。 假手术组不插入线栓,其余操作与上述步骤相同。大鼠清醒后,采用Longa 5 分制评分法[13]对其进行评定,评分1~3 分者纳入后续实验,并对各组缺失大鼠以相同模型制备方法进行数量补齐。
2.2 分组及干预
待所有入组大鼠生命体征平稳(约模型制备后2 h),对其进行捆绑固定。 针刺组取穴参考大鼠穴位图谱[14],选取大椎、百会、水沟穴,大椎直刺3 mm,百会向后平刺2 mm,水沟朝鼻中隔方向斜刺2 mm,行平补平泻捻转手法1 min,频率为90 次/min,间隔15 min 行针1 次,留针30 min;假手术组与模型组仅捆绑不针刺。 每12 h 干预1 次,共7 次。
2.3 神经功能缺损评估
分别于首次干预前、末次干预后,对3 组大鼠采用改良Garcia 评分法[15]综合评估大鼠健侧、患侧比对运动、感觉及自主活动,总分18 分,分值愈低则提示神经功能缺损愈重。
2.4 TTC 染色法
结束末次Garcia 评分后,从每组随机选取5 只大鼠取脑组织,经冷冻30 min 后制成约2 mm 厚的均匀切片,取相邻5 个冠状脑切片浸泡于2%TTC 染液的烧杯中,37 ℃恒温水浴箱遮光孵育30 min,使其染色均匀。 完成染色后,将切片放入4%多聚甲醛固定24 h,观察脑组织梗死情况,通过Image J 软件量化脑梗死面积比。
2.5 筛选核心共同差异表达circRNA
从各组余下大鼠中,随机选取3 只大鼠海马组织,应用Nano Drop 测定评估所提取RNA 的纯度和浓度,使用RNaseR 富集circRNA;随机引物扩增并转录,样本标记并杂交至微阵列载玻片,经孵育、洗涤、固定后,借助G2505C 扫描仪扫描分析切片。 通过Feature Extraction 软件提取芯片数据,Gene Spring软件将数据标准化,参照差异倍数(fold change, FC)>1.25、P<0.05 的标准,筛出差异表达circRNA;而后进行韦恩交集分析,选取针刺组/模型组、模型组/假手术组共同差异表达circRNA(common deferentially expressed circRNA, co-DEcircRNA)。
根据基因芯片表达谱及生物信息学分析结果,以FC>1.25 和基因本体功能富集条目计数前2 为标准,筛选出核心co-DEcircRNA。
2.6 qRT-PCR 验证
对基因芯片检测后余下样本进行核心co-DEcircRNA 表达水平验证。 实验过程严格按照试剂盒说明操作,选择β-actin 作为内参基因,通过2-ΔΔCt法计算其表达量,各引物序列详见表1。

表1 引物序列
2.7 构建circRNA-miRNA-mRNA 三元转录网络
使用TargetScan 结合miRanda 软件,以Seq Mirna Coverage>0.3、CeMirna Coverage>0.3、P<0.05 为标准,预测与核心co-DEcircRNA 可能结合的miRNA及其下游靶基因mRNA,构建ceRNA 网络,通过Cytoscape 3.10 软件将网络可视化呈现。
2.8 靶基因本体功能富集分析
利用在线数据库(http://www.geneontology.org)对circRNA-miRNA-mRNA 网络中的下游靶基因mRNA 进行本体功能富集分析。
2.9 Western blot 法
通过Western blot 法检测海马区神经元生物标记物神经元核抗原抗体(neuron specific nuclear protein, NEUN)相对表达量。 各组余下的5 只大鼠海马组织加入蛋白提取液,匀浆及冰浴30 s/次,组织裂解后取上清液,BCA 蛋白定量检测试剂盒进行目标蛋白定量。 将同等浓度的蛋白上样,凝胶电泳使蛋白与样本分离,并转移至PVDF 膜,而后加一抗4 ℃孵育过夜,次日清洗后加二抗室温下孵育1 h,使用化学发光检测试剂盒进行可视化。 Image J 软件分析各条带灰度值,以GAPDH作为参照计算NEUN 相对表达量。
2.10 统计学分析
数据通过SPSS 25.0 软件进行统计学分析。 符合正态分布的资料以“±s”表示,组内比较采用配对t 检验,组间比较采用单因素方差分析,方差齐者采用LSD 法,方差不齐者使用Tamhane's T2 法。 不符合正态性分布则以“M(Q)”进行描述,组内比较使用配对秩和检验,组间比较采用非参数检验。 均以P<0.05 为差异有统计学意义。
3 结果
3.1 各组大鼠干预前后Garcia 评分比较
干预前,与假手术组相比,模型组和针刺组Garcia评分明显降低(P<0.01)。 干预后,与假手术组相比,模型组评分明显降低(P<0.01);与模型组相比,针刺组评分显著升高(P<0.01)。 干预后,针刺组Garcia 评分较干预前显著升高(P<0.01)。 详见表2。
表2 各组大鼠干预前后Garcia 评分比较(分,±s)

表2 各组大鼠干预前后Garcia 评分比较(分,±s)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与干预前比较,&&P<0.01。
组别假手术组模型组针刺组n 13 13 13干预前18.00±0.00 9.85±1.95**11.54±1.66**干预后18.00±0.00 9.92±1.19**13.62±1.50##&&
3.2 各组大鼠缺血侧梗死面积比比较
TTC 染色结果如图1 所示,假手术组未见梗死区域;模型组、针刺组切片均呈现不同程度的梗死区域。 通过Image J 软件与Swanson 法量化脑梗死面积比,相较于假手术组,其余两组脑梗死面积比显著升高(P<0.01);相较于模型组,针刺组脑梗死面积比显著降低(P<0.01)。 详见表3。

图1 各组大鼠脑组织TTC 染色
表3 各组大鼠缺血侧梗死面积比(%,±s)

表3 各组大鼠缺血侧梗死面积比(%,±s)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01。
组别假手术组模型组针刺组n555脑梗死面积比0 24.14±4.97**15.01±2.50**##
3.3 各组大鼠缺血侧海马组织circRNA 差异表达谱及差异表达circRNA 数量
基于基因芯片检测结果,根据FC>1.25、P<0.05的标准筛选组间差异表达circRNA,差异表达谱详见图2。 模型组与假手术组比较,差异表达circRNA为603 个;针刺组与模型组比较,差异表达circRNA为51 个。 模型组/假手术组、针刺组/模型组co-DEcircRNA 为23 个,在模型组中上调、针刺组下调的co-DEcircRNA 为7 个,在模型组中下调、针刺组上调的co-DEcircRNA 为16 个。 详见图3。

图2 各组大鼠circRNA 差异表达谱

图3 各组大鼠缺血侧海马组织差异表达circRNA 韦恩图
3.4 核心co-DEcircRNA 的筛选
以P<0.05、FC>1.25 为标准,对co-DEcircRNA基因本体功能富集的条目进行计数,经筛选,circ_009775确定为核心co-DEcircRNA。 详见表4。
3.5 qRT-PCR 验证核心co-DEcircRNA 表达水平
与假手术组比较,模型组大鼠缺血侧海马区circ_009775 表达量明显降低(P<0.01);与模型组比较,针刺组circ_009775 表达量显著上升(P<0.01)。详见表5。
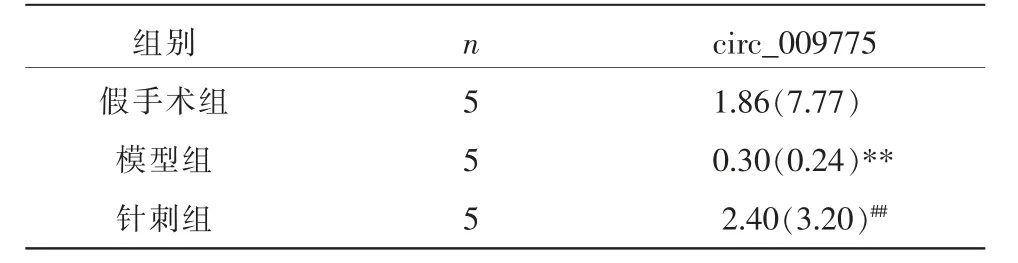
表5 各组大鼠缺血侧海马组织circ_009775 表达水平的比较[M(Q)]
3.6 构建circRNA-miRNA-mRNA 三元转录网络
采用TargetScan 与miRanda 软件,预测与circ_009775 可结合的miRNA 以及下游靶基因mRNA,使用Cytoscape 3.10 软件绘制构建了含有1 个circRNA、12 个miRNA、31 个mRNA 的三元转录网络。详见图4。

图4 circRNA-miRNA-mRNA 三元转录网络
3.7 靶基因GO 功能富集分析
以P<0.05 为标准,对31 个靶基因进行GO 功能富集分析,发现富集的生物进程主要为神经系统发育、神经元生成等;细胞成分主要为细胞质、细胞器、突触等;分子功能主要为蛋白质结合、微管结合、酶结合等。 详见图5。

图5 靶基因GO 功能富集分析
3.8 各组大鼠缺血侧海马区NEUN 表达比较
与假手术组比较,模型组大鼠缺血侧海马组织NEUN 表达水平显著降低(P<0.01);与模型组比较,针刺组NEUN 表达水平上调(P<0.05)。 详见表6、图6。

图6 各组大鼠缺血侧海马区NEUN 蛋白电泳图
表6 各组大鼠缺血侧海马区NEUN 相对表达量的比较(±s)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05。
组别假手术组模型组针刺组n555 NEUN/GAPDH 0.66±0.10 0.31±0.19**0.55±0.21#
4 讨论
在全球范围内,缺血性脑卒中占比脑卒中发病率的87%左右[1],CIRI 通常继发于缺血性脑卒中,是引起脑组织损伤与功能障碍进一步恶化的关键环节。尽管药物与介入治疗取得了一定成效,但仍存在治疗窗口狭窄、增加出血风险性等局限性[16-17]。 这促使我们深入了解CIRI 的发生发展机制,寻找有效、安全的治疗策略。 中医学将CIRI 归于“中风”范畴,多因风、火、痰、瘀等病邪上扰清窍,导致脑络痹阻、神失其用,病位在脑。针刺作为治疗“中风”的主要手段之一,已有数千年历史。“病变在脑,首取督脉”,脑为元神之府,督脉入络脑,大椎、百会、水沟皆属督脉,三穴合用可调神导气以醒脑开窍,是治疗缺血性脑卒中的常用腧穴[18]。 课题组前期研究表明,针刺大椎、百会、水沟穴可缓减神经元超微结构的病理改变,促进神经元的修复,激活血管内皮生长因子,诱导血管新生,从而在一定程度上减轻CIRI[19]。本研究结果提示,针刺可改善CIRI 大鼠Garcia 神经功能评分、降低缺血侧的脑梗死面积、促进神经元发育,这与先前研究报道一致[20]。
近年来研究发现,circRNA 在CIRI 发生与进展中均有异常表达,常通过ceRNA 机制途径影响CIRI 进程[21]。CHEN 等[22]研究表明,circSHOC2 在体外氧-糖剥夺缺血模型与大脑中动脉闭塞小鼠模型中的过表达,可通过海绵miR-7670-3p 促进去乙酰化酶1 的表达,进而减轻缺血诱导的神经元凋亡。 此外,BAI等[23]通过基础与临床研究发现,circDLGAP4 作为内源性miR-143 海绵抑制其活性, 调节HECT-E3 型泛素连接酶的表达水平, 以减轻CIRI 对血脑屏障的损伤。 本研究中,通过芯片检测技术发现3 组大鼠海马区circRNA 表达的改变,其中23 个circRNA共同在模型组/假手术组、针刺组/模型组中发生了改变,提示针刺对CIRI 的治疗机制可能与这类基因的表达变化相关。 而后qRT-PCR 法对筛选出的核心co-DEcircRNA 验证结果显示,circ_009775 的表达趋势与芯片结果一致,提示针刺对circ_009775 的上调涉及抗CIRI 过程,是可能的治疗靶点之一。为明确circ_009775 潜在的分子调控机制, 本研究预测并构建了circRNA-miRNA-mRNA三元转录网络,对下游mRNA 的GO 功能富集结果显示其与神经系统发育、神经元生成等生物进程密切相关。 良好的神经元发育是CIRI 后神经功能恢复的必要条件,本研究中对神经元生物标记物的检测显示, 针刺组NEUN 表达水平明显高于模型组, 说明针刺具有一定的神经元保护作用,与上述GO 功能富集分析有一致的部分。
综上所述,本研究从circRNA 的角度阐释了针刺抗CIRI 的另一潜在效应机制,可能与激发多种ciriRNA 的改变有关,通过介导以circ_009775 为中心的circRNA-miRNA-mRNA 三元转录网络,调控神经系统发育、神经元生成过程发挥其治疗效应,从而改善CIRI 大鼠的神经功能缺损、缩小脑梗死面积、促进CIRI 海马区的神经元修复,为揭示针刺多靶点、多途径治疗CIRI 的作用机制提供了理论依据。

