卡培他滨致手足综合征严重程度与血浆中炎症因子含量的分析
刘艳平,王志鹏,崔莉莉,许封菁,张蒙伟,高守红 (.海军军医大学附属长征医院药学部, 上海 200003;2.宜春学院化学与生物工程学院, 江西 宜春 336000)
结直肠癌,又称大肠癌,好发于大肠黏膜,是常见消化系统恶性肿瘤,早期症状不明显不易发现,晚期则表现贫血、体重减轻等。由于现代生活节奏加快及各种不良饮食、作息、环境和遗传等因素的影响,使得我国的发病率逐年增加[1]。据《中国肿瘤登记年报》内容显示:2015 年我国肿瘤登记地区结直肠癌发病率和病死率分别为17.1/10 万和7.9/10 万,发病率男女性别比和城乡比分别为1.5 和1.4,病死率分别为1.6 和1.4。与年报数据接近的《中国死因监测数据集》显示,2017 年我国结直肠癌病死率为6.9/10 万[2]。虽然,目前已有各种化疗、外科手术、中医治疗等诊治方法,但是仍然存在早期诊查率低、预后差等问题,患者术后5 年的生存率仍没有得到较大的改善,故针对结直肠癌的诊疗研究亦成为现在的热点[3]。
卡培他滨(Cap)是结直肠癌辅助化疗及一线治疗药物,通常与多西他赛、奥沙利铂、爱必妥等联合应用,常见结直肠癌化疗方案是联合奥沙利铂。Cap 是前体药,体内转化成氟尿嘧啶,并在肿瘤组织中代谢为5-氟尿嘧啶,从而抑制核苷酸的合成,发挥抗肿瘤作用。肿瘤组织中5-氟尿嘧啶的浓度是血液中的100 倍以上,靶向性好,不良反应轻微,且大部分患者都可耐受[4]。手足综合征(HFS)是服用Cap 后出现的常见药物不良反应,多为1~2 级,少数达到3 级。临床主要表现为进展性症状变化,早期症状主要发生在手掌和足底,出现不同程度的瘙痒,指尖、手掌和足底充血,之后会持续发展为手掌和足底的暗红和肿胀,随后产生水泡,最终发展为脱皮,极大影响患者用药依从性及生存质量,成为后期持续治疗效果不佳的严重因素之一[5]。Cap 导致HFS 的发病机制尚不清楚,但病理特征表现为不同程度的细胞点片坏死、轻度的海绵状水肿、血管扩张、表皮与真皮交界处有炎性渗出。有研究表明[6-8],显微镜镜下观察到血管舒张和水肿,类似于炎症反应,而炎症发生时,活跃的炎症因子主要有白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23,肿瘤坏死因子(TNF-α)、干扰素(IFNγ)、C-反应蛋白(CPR)以及趋化性细胞因子(CCL-5)。因此,本研究对出现HFS 的结直肠癌患者血浆中的主要炎症因子进行考察,推测其中涉及到的炎症因子,建立炎症因子含量变化与HFS 发生的相关性,为Cap 发生HFS 的防治提供一定参考。
1 材料和方法
1.1 一般资料
选取2018 年9 月至2019 年2 月海军军医大学附属长征医院普外科接受卡培他滨化疗方案的35 例结直肠癌患者作为本次研究对象。纳入标准:①年龄≥18 周岁;②经临床确诊为结直肠癌的患者;③接受了以Cap 为基础的化疗;④预计生存期≥3 个月,无主要器官的功能障碍;⑤有化疗指证,包括心肝肾等脏器功能正常,骨髓造血功能正常;⑥治疗前病情评估应有完整的体格检查和实验室检查,包括全血细胞计数、生化功能检查等;⑦生活质量:首次出现先写中文名(KPS)评分≥60 分;⑧自愿签署知情同意书。排除标准:①孕、哺乳期患者;②5 年内患过其他恶性肿瘤者;③经临床确定,对FU 类药物过敏或严重代谢不良的患者;④有严重感染的患者;⑤经临床确定,患有其他会影响实验结果的恶性疾病;⑥不符合纳入标准,未按规定用药,无法判断疗效,或资料不全等影响疗效或安全性判断者。HFS 事件评价标准:根据美国卫生及公共服务部2009 年出版的常见不良反应事件评价标准4.0(CTCAE v4.0)分级,1 级:轻微皮肤改变或皮肤炎(红斑、水肿、角化过度、不痛);2 级:皮肤改变(剥落、水泡、出血、肿胀、角化过度),疼痛,影响工具性日常生活活动;3 级:重度皮肤改变(剥落、水泡、出血、水肿、角化过度),疼痛,个人自理能力受限。自患者服用Cap 后进行临床观察,直到患者出现HFS 后停止,收集患者出现HFS 时的血液样本,采用EDTA-3K 抗凝管采集血样,储存于-80 ℃冰箱冻存。本研究经过海军军医大学附属长征医院伦理委员会批准,35 例患者基本信息及HFS 信息见表1。
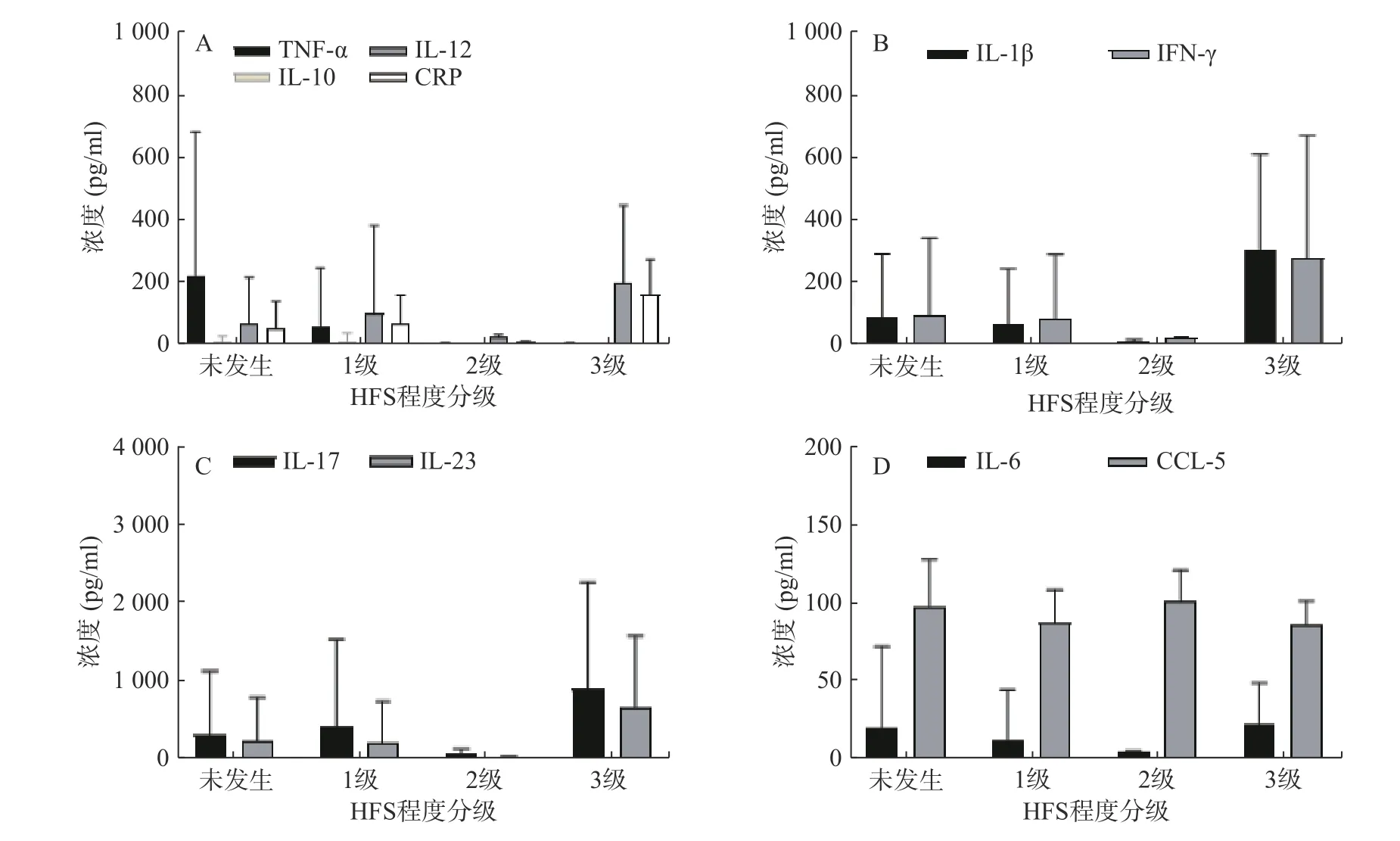
图1 样本中各个炎症因子含量检测结果分布情况
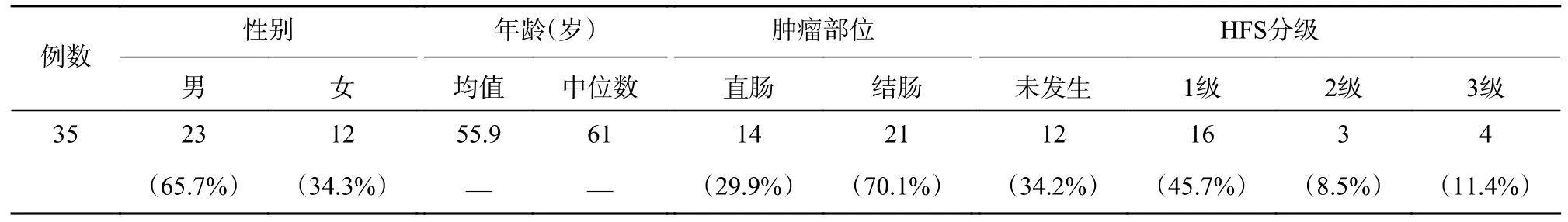
表1 患者一般资料及HFS 分级情况
1.2 仪器和耗材
Human IL-6 ELISA kit 试剂盒、 Human IL-1β ELISA kit 试 剂 盒、Human IL-10 ELISA kit 试 剂盒、Human IL-12p70 ELISA kit 试剂盒、Human IL-17/IL-17A ELISA kit 试剂盒、Human IL-23 ELISA kit 试剂盒、Human IFN-γ ELISA kit 试剂盒、Human CRP ELISA kit 试剂盒、Human TNF-α ELISA kit试剂盒以及Human RANTES ELISA kit 试剂盒均购自国润医疗供应链服务(上海)有限公司。酶标仪(Biotek,型号:800TSI)购自美国伯腾仪器(北京代表处)有限公司。37 ℃孵箱(型号:FYL-YS-151L,温度:0 ℃~100 ℃)由北京福意电器有限公司提供。
1.3 炎症因子指标检测方法
参照试剂盒说明书测定35 例结直肠癌患者服用卡培他滨后血浆中各炎症因子包括白介素类中的IL-1β、IL-6、IL-10、IL-12、IL-17、IL-23, TNFα,IFN-γ,CPR 和CCL-5 含量水平。将血液样本4 000 r/min 离心15 min, 收集血浆样本,按照试剂盒说明书测定各炎症因子的含量。
1.4 统计学方法
使用 Microsoft Excel 软件进行统计结果分析,采用Graphpad Prism 8.3.0 作图。
2 结果
2.1 标准曲线
IL-23 标准曲线的浓度为2 000、1 000、500、250、125、62.5、31.25 pg/ml;IFN-γ、IL-17、TNF-α、IL-12 标准曲线的浓度为1 000、500、250、125、62.5、31.25、15.6 pg/ml;CCL-5、IL-1β 的标准曲线的浓度为500、250、125、62.5、31.25、15.6、7.8 pg/ml;IL-6、CRP 的标准曲线的标准品浓度为200、150、50、25、12.5、6.25、3.125 pg/ml;IL-10 的标准曲线的浓度为50、25、12.5、6.25、3.125、1.56、0.78 pg/ml。各炎症因子标准曲线呈现良好线性关系,可为样本的检测提供阳性对照,见表2。
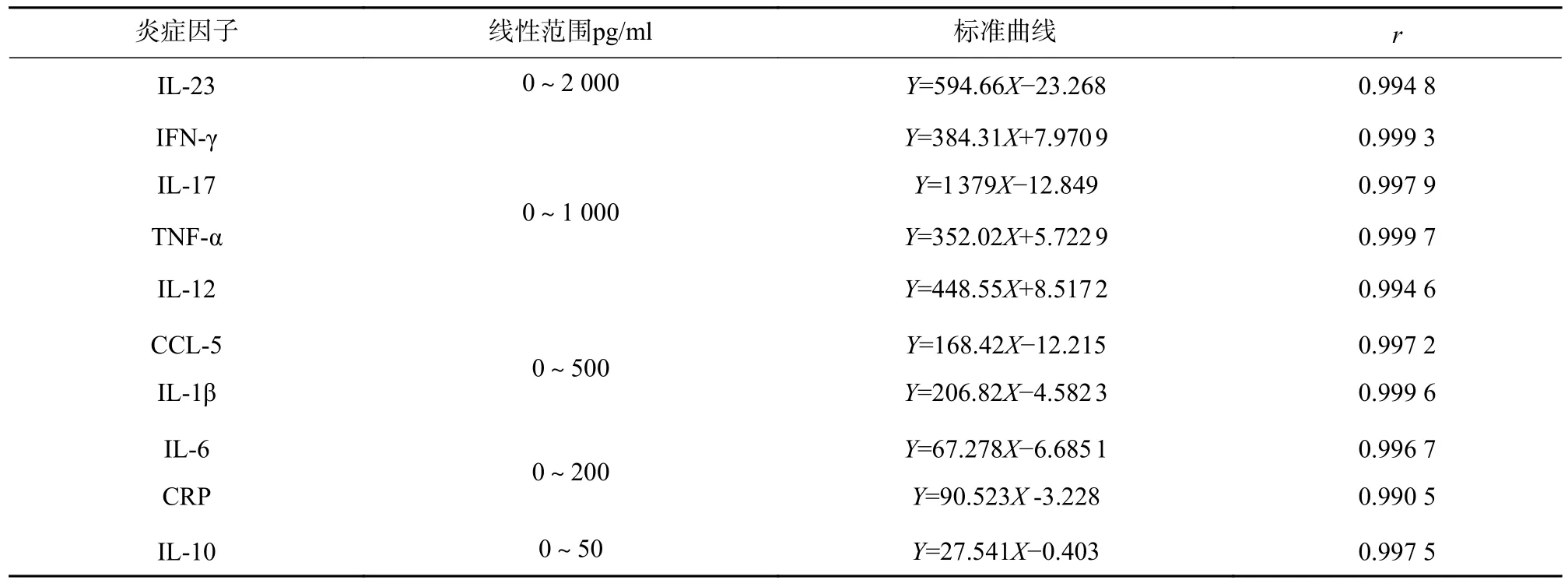
表2 炎症因子线性范围及标准曲线
2.2 样本实测
35 例服用Cap 后未发生与发生各级HFS 的两类结直肠癌患者,其血浆中各炎症因子含量水平见表3。结果显示,不同级别的HFS 各炎症因子含量存在一定的差异性,提示Cap 诱发HFS 会导致血浆中不同炎症因子相互作用发生级联反应。其中,TNF-α 的含量水平在发生HPS 呈整体下调状态,且明显低于未发生者的含量水平。其余炎症因子含量水平变化则无规律可循(图1)。
表3 不同分级HFS 患者中的各炎症因子含量测定结果(pg/ml, ±s)
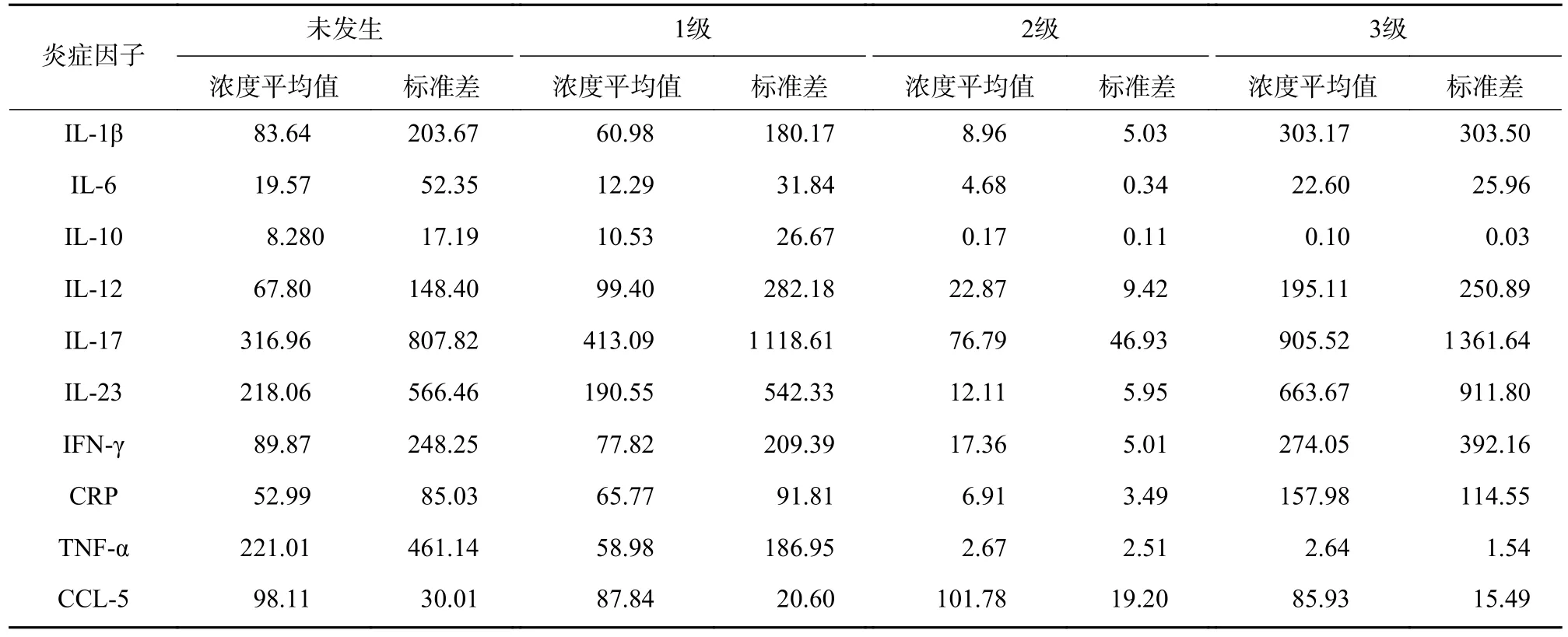
表3 不同分级HFS 患者中的各炎症因子含量测定结果(pg/ml, ±s)
注:未发生HFS 12例;1级HFS 16例;2级HFS 3例;3级HFS 4例
炎症因子未发生 1级 2级 3级浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差 浓度平均值 标准差IL-1β 83.64 203.67 60.98 180.17 8.96 5.03 303.17 303.50 IL-6 19.57 52.35 12.29 31.84 4.68 0.34 22.60 25.96 IL-10 8.280 17.19 10.53 26.67 0.17 0.11 0.10 0.03 IL-12 67.80 148.40 99.40 282.18 22.87 9.42 195.11 250.89 IL-17 316.96 807.82 413.09 1 118.61 76.79 46.93 905.52 1 361.64 IL-23 218.06 566.46 190.55 542.33 12.11 5.95 663.67 911.80 IFN-γ 89.87 248.25 77.82 209.39 17.36 5.01 274.05 392.16 CRP 52.99 85.03 65.77 91.81 6.91 3.49 157.98 114.55 TNF-α 221.01 461.14 58.98 186.95 2.67 2.51 2.64 1.54 CCL-5 98.11 30.01 87.84 20.60 101.78 19.20 85.93 15.49
3 讨论
随着结直肠癌发病率的上升,Cap 的临床应用越来越广泛,其带来的不良反应也急剧增加,其中,HFS 严重影响患者生活质量以及用药依从性,更甚者则终止治疗,故必须对Cap 诱发HFS 进行药学监护[9-10]。临床常见的监护策略主要有减少给药剂量、中断药物治疗以及使用其他药物(如塞来昔布胶囊200 mg,po,bid +尿素乳膏涂抹患处,tid)干预HFS 严重程度等方法。肿瘤坏死因子(TNF-α)是机体重要的炎性细胞因子之一,具有多生物学效应及生理病理性功能,且TNF-α 在HFS 发生的不同程度时血浆中含量有显著变化,推测TNF-α 血浆中含量水平越低发生HFS 的程度越严重,并在进行药学监护时具有一定参考价值。
本实验以HFS 为主要研究方向,对患者血浆中炎症因子进行检测,结果发现Cap 诱发不同程度HFS 血浆中的炎症因子含量有一定的差异性。由于临床化疗治疗医生很少让患者的HFS 进展到2、3 级再进行处理,所以患者例数较少,数据不能支撑比较。但对未发生与1 级HFS 比较发现,1 级HFS 患者血浆中IL-1β、IL-6、IL-23、IFN-γ、TNF-α、CCL-5 的含量明显低于未发生HFS 患者;而IL-10、IL-12、IL-17、CRP 血浆中含量明显高于未发生HFS 患者,且TNF-α 浓度水平变化较为明显。目前,Cap 诱发HFS 的发生机制尚不清楚,可能是多途径炎症因子相互作用的结果。因此,关注定血浆炎症因子含量水平变化,在一定程度上可以反应Cap 诱导HFS 的严重程度,通过测定血浆中炎症因子含量的变化,有利于防治Cap 诱发HFS情况,并对临床有重要的指导意义。

