黄瓜连作对根际土壤微生物群落结构的影响
乔蓬蕾,李玉明,王 谨,曲伟华,于 宝
(1.莱阳市农业技术推广中心,山东莱阳 265200;2.莱西市农业技术推广服务中心,山东莱西 266600)
设施生产规模化发展迅速,商品化生产使设施内土地复种指数高,因连作严重导致的土壤劣化明显,严重影响了设施农业可持续发展[1]。黄瓜(Cucumis sativusL.)是保护地生产中种植面积居首位的蔬菜,因此黄瓜的连作障碍问题越来越受到人们重视[2]。
连作障碍是指同一地块在正常栽培管理条件下连续多茬种植同一作物或近缘作物而导致的一系列品质变劣、病虫害加剧、产量降低等生长问题[3]。连作障碍可以通过清洁田园、合理施肥、选用抗性品种、生物防治、填闲和伴生、轮作等措施来缓解[4,5],但导致连作障碍的主导因素或真正原因暂无定论。学者们越来越重视从土壤微生物群落及其重要的生理功能角度揭示连作障碍发生的原因,但对于连作导致的土壤微生物群落变化的认识尚不统一。多数学者认为,连作后土壤菌群结构破坏严重,有害微生物菌群增加,有益微生物菌群减少[4,6-8]。也有学者认为,微生物能够通过调整结构适应外部环境的变化,如形成抑菌土,从而保持长期健康的群落结构[9,10]。本研究利用巢式PCR 变性梯度凝胶电泳(Nested PCR-DGGE)技术分析黄瓜根际土壤芽孢杆菌、假单胞菌菌群结构不同连作茬次的变化,以期为探讨黄瓜连作障碍中发生微生物变化提供科学依据。
1 材料与方法
1.1 供试土样
土样45 份,取自东北农业大学设施园艺与蔬菜生理生态实验站,分为连作1、3、5、7、9 茬(连作茬次不同),每茬次黄瓜种植后30、40、50 d 的土样各3 份(即3 次重复),于-80 ℃冰箱保存。
1.2 变性梯度凝胶电泳分析
1.2.1 土壤总DNA 的提取 用试剂盒Power Soil DNA Isolation Kit(MO BIO Laboratories,CA,USA)提取黄瓜根际土壤总DNA(方法参照说明书)。
1.2.2 PCR 反应体系及条件 假单胞菌特异性巢式引物序列如下:PCRPs-for/Ps-rev(GGTCTGAGAGG ATGATCAGT/TTAGCTCCACCTCGCGGC)、338f-GC/518r (CGCCCGCCGCGCGCGGCGGGCGGGGCGGG GGCACGGGGGGACTCCTACGGGAGGCAGCAG/ATTACCGCGGCTGCTGG)[11,12]。
第一轮反应:4 μL 模板,25 μL PCR Mix(Tian-Gen),各20 μL 去离子水,引物各0.5 μL,反应体系50 μL。反应采用降落PCR,95 ℃预变性5 min;95 ℃变性1 min,66 ℃至56 ℃每个循环降0.5 ℃退火30 s,72 ℃延伸1 min,20 个循 环;95 ℃变性50 s,56 ℃退火30 s,72 ℃延伸1 min,15 个循环;最后72 ℃延伸10 min。选取3 μL 反应产物用琼脂糖凝胶(1%)进行电泳检测(扩增片段长度约为960 bp)。
第 二 轮 反 应:5 μL 10×Buffer,4 μL dNTPs(2.5 mmol/L),4 μL Mg2+(25 mmol/L),引物各1 μL,1 μL Taq 酶(TianGen),1 μL 模板,33 μL 去离子水,反应体系50 μL。条件为94 ℃预变性5 min;94 ℃变性1 min,65 ℃退火1 min,72 ℃延伸50 s,32 个循环;最后72 ℃延伸15 min。取3 μL 用琼脂糖凝胶(1%)进行电泳检测(扩增片段长度为240 bp 左右)。
芽孢杆菌特异性巢式引物序列如下:BacF/1378R(GGGAAACCGGGGCTAATACCGGAT/CGGTGTGTACAAGGCCCGGGAAC)、968F-GC/1378R(CG CCCGGGGCGCGCCCCGGGCGGGGCGGGGGCA CGGGGGGAACGCGAAGAACCTTAC/CGGTGTGTACAAGGCCCGGGAACG)[13]。
第一轮反应:4 μL 模板,25 μL PCR Mix(Tian-Gen),引物各1 μL,19 μL去离子水,反应体系50 μL。反应条件为94 ℃预变性5 min;94 ℃变性1 min,65 ℃退火1.5 min,72 ℃延伸1.5 min,26 个循环;最后72 ℃延伸10 min。取3 μL 用琼脂糖凝胶(1%)进行电泳检测(扩增片段长度约1 300 bp)。
第二轮反应:4 μL 模板,25 μL PCR Mix(Tian-Gen),引物各0.5 μL,20 μL 去离子水,反应体系50 μL。反应条件为94 ℃预变性5 min;94 ℃变性1 min,69 ℃退火1 min,72 ℃延伸1 min,2 个循环;94 ℃变性1 min,67 ℃退火1 min,72 ℃延伸1 min,2 个循环;94 ℃变性1 min,65 ℃退火1 min,72 ℃延伸1 min,2 个循环;94 ℃变性1 min,63 ℃退火1 min,72 ℃延伸1 min,22 个循环;最后72 ℃延伸10 min。取3 μL 用琼脂糖凝胶(1%)进行电泳检测(扩增片段长度约为445 bp)。
1.2.3 变性胶的制备 制备8%的聚丙烯酰胺凝胶,从胶上方向下方变性剂浓度依次递增,100%变性剂为40%去离子甲酰胺和7 mol/L 尿素混合物,芽孢杆菌及假单胞菌的变性剂浓度分别为45%~65%和40%~75%。待胶完全凝固后在每孔的上样量为15 μL,用夹子将胶板夹好,放入装有缓冲液的电泳槽中。利用Bio-Rad 公司的D-code System 仪器进行电泳,时间12 h,温度60 ℃,电压70 V,卸下凝胶用Gelred 染色20~30 min,蒸馏水洗涤5 min,使用Canoco for Windows 5、BIO-RAD 的凝胶成像分析系统和Quantity One 软件进行分析。
1.3 数据分析处理
用Excel 2010软件进行数据整理分析,用Biodap软件进行多样性指数分析,用SAS 9.1.3 软件进行方差分析,用Canoco for Windows 4.5 软件进行主成分分析,用Bio-Rad Quantity one 4.5 软件对DGGE 指纹图谱进行数字化、标准化分析。
2 结果与分析
2.1 黄瓜连作对根际土壤芽孢杆菌群落结构的影响
2.1.1 芽孢杆菌菌群结构的DGGE 图谱及主成分分析 种植后30 d,各茬次间条带没有明显差异(图1a);5 茬散点与其他各茬距离较远(图1b)。

图1 黄瓜种植后30 d 不同连作茬次芽孢杆菌菌群结构DGGE 图谱(a)、主成分分析(b)
种植后40 d,各茬次间条带无明显差异(图2a);5、7 茬的散点距离较近,而与其他茬次距离相对较远(图2b)。
种植后50 d,各茬次间条带没有明显差异(图3a);7茬散点与其他茬次距离较远(图3b)。

图3 黄瓜种植后50 d 不同连作茬次土壤芽孢杆菌菌群结构DGGE 图谱(a)、主成分分析(b)
2.1.2 芽孢杆菌DGGE 图谱的条带数和多样性指数分析 条带数1 茬在种植后30 d 显著高于其他茬次,1 茬的均匀度指数和香农多样性指数显著高于9 茬(表1);种植后40 d,5 茬条带数显著高于其他茬次,而7 茬条带数显著高于1、3、9 茬,9 茬条带数显著高于1、3 茬,均匀度指数和香农多样性指数5、7 茬显著高于1 茬。种植后50 d,香农多样性指数、均匀度指数、条带数各茬次之间差异均未达到显著水平(P>0.05)。
2.2 黄瓜连作对根际土壤假单胞菌菌群结构的影响
2.2.1 假单胞菌菌群结构的DGGE 图谱及主成分分析 种植后30 d,上部和下部无明显差异,中部各茬次间可以看出差异(图4a)。5 茬的散点离其他各茬较远(图4b)。
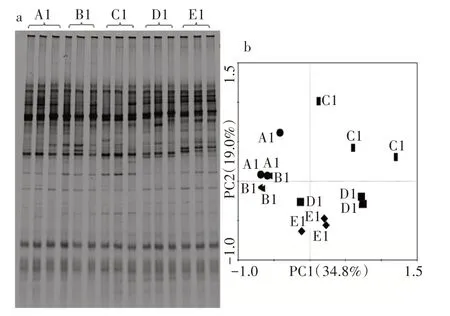
图4 黄瓜种植后30 d 不同连作茬次假单胞菌菌群结构的DGGE 图谱(a)、主成分分析(b)
种植后40 d,7 茬条带与其他各茬次有明显差异(图5a)。3、7茬的散点距离其他各茬较远(图5b)。

图5 黄瓜种植后40 d 不同连作茬次假单胞菌菌群结构的DGGE 图谱(a)、主成分分析(b)
种植后50 d,各茬之间条带差异明显(图6a)。主成分分析能够区分开各茬次,1、7 茬的散点与其他各茬距离相对较远(图6b)。

图6 黄瓜种植后50 d 不同连作茬次假单胞菌菌群结构的DGGE 图谱(a)、主成分分析(b)
2.2.2 假单胞菌DGGE 图谱的条带数和多样性指数分析 种植后30 d,条带数5、7茬显著高于3茬(表2),香农多样性指数、均匀度指数5 茬均显著高于3 茬。种植后40 d,条带数7 茬显著高于1、3、9 茬,而5 茬与其他各茬之间差异均不显著;均匀度指数、香农多样性指数7 茬显著高于其他茬次。种植后50 d,5茬的条带数显著低于除3 茬外的其他茬次,3 茬的条带数显著低于7 茬,香农多样性指数7 茬显著高于3茬和5 茬;7 茬均匀度指数显著高于3 茬(P<0.05)。

表2 黄瓜连作对土壤假单胞菌多样性指数和DGGE 图谱条带数的影响
3 小结与讨论
连作会导致土壤中根际生态环境恶化,拮抗菌的菌群结构发生变化,有害菌株增加,而有益菌株减少[14,15]。有研究表明,连作可能没有持续破坏微生物群落结构,长期连作促进了抑菌土的形成[16]。试验选用Nested PCR-DGGE 技术研究了黄瓜连作后土壤假单胞菌菌群、芽孢杆菌结构的变化。结果表明,在5、7 茬主成分分析显示菌群结构表现出不同,多样性较高。已有研究显示,7 茬黄瓜出现明显的生长障碍[17],到9 茬又有所好转。随着连作茬次的增加,当土壤中病原菌达到一定量后,作物会通过调整根系分泌物来增加有益微生物的数量,从而抑制病原菌[9,10],所以当7 茬出现明显连作障碍后,黄瓜根际土壤中芽孢杆菌、假单胞菌多样性开始升高,群落结构表现出不同。在黄瓜种植后3 个时期,芽孢杆菌的条带数没有明显一致的变化规律。胡元森等[18]研究表明,黄瓜不同生长时期条带数目稳定,农田微生物区系组成稳定;但霍琳等[19]认为,黄瓜不同生长时期土壤中微生物数量的变化趋势不同。试验结果与之一致,黄瓜不同生育期之间,随着连作茬次的增加,假单胞菌多样性的变化趋势不同,芽孢杆菌亦是如此。受外界因素刺激,植物可以通过改变其根系分泌物的含量及组分对根际微生物产生不同的影响。植物可以分泌特定的根系分泌物来选择根际周围的微生物,黄瓜在不同生育期假单胞菌及芽孢杆菌的多样性水平及菌群结构变化趋势不同,可能与黄瓜生长过程中根系活力及其根系分泌物变化有关[20,21]。
用Nested PCR-DGGE 方法探索黄瓜连作对根际土壤微生物菌群的影响,结果表明,芽孢杆菌菌群、假单胞菌菌群的结构被改变了,但黄瓜不同生育期,菌群结构及多样性变化不同,主要表现为5、7 茬与其他茬次不同。假单胞菌和芽孢杆菌主要在5、7茬表现出较高的多样性,说明黄瓜连作并没有持续破坏微生物群落结构。通过进一步研究连作条件下根系分泌物变化对土壤微生物活性和功能的影响,对解决连作障碍具有重要意义。

