2 个烟草青枯病菌菌株的致病力差异与基因组比较分析
管成伟,胡利伟,冯小虎,张超群,秦言敏,张志高,王利兵
(1.江西省烟草科学研究所,江西 南昌 330002;2.中国烟草总公司郑州烟草研究院,河南 郑州 450001;3.江西省烟草公司抚州市公司,江西 抚州 344000;4.抚州市烟草公司黎川分公司,江西 抚州 344600)
【研究意义】青枯病菌也叫青枯雷尔氏菌(Ralstonia solanacearum),是引发青枯病的病原菌,具有侵染力强、寄主范围广的特点,目前已知能够侵染50 多科200 多种作物,烟草就是其中之一。青枯病菌还有明显的生理分化现象[1-2],来源于不同地区和不同寄主植物的病原菌在寄主范围、致病力和菌系特性等方面差异很大[3-4]。我国烟草青枯菌属于生理小种1、生化型III 和IV,且均属于演化型I[4]。尽管我国烟草青枯菌的生理小种、生化型及演化型等群体结构较为单一,但同一演化型的青枯菌致病力也存在较大差异[5-10],给青枯病的防治带来很大困难。截至目前,针对烟草青枯病防治,国内尚未有较为广泛有效的技术方法。因此,了解烟草青枯菌致病力差异的内在基础,对于探索更有针对性的防控措施、提高烟草青枯病的防治效果具有重要意义。【前人研究进展】烟草青枯病菌的致病力不但与温度、湿度、pH 值以及营养条件等环境因素密切相关,还与病原菌的内在编码基因有关,其中主要的内在编码基因有III 型和VI 型分泌系统、胞外多糖(Extracellular polysaccharide,EPS)合成、鞭毛合成等基因(簇)[3-4,11]。目前已经有包括GMI1000 在内的多个青枯菌株系的基因组测序已经完成,通过基因组比较发现,不同青枯病菌细胞内部的巨大质粒上携带着大量特有的基因,大小变异幅度达到26%[4,12-13],这些特有基因赋予不同青枯病菌株不同的生理特性和侵染能力。【本研究切入点】虽然众多研究学者已证实青枯病菌株的致病力差异主要与编码III 型和VI 型分泌系统、胞外多糖合成、鞭毛合成等基因(簇)有关,但由于青枯病菌之间遗传物质变化和差异大,同一区域内关系相近的青枯病菌株在致病力和基因序列方面仍存在不同,这些内在差异直接影响青枯病防治药剂的防治效果。因此,比较不同致病力青枯病菌菌株之间基因序列上的差异,探索针对青枯病菌的遗传差异的防治药剂和技术,对提高青枯病防效具有重要意义。【拟解决的关键问题】本研究从江西抚州广昌县头陂镇和南丰县太源乡种植的云烟87 上分离得到2 株序列变种为13 的青枯病菌,为首次在江西抚州地区发现能够侵染烟草的青枯病菌序列变种13[14]。通过对2 株致病力有差异的菌株进行基因组测序,比对其编码基因和编码蛋白的差异,探索2 株菌株之间致病力差异的内在基础,以期为根据致病力差异制定防治措施、开发针对性青枯病防治药剂、提高防治烟草青枯病防治效果提供理论参考。
1 材料与方法
1.1 青枯病菌的分离与鉴定
青枯病菌菌株RsTP2 和RsTY2 于2016 年7月分别分离自抚州市广昌县和南丰县的发病烟草植株。将采集的青枯病烟草植株茎杆于室内切成5 cm 长的茎段,置于盛有湿纱布的塑料袋内3~5 h,将溢出的白色菌液挑入盛有 2~3 mL 无菌水试管中研磨制成菌悬液,静置15 min 后用移菌环移取菌悬液并在牛肉膏蛋白胨选择培养基平板上划线[15](选择培养基含放线菌酮50 mg/L、氯霉素10 mg/L 和硫酸多粘菌素B 10 mg/L),28 ℃恒温培养48 h,挑取2 个单菌落进行纯化,分别命名为RsTP2 和RsTY2,于4 ℃冰箱内斜面保存备用。采用青枯病菌种特异引物对759/760 对菌株RsTP2 和RsTY2 的egl基因片段进行PCR 鉴定[14],同时将菌株RsTP2 和RsTY2 置于中国工业微生物保藏中心(http://www.china-cicc.org/)保藏,保藏号分别为CICC24306 和CICC24305。
1.2 侵染试验
将青枯病菌株接入LB 液体培养基(胰蛋白胨10 g/L、酵母提取物5 g/L、氯化钠10 g/L)中,30 ℃、200 r/min,过夜培养至浑浊状态,离心后菌体采用无菌水重悬,采用紫外分光光度计检测菌液浓度,菌液稀释至1.0×108CFU/mL 用于侵染试验。
侵染试验在郑州烟草研究院温室进行。测试品种为当地主栽品种云烟87,该品种对青枯病抗性为中感。当云烟87 苗龄4~5 周时,采用伤根灌菌液法分别接种1.0×108CFU/mL 的青枯病菌液,以清水处理为对照,每个处理侵染36 株苗。28~30 ℃条件下培养2 周后调查发病情况,病情指数和发病率调查按照国家标准 GB/T23222-2008进行。
1.3 青枯病菌基因组DNA 提取
青枯病菌基因组的提取采用Ezup 柱式细菌基因组DNA 抽提试剂盒(生工生物工程(上海)股份有限公司)进行,提取方法参照试剂盒说明书进行操作。提取的DNA 可立即进行下一步实验或-20 ℃保存。
1.4 青枯病菌基因组测序
采用Covaris ME220(美国Covaris 公司)将提取的DNA 片段化打断,以Agencourt AMPure XP 核酸纯化试剂盒(德国Beckman Coulter 公司)将破碎后的DNA 片段浓缩回收。使用Next®Ultra™ DNA 文库制备试剂盒(英国NEB 公司)进行建库和连接接头,磁珠分选纯化连接产物,接着采用Next Q5 Hot Start HiFi PCR 预混液(英国NEB 公司)进行文库的扩增和扩增产物磁珠纯化,使用Qubit®2.0(美国Invitrogen 公司)进行文库浓度测定,使用Agilent 2100 生物分析仪(美国Agilent 公司)进行文库长度分布检测,采用Hiseq XTen 平台(美国Illumina 公司)进行测序。
1.5 基因序列的生物信息学分析与基因注释
获得测序数据后,采用FastQC 软件对原始数据进行质量评估,过滤处理后使用IDBA_UD对各样本有效序列进行拼接组装[16-17],获得contigs,综合评定多个Kmer 的组装结果,采用Prodigal 对最佳拼接结果进行ORF 预测[18],并将长度≥100 bp 的基因翻译成氨基酸序列。采用CD-HIT 软件对基因预测结果进行去冗,获得非冗余基因集[19]。采用Bowtie2 将各样本序列比对到非冗余基因集序列上[20-21]。将获得的基因和蛋白序列与相关数据库(包括NR)进行比对,获得基因的功能及物种注释信息[22-24]。
2 结果与分析
2.1 菌株RsTP2 和RsTY2 的分离与鉴定
菌株RsTP2和RsTY2的PCR鉴定结果如图1,其扩增产物出现在青枯病菌预期位置(281 bp),同时将其回收纯化送生工生物工程(上海)股份有限公司进行测序,序列比对结果表明其均为青枯病菌。将菌株RsTP2 和RsTY2 的egl基因扩增测序结果提交NCBI 数据库,获得编号分别为MG669274 和MG669275,将其与亚洲分支序列变种12、13、15、17、34 和44 等序列变种egl基因进行比对分析,MG669274 和MG669275 序列与来自序列变种13 菌株JT523 的AF295252 序列相似度为100%,确定菌株RsTP2 和RsTY2 均为亚洲分支演化型I 中的序列变种13(图2)。

图1 菌株RsTP2 和RsTY2 的PCR 鉴定结果Fig. 1 PCR identification results of strains RsTP2 和RsTY2

图2 菌株RsTP2 和RsTY2 与相关序列变种egl 序列的系统发育分析Fig. 2 Phylogenetic analysis based on egl gene sequences of strains RsTP2 and RsTY2 with related sequence variants
2.2 菌株RsTP2 和RsTY2 对云烟87 的致病力测试
将浓度为1.0×108CFU/mL 的菌株RsTP2 和RsTY2 菌液以伤根灌菌液法接种云烟87,2 周后调查发病率和病情指数。结果(图3)显示,未接种青枯病菌的对照烟苗生长正常,未发生青枯病;而接种菌株RsTP2 的云烟87 烟苗叶片基本上全部凋萎,发病率为100%、病情指数达76.9;接种菌株RsTY2 的云烟87 烟苗发病率为100%、病情指数达35.6。由此表明,菌株RsTP2和RsTY2 对云烟87 的致病力有显著差异,菌株RsTP2 致病力较强,菌株RsTY2 致病力较弱。

图3 云烟87 接种菌株RsTP2 和RsTY2 的发病情况Fig. 3 Disease incidence of Yunyan 87 inoculated with strains RsTP2 and RsTY2
2.3 菌株RsTP2 和RsTY2 的基因组测序
将菌株RsTP2 和RsTY2 进行基因组测序,总共获得785 MB 和787 MB 数据,其Clean Data Q30(%)分别为92.52%和92.23%,基因组框架图总共获得5.43 MB 和5.23 MB,分别预测编码基因4 967 和4 801 个,平均基因长度分别为965和970 bp(表1)。测序数据已上传至NCBI,菌株RsTP2 和RsTY2 基因组序列登记号分别为SAMN35628657 和SAMN35628658。
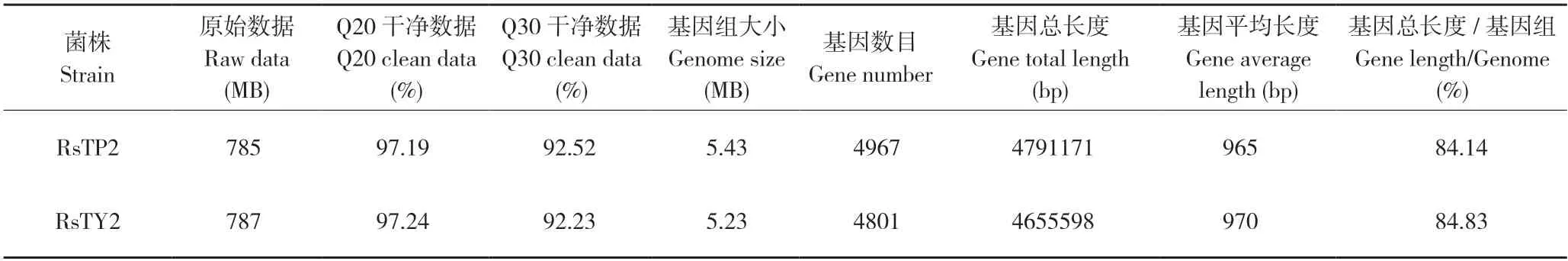
表1 菌株RsTP2 和RsTY2 的基因组测序数据Table1 Genome sequencing data of strains RsTP2 and RsTY2
2.4 菌株RsTP2 和RsTY2 的差异基因筛选
为探究菌株RsTP2 和RsTY2 致病力差异的分子机制,对两者的差异基因进行筛选,将菌株RsTP2 和RsTY2 编码基因的蛋白序列进行BLASTP 分析,结果表明菌株RsTY2 有52 个蛋白序列与菌株RsTP2 的44 个蛋白存在差异,其相似度在50.00%~99.88%。基于生物学过程的GO分析结果表明,其差异基因更多地参与含氮化合物代谢、杂环化合物代谢、芳香族化合物代谢、蛋白定位与细胞运输等过程(图4)。其中,凝集素(Hemagglutinin)类蛋白数量最多,RsTY2有10 个蛋白,菌株RsTP2 有9 个蛋白,其序列相似度在55.00%~99.61%;其次是细胞溶素分泌激活蛋白(Family hemolysin secretion activation protein),在菌株RsTP2 和RsTY2各有4个蛋白序列差异较大;穿孔素家族蛋白(Phage holin family protein)在两者之间也存在较大差异,各有4 个蛋白序列差异较大(表2)。

表2 菌株RsTP2 和RsTY2 差异基因比对情况Table 2 Differential genes alignment between strain RsTP2 and RsTY2

图4 基于生物学过程的菌株RsTP2 和RsTY2 差异基因GO 分析Fig. 4 GO analysis of strains RsTP2 and RsTY2 differential genes based on biological processes
2.5 菌株RsTP2 和RsTY2 凝集素家族的系统发育分析
将菌株RsTP2 和RsTY2 的差异凝集素蛋白进行比对后构建系统发育树,结果(图5)表明,以0.5遗传距离进行划分,可以将其分成a~h 共8 个亚类,其中d 亚类和g 亚类包含凝集素蛋白最多、分别为3 个和4 个,其他亚类均为2 个。可见,凝集素蛋白在菌株RsTP2 和RsTY2 之间差异蛋白较多、序列差异较大,可能是其致病力差异的因素之一。

图5 菌株RsTP2 和RsTY2 的凝集素基因遗传多样性分析Fig. 5 Genetic diversity analysis of lectin genes in strains RsTP2 and RsTY2
3 讨论
烟草青枯病菌具有很强的侵染性,目前已知能够侵染450 余种寄主植物,其致病性主要与编码III 型和VI 型分泌系统、胞外多糖合成、鞭毛合成等基因(簇)有关[4]。然而,即使同属于一个亚型或序列变种的青枯病菌,不同菌株之间的致病性仍然存在较大差异。Remenant 等[25]从泛基因组学的角度对6 个基因组的比对结果显示,青枯菌核心基因组的权重仅占28%,非必需基因组占35%,各菌株拥有数量不等的菌株特异基因,因此,各菌株独有的特异基因可能是导致菌株间致病力差异较大的重要原因[26]。
本研究从江西抚州广昌县头陂镇和南丰县太源乡等地种植的云烟87 上均分离到青枯雷尔氏菌菌株RsTP2 和RsTY2,egl测序表明其为亚洲分支序列变种13,侵染试验表明菌株RsTP2 对云烟87 致病力较强、菌株RsTY2 致病力较弱。分析两者基因组序列发现,菌株RsTY2 的52 个蛋白序列与RsTP2 菌株的44 个蛋白存在差异,其相似度在50.00%~99.88%之间,其中凝集素类蛋白数量最多,其次是细胞溶素分泌激活蛋白和穿孔素家族蛋白。编码凝集素的基因广泛存在于动植物病原菌中,如青枯雷尔氏菌的基因组中就有27 个与凝集素相关的编码基因,这些基因编码的蛋白主要作用是促使病原菌附着到寄主细胞表面[27-28],已有研究证明其在青枯雷尔氏菌(R.solanacearum)[12]、百日咳杆菌(Bordetella pertussis)[29]、流感嗜血杆菌(Haemophilus inf luenzae)[30]、苛养木杆菌(Xylella fastidiosa)[31]等致病菌侵入寄主细胞中起着重要作用。细胞溶素对致病菌在寄主细胞表面的黏连和侵染、寄主组织中细胞间的生存及毒力发挥方面起着重要作用,而细胞溶素分泌激活蛋白可促进细胞溶素的分泌、进而促进侵染发生[32-33]。穿孔素(Holin)可协助自溶素(Autolysin) 作用于宿主细胞的细胞壁,并通过切割肽聚糖聚合物中的各种键来发挥作用,具体作用取决于自溶素的类型[34-35]。由此可见,凝集素、细胞溶素分泌激活蛋白和穿孔素家族蛋白等与青枯病菌的侵染能力和致病能力高度相关。
4 结论
本研究从广昌县头陂镇和南丰县太源乡的青枯病发病烟株上分离到青枯雷尔氏菌菌株RsTP2和RsTY2,egl测序证明其为亚洲分支序列变种13,侵染试验表明菌株RsTP2 对云烟87 致病力较强、菌株RsTY2 致病力较弱。通过对比属于同一序列变种、但致病力存在差异的2 株青枯病菌RsTP2 和RsTY2 基因序列,发现菌株RsTY2 的52 个蛋白序列与菌株RsTP2 的44 个蛋白存在差异,其相似度在50.00%~99.88%。差异基因更多地参与含氮化合物代谢、杂环化合物代谢、芳香族化合物代谢、蛋白定位与细胞运输等过程。其中,编码凝集素类蛋白数量差异最大,其次是细胞溶素分泌激活蛋白和穿孔素家族蛋白,这3 类蛋白与青枯病菌的吸附侵染能力相关性较高。凝集素类蛋白、细胞溶素分泌激活蛋白和穿孔素家族蛋白3 类基因编码的蛋白序列差异可能是导致RsTP2 和RsTY2 致病力差异的重要原因。

